外周血淋巴细胞亚群在小儿肺炎合并急性呼吸窘迫综合征中的变化及临床价值
2021-04-06陈伟莉林海郭仁铭林敏
陈伟莉 林海 郭仁铭 林敏
福建省妇幼保健院儿童重症医学科,福州 350001
小儿肺炎是儿科常见的一种呼吸道感染性疾病,当其进展为ARDS 时,具有较高的病死率。ARDS 占全球ICU 入院患者的10%,病死率持续超过40%[1],虽然与成人相比,收住PICU 患儿发生ARDS 比例相对较低,但病死率达20%~62%,而且儿童ARDS 的病死率并未如成人那样有显著降低的趋势[2]。小儿肺炎诱发的ARDS 较肺外因素导致的ARDS 在病理、临床表现、影像学改变及肺力学等方面更为复杂,有更为显著的异质性[2]。ARDS 核心的环节是炎症反应失衡导致了肺泡上皮或血管内皮的损害,从而导致富含蛋白质的水肿液进入肺泡[3]。ARDS 发生机制复杂,涉及诸多机制,越来越多的研究表明免疫反应为其重要发病机制之一,受到多种免疫细胞及免疫分子通路的调控[4]。目前ARDS 的炎症微环境及免疫调节机制是研究热点,但对于小儿肺炎进展为ARDS 过程中的免疫功能变化文献鲜有报道。本研究探讨了小儿肺炎和肺炎合并ARDS 时外周血淋巴细胞亚群的变化,并分析其与病情严重程度的关系,以期探索该过程免疫功能的变化,为临床诊疗提供参考。
1 对象与方法
1.1 研究对象 本研究病例资料来源于2017 年1 月至2019 年12 月入住本院PICU 的肺炎合并ARDS 患儿55 例,选取同期本院呼吸内科病房收治的小儿肺炎51 例。纳入标准:小儿肺炎及重症肺炎纳入标准参照第8 版《诸福棠实用儿科学》[5];ARDS 诊断标准及严重程度评判标准参照2015 年儿童急性肺损伤共识会议所提出的新诊断标准[6-7]。肺炎合并ARDS组根据诊断后24 h氧合指数最差值分为轻度组(13 例)、中度组(24 例)、重度组(18 例)3 个亚组。排除标准:有围产期的相关肺部疾病患儿;原发或继发免疫缺陷或正在使用免疫抑制剂;先天性心脏病或呼吸道发育不良或胸廓发育畸形的患儿;罹患恶性肿瘤、慢性肾脏病患;活动性结核感染的患儿;重度营养不良的患儿。本研究通过本院医学伦理委员会批准。
1.2 资料采集 在确诊小儿肺炎和肺炎合并ARDS 的第1 d 采集患者空腹外周静脉血3 ml,用流式细胞技术检测血清淋巴细胞计数及淋巴细胞亚群(包括CD3+T 细胞、CD4+T 细胞、CD8+T 细胞、CD4+/CD8+、CD19+B 细胞、CD16+CD56+NK细胞)。同时收集患儿入院当天白细胞计数、外周血淋巴细胞计数。
1.3 检测仪器和试剂 流式细胞术仪器采用美国BD公司BO CantoⅡ三激光8色流式分析仪,抗体及溶血素均为美国BD公司产品。
1.4 统计学分析 采用SPSS17.0 软件进行统计学分析。所有计量资料行正态性检验,符合正态分布的计量资料以均数±标准差()表示,组间比较采用t 检验和方差分析;不符合正态分布的计量资料以中位数(四分位数)[M(QL,QU)]表示,组间比较采用Mann-Whitney U 检验和Kruskal-Wallis 检验;计数资料组间比较采用χ2检验;P<0.05为差异有统计学意义。
2 结 果
2.1 小儿肺炎组和肺炎合并ARDS 组比较 患儿性别、年龄、体质量、白细胞计数、CD4+/CD8+比较,差异均无统计学意义(均P>0.05);肺炎合并ARDS 组淋巴细胞计数、CD3+T 细 胞 计 数、CD4+T 细 胞 计 数、CD8+T 细 胞 计 数、CD19+B 细胞计数、CD16+CD56+NK 细胞计数低于小儿肺炎组,差异均有统计学意义(均P<0.05),见表1。
2.2 肺炎合并轻度ARDS、肺炎合并中度ARDS 组、肺炎合并重度ARDS 组比较 不同严重程度患儿CD3+T 细胞计数、CD4+T 细胞计数、CD8+T 细胞计数、CD4+/CD8+比较,差异均有统计学意义(均P<0.05),且CD3+T 细胞计数、CD4+T 细胞计数、CD8+T 细胞计数水平在肺炎合并重度ARDS 组最低,肺炎合并中度ARDS 组次之,肺炎合并轻度ARDS 组最高;3 组患者CD19+B 细胞计数、CD16+CD56+NK细胞计数比较,差异均无统计学意义(均P>0.05),见表2。
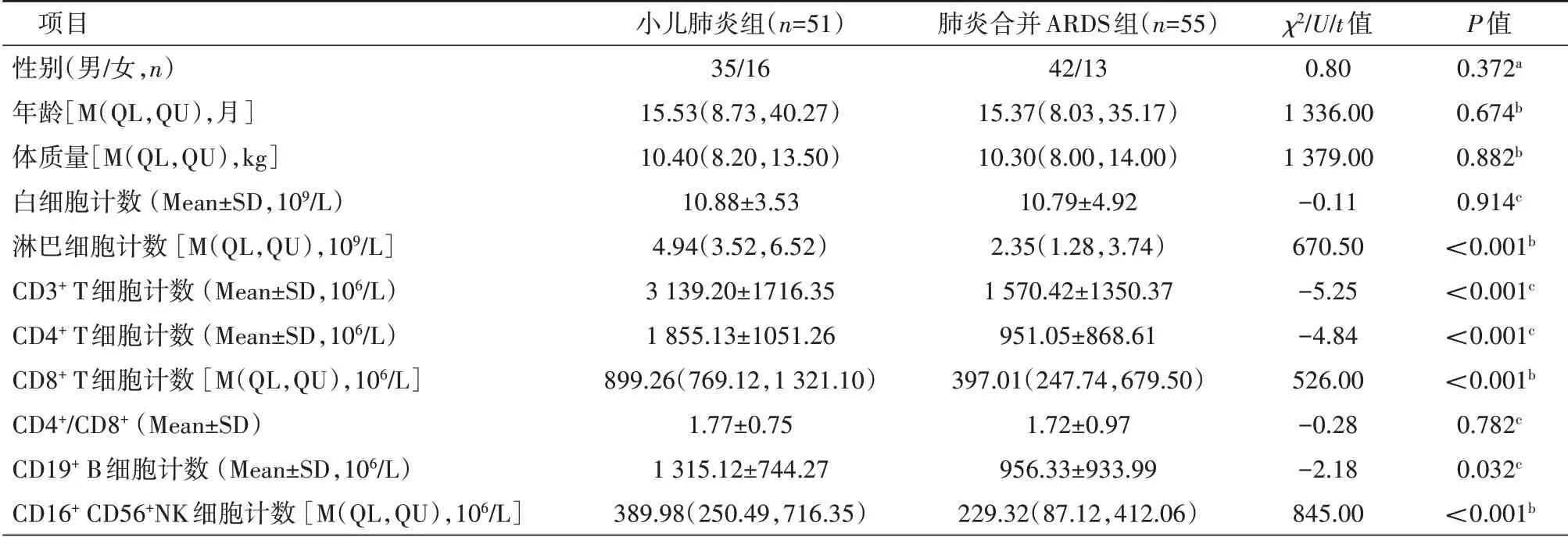
表1 小儿肺炎和肺炎合并ARDS组资料比较

表2 肺炎合并ARDS不同严重程度的活化淋巴细胞亚群水平比较
3 讨 论
虽然小儿肺炎是儿科的常见病,临床治疗大多数预后良好,但当其进展为重症肺炎、ARDS时,则具有较高的病死率。有研究表明,肺炎患者会出现不同程度的免疫失衡[8-9]。从小儿肺炎进展为重症肺炎以及ARDS,除了和年龄、病原体、合并症、先天性免疫缺陷等相关外,和机体本身对病原体的免疫反应可能相关,且可能影响患者的临床表现、病情严重程度和预后[10]。当ARDS 时,大量免疫细胞、中性粒细胞等被激活并趋化至肺泡,导致肺泡上皮和毛细血管内皮受损,肺泡内富含蛋白质的液体积聚。越来越多研究发现,ARDS这一非单一固定因素造成的综合征与多种炎性细胞相互作用有密切关系。正是由肺脏结构或功能细胞、免疫细胞(T 细胞、B 细胞、NK 细胞等)、巨噬细胞、中性粒细胞等及其分泌(或趋化)的细胞因子/炎症介质所共同构成的“炎症微环境”,在ARDS 发生、发展过程中发挥重要而复杂的调控作用[11-12]。临床上常用糖皮质激素、免疫球蛋白等免疫调控来治疗ARDS,但其结果仍有争议,影响其临床应用的主要难点是可能获益人群的筛选和治疗时机的选择[13]。鉴于免疫反应的复杂性,以及其在ARDS发病过程中的重要作用,如能更好地对其进行监控,评估机体的免疫状态,再进行精确的调控,势必会改善ARDS患者的预后。因此深入了解肺炎所致ARDS的免疫功能的变化及与病情严重程度的相关性,将为临床治疗决策提供有价值的参考。
ARDS可由肺内和肺外等多种因素导致,不同原因引起的ARDS 病情的演变和病死率不尽相同。目前,通过临床数据研究肺炎所致ARDS 这一人群的免疫功能变化鲜有报道。本研究通过外周血的淋巴细胞亚群分析其免疫功能的变化,淋巴细胞亚群根据表面抗原可分为T 细胞、B 细胞和NK 细胞,可监测免疫系统功能状态。T 细胞亚群是细胞免疫功能的重要指标,包括CD3+T细胞、CD4+T细胞、CD8+T细胞。CD3+在所有T 细胞表达,CD3+T 细胞代表全部T 细胞。CD4+T细胞是参与细胞免疫的主要细胞,可分为辅助T细胞和调节性T 细胞。CD4+T 淋巴细胞是发挥核心作用的一类免疫细胞,能帮助B 细胞产生抗体,增强和维持CD8+T淋巴细胞的反应及调节巨噬细胞功能,以调节或抑制自身免疫反应。CD4+T 淋巴细胞也是免疫记忆的重要介质,其数量减少或功能失去时,机体易感性增加,甚至可重新激活休眠病毒或机会性细菌感染。CD8+T细胞分为抑制性T细胞(Ts)、细胞毒性T 细胞(Tc),前者抑制免疫,使淋巴细胞增殖呈自限性变化,后者发挥细胞毒作用,直接杀伤靶细胞,表现出双向性改变。活化的B 细胞是抗原提呈细胞,可激活T 细胞,促进其增殖活化。CD56+NK 细胞分泌自然杀伤因子,是第一响应细胞,在机体免疫监视和早期抗感染免疫过程中起重要作用[14-17]。
本研究发现肺炎合并ARDS组总淋巴细胞计数、CD3+T细胞、CD4+T细胞、CD8+T细胞、B细胞、NK细胞均低于肺炎组,表明肺炎进展至ARDS 时出现了免疫功能抑制甚至免疫麻痹状态。在病情严重评估方面,随诊病情严重程度增加,CD3+T 细胞、CD4+T 细胞、CD8+T 细胞逐渐下降,表明T淋巴亚群可反映ARDS 病情严重程度,推测ARDS 病情加重和细胞免疫的失调相关,T 淋巴细胞亚群可作为评估ARDS病情严重程度的指标。
既往对ARDS 免疫机制的研究通常采用动物模型和对肺泡组织局部免疫细胞的浸润情况来研究[10,12,18],而ARDS涉及全身炎症反应,若能通过外周血情况了解其免疫状态,将对临床的应用有更大帮助。Buttenschoen K 等[19]对23 例ARDS 患者进行分析,发现ARDS 患者外周血单核细胞释放的细胞因子减少。回顾既往文献,通过外周血淋巴细胞亚群分析ARDS 病情严重程度的相关报道较少。黄大伟和孙金燕[17]报道指出不同程度ARDS的成人患者的CD3+、CD4+、CD8+T 细胞水平比较,差异均有统计学意义,重度ARDS 患者的上述指标水平最低;存活组的CD3+、CD4+、CD8+T 细胞水平明显高于死亡组。畅毅平等[20]对34例ARDS成人患者研究报道,发现早期ARDS 患者外周静脉血清CD3+、CD4+T细胞和CDl9+B 明显低于健康对照组,中度组患者外周静脉血清CD3+、CD4+、CD8+T 细胞和CDl9+B 水平明显高于重度组;存活组患者CD3+、CD4+、CD8+T 细胞和CDl9+B 细胞水平明显高于死亡组;该学者认为早期ARDS 患者外周血CD3+、CD4+、CD8+T 细胞和CDl9+B 细胞水平有助于评估ARDS 严重程度和预测其预后。但上述研究的对照组均为成人健康体检患者,未探讨肺炎与肺炎合并ARDS 的免疫功能变化,对此,本课题组做了相关研究分析。
本文也存在不足之处:首先,本研究为单中心回顾性研究,样本量较少。二是CD4+、CD8+T细胞更细分的亚群及功能变化有待进一步探讨。三是未能动态连续监测免疫指标的变化,无法获取连续变化的资料。
总之,不同人群、不同原因的ARDS 可能涉及不同的发病机制和免疫机制,本研究发现小儿肺炎进展致ARDS 过程中出现了免疫功能抑制,随着病情加重,T 淋巴细胞亚群水平逐步降低,T 细胞亚群有助于评估小儿肺炎合并ARDS病情严重程度。
利益冲突:作者已申明文章无相关利益冲突。
