五子衍宗丸对化疗性肠黏膜炎小鼠的保护作用及其机制研究*
2021-04-06周卫东卢汉祺陈泽伟田春阳孙晓敏赵晓山
周卫东 卢汉祺 陈泽伟 田春阳 孙晓敏 赵晓山 谭 为
目前对化疗引起的肠黏膜炎治疗手段有限,主要为止吐、抑酸、饮食干预,及谷氨酰胺、益生菌等对症治疗,但其预防或者治疗胃肠道黏膜炎效果有限[1-4]。
5-HT3受体拮抗剂是临床常用的止吐药,有研究表明,雷莫司琼对化疗引起的胃肠道黏膜炎效果有较好的治疗效果[5,6],本研究拟采用5-FU诱导小鼠小肠炎模型,通过五子衍宗丸(WYP)与雷莫司琼(RAM)疗效效果进行比较,以探索WYP治疗化疗性肠道黏膜炎效果,并对其抗炎机制进行初步分析,现报道如下。
1 材料与方法
1.1 材料
1.1.1 药品和试剂枸杞子(宁夏,广东健禾药业有限公司,批号:110801);盐菟丝子(山东,广东和翔制药有限公司,批号:111101);覆盆子(浙江,广东三信药业有限公司,批号:110901);炒车前子(江西,广东健禾药业有限公司,批号:110901);制五味子(产地:山西广东天诚中药饮片有限公司,批号111002);5-FU(上海旭东海普药业有限公司,批号:FA140518);肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、ELISA试剂盒 ( R&D,美国);Tunel试剂盒(Roche,瑞士)等。
1.1.2 实验动物7周龄SPF级雄性BALB/c小鼠,体质量18~22 g(由广东医学实验动物中心提供,许可证号:SCXK(粤)2013-0002)。实验前所有小鼠适应性喂养7 d,室温22~26 ℃,相对湿度40%~60%,明暗交替12 h,自由饮水、采食。实验动物室保持安静,实验过程中对动物的处置符合动物伦理学标准。
1.2 方法
1.2.1 五子衍宗丸的制备五子衍宗丸混悬剂的制备方法为:将枸杞子、盐菟丝子、覆盆子、炒车前子烘干,取枸杞子40 g,盐菟丝子40 g,覆盆子20 g,炒车前子10 g及制五味子5 g,混合,粉碎至过120筛目的粉末,充分拌匀,分别取1.5 g,0.76 g,0.38 g粉末,加入0.5%羧甲基纤维素钠(CMC-Na)20 ml制备成悬浊液,备用[7]。
1.2.2 分组和给药方法小鼠随机分为正常组、对照组、雷莫司琼(RAM)组、五子衍宗丸高剂量(HWYP)组、五子衍宗丸中剂量(MWYP)组、五子衍宗丸低剂量(LWYP)组,每组10只。对照组、RAM组、HWYP组、MWYP组和LWYP组给予腹腔注射5-FU(mg·kg-1),第1次给药记为给药第0天,每天上午8:00给药,每天1次,连续给药5次,正常给药相应体积pH=7.4的PBS;HWYP组、MWYP组、LWYP组每次分别给予灌胃WYP 0.75 g·kg-1、0.38 g·kg-1、0.19 g·kg-1,RAM组给予灌胃RAM 0.1 g·kg-1,每天上午9:00给药及下午17:00给药各1次,从5-FU给药前2天开始给药,连续7 d,正常组和对照组给予灌胃相应体积的0.5%羧甲基纤维素钠。
1.3 观察指标
1.3.1 体质量情况给药第0天开始测量体质量,体质量的改变通过体质量分数表示:体质量分数=第n天的体质量×100/第0天的体质量。
1.3.2 腹泻给药第0天开始观察大便的情况。腹泻症状评分:0分,正常;1分,微湿;2分,中等湿度;3分,松散便;4分,水样便[4]。
1.3.3 组织学评价麻醉小鼠,打开腹腔,取新鲜的小鼠空肠组织,4 %多聚甲醛溶液固定24 h,行脱水、透明、浸蜡、包埋组织,病理切片用苏木精-伊红染色(HE),镜下观察。通过测量的空肠绒毛长度、隐窝深度、空肠绒毛长度/隐窝深度比值来评价其形态学的改变。
1.3.4 炎症因子蛋白含量的测定将空肠组织3 g,加4℃生理盐水,使用匀浆器匀浆后,在低温离心机 3000 r/min 离心15 min,取上清液。含量测定方法严格按TNF-α、IL-6和 IL-1β试剂盒说明书操作。
1.3.5 凋亡指数分析按TUNEL试剂盒说明书方法操作:取石蜡切片脱蜡至水、修复、破膜、加试剂1(TdT)与试剂2(dUTP)、阻断内源性过氧化物酶、加试剂3、DAB显色、复染细胞核、脱水封片。Image pro-plus 6.0软件分析荧光tunel凋亡图片方法:每组内每张切片从扫描结果上在相同倍数下进行采图,应用Image-Pro Plus 6.0软件对每张照片进行分析得出每张照片阳性细胞的比率(阳性细胞数/总细胞数)即为细胞凋亡率。
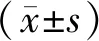
2 结果
2.1 小鼠体质量变化给药第1天起,对照组小鼠体质量百分比相对正常组出现显著下降;给药后第3天,MWYP组体质量百分比较对照组明显更高(P<0.05);而到第5天,HWYP组、MWYP组、LWYP组、RAM组比对照组体质量均明显更高(P<0.05或P<0.01);MWYP组比LWYP组体质量百分比明显更高(P<0.05)。见图1。
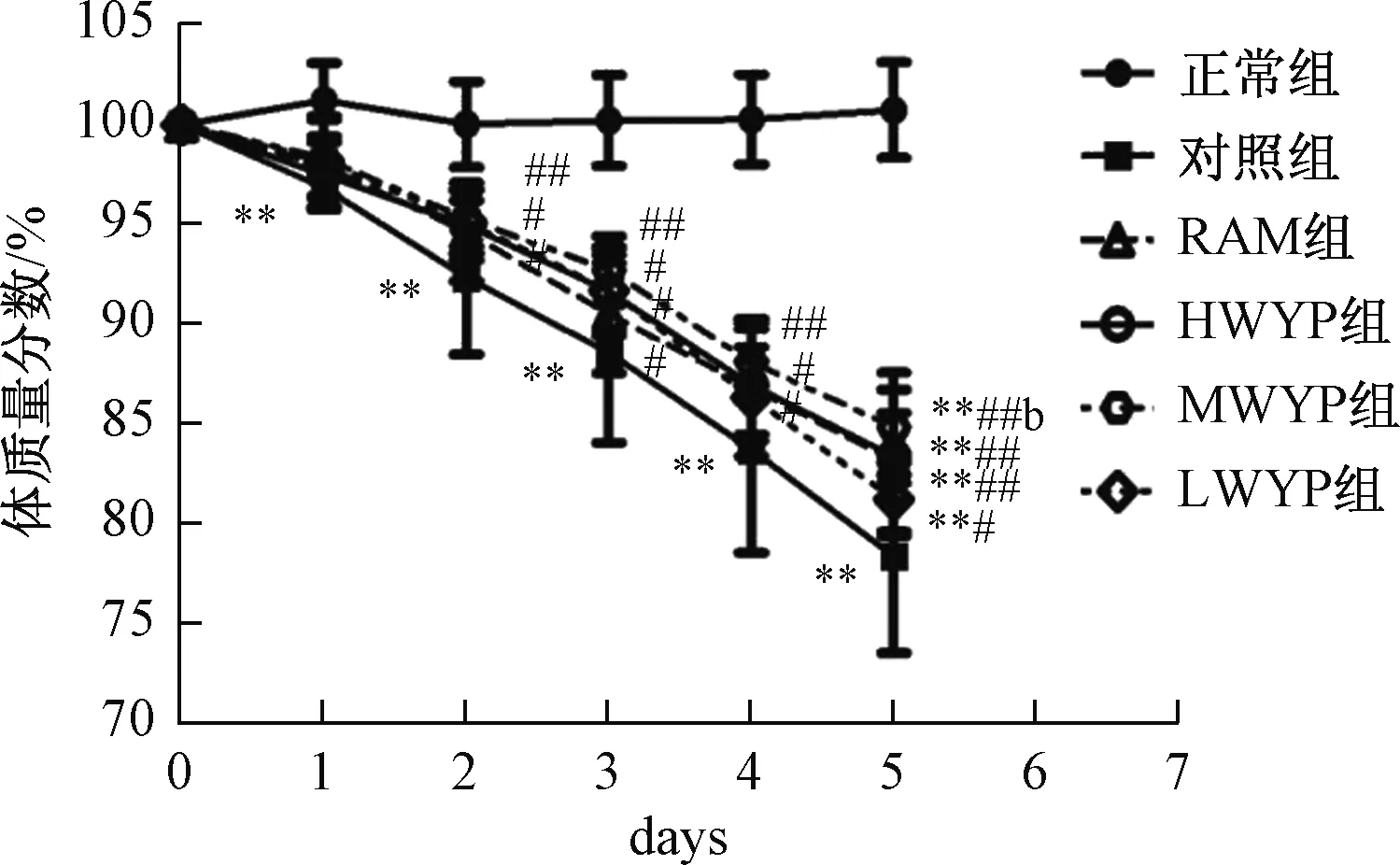
2.2 小鼠大便得分情况各5-FU模型组小鼠大便从干便、湿便,再到水样便。注射5-FU第1天后,对照组大便得分与正常组相比得分明显升高(P<0.01);给药第5天,HWYP组、MWYP组、LWYP组、RAM组得分显著低于对照组(P<0.05或P<0.01),MWYP组得分显著低于LWYP组(P<0.05)。大便得分变化见图2。
注:与正常组比较,**P<0.01;与对照组比较,#P<0.05,##P<0.01, 与LWYP组比较,图1 五子衍宗丸对化疗小鼠体质量的影响
注:与正常组比较,*P<0.05,**P<0.01;与对照组比较,图2 五子衍宗丸对化疗小鼠腹泻的影响
2.3 五子衍宗丸对化疗小鼠黏膜形态学的影响正常组小肠绒毛形态整齐规则,而对照组绒毛形态萎缩、缺失,损伤较严重。见图3。与正常相比,对照组空肠绒毛高度值显著减少、隐窝深度显著增加、空肠绒毛高度值/隐窝深度值减少(P<0.01)。与对照组相比,HWYP组、MWYP组、LWYP组、RAM组空肠绒毛高度值显著增加、隐窝深度值显著减少、空肠绒毛高度值/隐窝深度比值增加(P<0.01)。MWYP组的WYP比LWYP组的WYP绒毛高度值显著增加、隐窝深度值显著减少、空肠绒毛高度值/隐窝深度比值增加(P<0.05或P<0.01)。与RAM组相比,HWYP组、MWYP组小鼠空肠隐窝深度更小,绒毛高度/隐窝深度比值更大(P<0.05)。见图4。
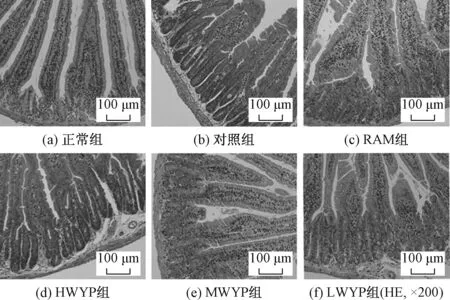
注:A:正常组;B:对照组;C:RAM组;D:HWYP组;E:MWYP组;F:LWYP组(HE, ×200)图3 各组小鼠空肠的HE染色切片图
2.4 五子衍宗丸对化疗小鼠肠道炎症因子的影响与正常组相比,对照组、HWYP组、MWYP组、LWYP组、RAM组小鼠空肠TNF-α、IL-1β、IL-6含量水平更高(P<0.01)。与对照组或LWYP组相比,RAM组、HWYP组、MWYP组小鼠空肠TNF-α、IL-1β、IL-6含量水平更高或含量水平更低(P<0.05或P<0.01)。见图5。
2.5 五子衍宗丸对化疗小鼠肠道细胞凋亡的影响给药后1 d,正常组凋亡细胞稀少,对照组可见大量的凋亡细胞,MWYP组较对照组凋亡细胞较少。见图6。给药后1 d(24 h)或第3天,与正常组相比,对照组、MWYP组的凋亡率显著升高(P<0.01);与对照组比, MWYP组凋亡率显著降低(P<0.01)。与对照组给药第1天比较,对照组给药第3天细胞凋亡率明显减少。见图7。
3 讨论
化疗相关性肠道黏膜炎在中医属于“泄泻”“下利”范畴。肾阳虚是中医辨证最常见的证型之一[8]。肾阳虚型泄泻病机为阳气不足,命门火衰,不能助脾腐熟水谷,水谷不化而为泄泻。五子衍宗丸为补肾名方,具有补肾益精、温补肾阳的功效。本研究通过给小鼠使用化疗药物(5-FU)的同时,使用五子衍宗丸温补肾阳,缓解化疗药物对肾阳的损伤,从而证明化疗过程中预防肠道黏膜炎补肾的重要性。

注:与正常组比较,**P<0.01;与对照组比较,#P<0.05,##P<0.01;与RAM组比较,aP<0.05;与LWYP组比较,图4 WYP对5-FU引起的小鼠小肠黏膜形态学的影响

注:与PBS+蒸馏水组比较,**P<0.01;与5-FU+蒸馏水组比较,#P<0.05,##P<0.01;与LWYP组比较,图5 WYP对炎症因子蛋白水平的影响

注:A:正常组;B:对照组;C:MWYP组图6 五子衍宗丸对化疗小鼠肠道细胞凋亡的影响
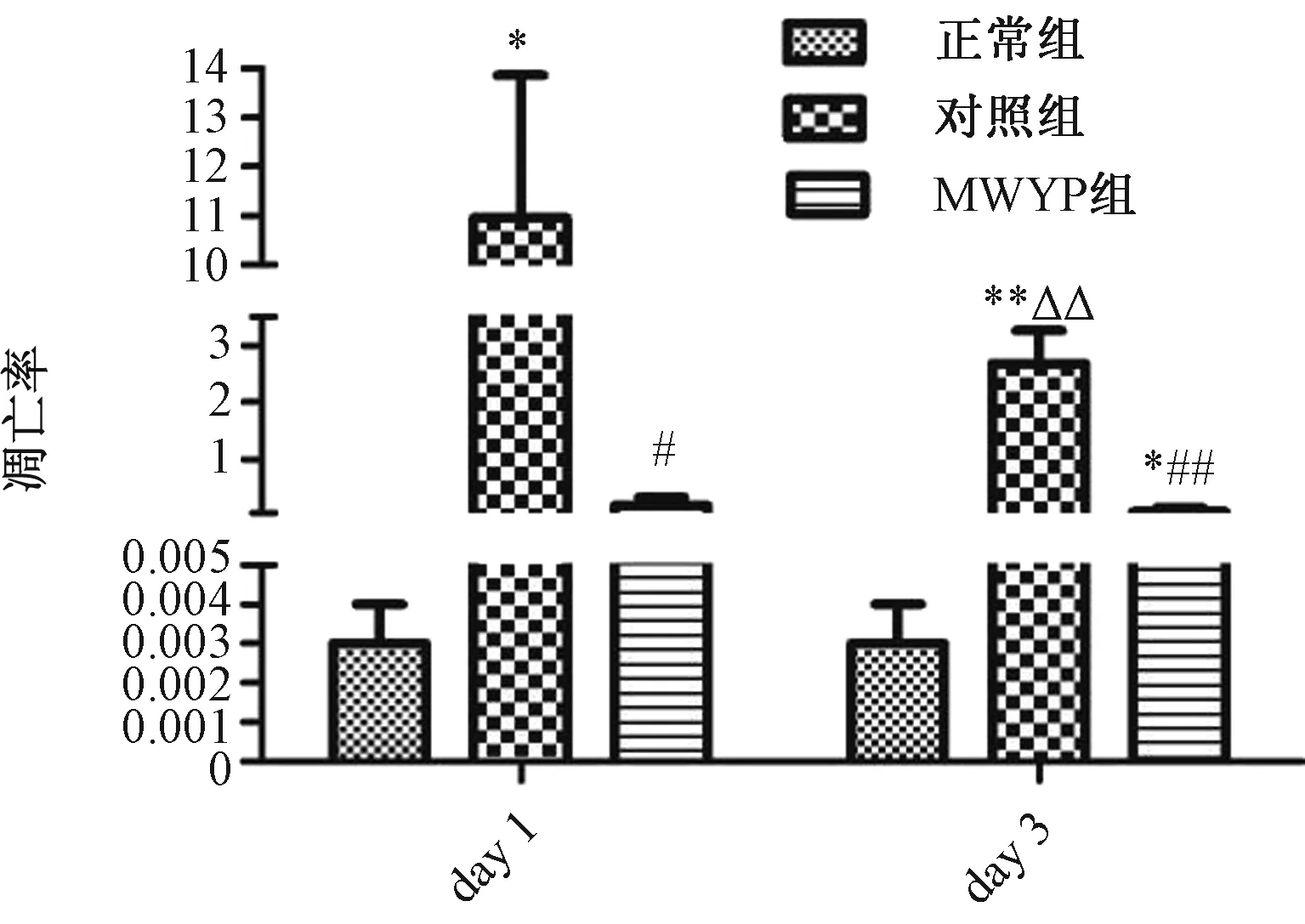
注:与正常组比较,**P<0.01;与对照组比较,##P<0.05,与对照组给药第1天比较,图7 五子衍宗丸对化疗小鼠肠道细胞凋亡的影响
从本研究结果来看,对照组因使用5-FU后,小鼠体质量一直出现显著下降。RAM、高中剂量的WYP能显著改善小鼠的腹泻和体质量下降情况,而中剂量的WYP效果明显好于低剂量的WYP,提示WYP改善5-FU 引起的小鼠体质量下降、腹泻症状存在一定量效关系;在病理形态学上,对照组小鼠肠黏膜严重损害:绒毛形态萎缩变短、切片外观上绒毛形态萎缩、 缺失。与对照组相比,3组WYP组、RAM组都能够显著性抑制5-FU引起的空肠绒毛萎缩变短、隐窝深度增加、绒毛长度/隐窝深度比下降,且HWYP组、MWYP组抑制隐窝深度增加的效果明显好于RAM组,说明WYP 能改善 5-FU对绒毛和隐窝的损害,高中剂量的WYP对隐窝细胞的保护效果明显好于RAM。
有研究表明:炎症因子(如TNF-α、IL-1β)对肠道黏膜损伤的严重程度和修复过程起着重要的影响[9,10]。TNF-α是出现较早、较重要的促炎症因子,促使其它炎症因子(如IL-6、IL-1、IL-8等)的产生[7,8]。IL-6通过IL-6/STAT3信号途径促使T细胞抗凋亡,由于T细胞对抗凋亡而累积的循环作用导致慢性炎症[11]。IL-1β在化疗性黏膜炎的发生也起着关键作用[12]。 通过对炎症细胞因子的合成与释放的抑制,可以减轻组织损伤,属于机体针对化疗性肠炎的一种保护作用机制[13,14]。
本实验结果表明,对照组的空肠组织中 TNF-α、IL-1β、IL-6含量显著性升高,提示5-FU可能通过促进 TNF-α、IL-6、IL-1β炎症细胞因子水平上升,诱导黏膜炎发生;而 WYP 能显著性降低其 TNF-α、IL-6、IL-1β炎症细胞因子水平升高现象,说明WYP可能通过抑制肠黏膜炎中TNF-α、IL-6、IL-1β炎症细胞因子水平发挥治疗作用,其抑制作用有一定的量效关系。高、中剂量的WYP组炎症细胞因子水平与RAM组无显著意义,其抑制促炎抗炎因子作用与RAM相当。因此,WYP可能抑制肠道组织中的IL-6、TNF-α、IL-1β水平,减轻炎症反应;通过减轻炎症反应,以保护对绒毛、隐窝的损伤,从而改善体质量下降、腹泻的小肠黏膜炎症状。
目前认为肠道黏膜上皮细胞凋亡在化疗性肠道黏膜炎的发病中占有极其重要的地位,抑制黏膜的上皮细胞凋亡可能是控制炎症性肠炎发生及发展的主要原因之一[15]。从本研究来看,5-FU导致肠道细胞加速凋亡,给药第1天凋亡细胞数量的增加明显超过给药第3天,这可能说明凋亡主要在24 h内引发,且是肠道黏膜炎发展的关键点。与对照组相比,MWYP组凋亡细胞明显减少,说明WYP都能够显著性抑制5-FU引起的细胞凋亡。因此,WYP抑制肠黏膜的细胞凋亡可能是治疗化疗性肠炎发生及发展的主要原因之一。
化疗对小肠细胞凋亡与促炎因子密切相关的(如TNF-α,IL-1β,IL-6)[16],有研究表明,TNF-α通过TNF-α-TNFR信号通路参与CWP通过激活FAS-caspase-8的发生和发展,从而抑制自噬而促进细胞凋亡[17]。IL-6通过传导信号诱导STAT3磷酸化,而STAT3自身则诱导抗凋亡因子bcl-xl和 bcl-2,由此诱导T细胞抗凋亡[18]。IL-1β可诱导细胞Bax等促凋亡蛋白的表达,活化caspase-3、caspase-9导致细胞发生内源性细胞凋亡[16]。
WYP能够抑制小鼠空肠TNF-α、IL-1β、IL-6含量水平,抑制肠道细胞的凋亡。鉴于炎症因子与凋亡存在一定的相关性,我们推测WYP治疗化疗性肠炎的抗炎机制可能通过抑制TNF-α、IL-1β、IL-6水平达到抗细胞凋亡的作用,对肠道的上皮细胞凋亡的抑制进而控制炎症性肠炎发生及发展。尽管如此,其细胞凋亡的信号通路不明,更深层次的机制仍有待进一步研究。
