侧流磷回收与磷去除工艺中的微生物学研究进展*
2021-04-06朱政豫李咏梅
高 丹 朱政豫 李咏梅,2#
(1.同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092;2.上海污染控制与生态安全研究院,上海 200092)
磷由磷矿石开采产生,是人类社会中不可或缺的一种非金属元素。目前,不可再生的磷矿石资源开采需求日益增大,同时磷的过量排放也会导致水体富营养化等生态环境污染问题。除了农业上的磷流失,城镇生活污水是人类向自然环境排放磷的另一个主要途径。随着城市化的发展与管网的完善,城市污水处理厂变成潜在的磷富集设施,如果对生活污水中的磷进行回收,其中的磷含量可以满足全球约15%~20%的磷矿石需求[1]。因此,从污水中经济有效、可持续地回收磷是近年来的研究热点。
城市污水处理厂中的磷回收大致有两类方法:一是在污泥处理过程中进行回收;二是在污水处理过程中进行回收,即侧流磷回收。相较于前者,侧流磷回收工艺成本更低,回收效率也更稳定[2]764。通常侧流磷回收工艺会与强化生物除磷(EBPR)系统相结合,以保证在污泥中富集充足的磷,便于后续通过不同手段进行磷释放及回收。EBPR系统中的厌氧池富含磷,可以直接从中将泥水混合物引入侧流,对富磷上清液进行回收处理;此外,可将好氧池或二沉池中污泥引入侧流装置,使其在厌氧环境下将细胞内的聚磷酸盐(poly-P)分解释放,然后对富磷上清液进行回收,释磷污泥回流至主流工艺系统[3]。
基于不同位置的磷回收衍生出诸多侧流磷回收工艺,如生物化学除磷(BCFS)工艺[4]、基于AAO的侧流磷回收(AAO-SBSPR)工艺[2]763-773、双污泥反硝化聚磷-诱导结晶磷回收(A2N-IC)工艺[5]等。这类工艺多是将传统污水生物处理技术与侧流磷回收相结合,以达到污染物去除与资源回收的双重目的。
近年来侧流EBPR工艺也逐渐受到关注[6],这是一种侧流磷去除工艺,与侧流磷回收工艺相似,但并不分离处理厌氧反应后的富磷上清液。侧流EBPR工艺是对传统EBPR进行改进,在其基础上加入侧流结构,从主流工艺中分流出部分污泥进行厌氧水解发酵,然后再回到主流系统,该工艺可以提高系统的磷去除效率,改善传统EBPR依赖进水碳源负荷、性能不稳定等缺陷[7]8。
侧流磷回收与磷去除工艺需关注的问题包括侧流对主流系统运行性能、污泥物化性质的影响及其内在微生物作用机制等。微生物的组成、丰度、代谢等对工艺运行的稳定性和效果具有显著影响。目前,传统EBPR工艺中的微生物研究已较为丰富,但侧流磷回收与磷去除工艺中的微生物作用机制研究尚处于起步阶段。为此,笔者就目前侧流磷回收与磷去除工艺中的微生物群落结构、功能微生物(尤其是磷相关功能微生物)的动态变化等研究进展进行总结与讨论。
1 侧流磷回收工艺
1.1 微生物群落结构及多样性
各研究采用的侧流磷回收工艺结构和运行条件不尽相同,其微生物群落组成则能在较大的分类水平上呈现出共性。随着分类水平的细化,微生物群落结构显现出差异,本节仅讨论科及以上分类水平的群落结构。现有研究中,门分类水平微生物中变形菌门(Proteobacteria)丰度最高。β-变形菌纲(β-Proteobacteria)是变形菌门中的主要菌群,其在脱氮除磷方面扮演了重要的角色[8]251。与硝化作用有关的亚硝化单胞菌属(Nitrosomonas)、亚硝化螺菌属(Nitrosospira),具有反硝化作用的动胶菌属(Zoogloea)、丛毛单胞菌科(Comamonadaceae)以及与除磷相关的红环菌目(Rhodocyclales)、CandidatusAccumulibacter Phosphatis(简称Ca. Accumulibacter)等均属于β-变形菌纲。
1.1.1 前置厌氧磷回收
从磷回收位点考虑,笔者将从厌氧池分流部分泥水混合物进行磷回收的工艺都归为前置厌氧磷回收。一般变形菌门、拟杆菌门(Bacteroidetes)是该工艺中的优势菌群。DAI等[9]1093构建实验室规模A2N-IC反应器,该工艺在厌氧池与缺氧池中间增添一个独立的好氧池将反硝化污泥与好氧硝化污泥分开,仅有上清液流通,然后将厌氧池中的富磷上清液引入结晶反应器中投加CaCl2进行磷回收。根据宏基因组学对微生物种群结构的分析,变形菌门丰度最高,其次是拟杆菌门和放线菌门(Actinobacteria)。侧流磷回收装置介入后,变形菌门丰度降低,在硝化污泥和反硝化污泥中,其相对丰度分别由64.21%、70.89%下降至62.57%、67.07%。刘传波[10]则从倒置AAO的厌氧池中分流活性污泥进行侧流磷回收,侧流工艺运行前后变形菌门和拟杆菌门均为优势微生物,合计相对丰度保持在58.38%~86.72%。功能菌群以红环菌科(Rhodocyclaceae)和腐螺旋菌科(Saprospiraceae)为主。红环菌科下的微生物种类丰富,具有脱氮除磷及降解芳香化合物等有机物的作用[11-12]。
1.1.2 后置厌氧磷回收
后置厌氧磷回收是指从好氧池或二沉池回流污泥中分流部分污泥进行磷回收的工艺。ISLAM等[13]305研发了一种新型缺氧好氧(AO)—侧流厌氧工艺,为促进磷吸收,该工艺将侧流厌氧反应器的释磷污泥回流至好氧反应器而不是缺氧反应器。高通量测序结果表明,丰度最高的变形菌门主要由β-变形菌纲和γ-变形菌纲(γ-Proteobacteria)组成,其次为厚壁菌门(Firmicutes)(相对丰度1%~5%)和螺旋体门(Spirochaetes)(相对丰度1%~8%)。在所有微生物中占主导地位的是红环菌目、伯克氏菌目(Burkholderiales)和硫发菌目(Thiotrichales),前两者属于β-变形菌纲,其中红环菌目包括了大部分现有被认可的聚磷菌(PAOs),因此其丰度水平可能与系统的除磷性能关系密切。
张莹[14]采用AAO-SBSPR工艺,在侧流厌氧反应器中外加碳源进行侧流磷回收。在纲分类水平上,系统中丰度较高的依次为β-变形菌纲、鞘脂杆菌纲(Sphingobacteriia)和γ-变形菌纲。属于鞘脂杆菌纲的鞘脂杆菌目(Sphingobacteriales)通常是化能有机好氧菌或反硝化细菌,能够降解有机碳,部分成员还与聚β-羟基脂肪酸酯(PHA)和poly-P有关[13]306,[15]。ZHAO等[16]603同样以AAO为主流工艺,从好氧池而非二沉池中分流部分活性污泥进入侧流装置,运行侧流反应器后,系统内的微生物群落发生明显改变,形成两种不同的类群。在门分类水平上,变形菌门、放线菌门、拟杆菌门和绿弯菌门(Chloroflexi)是反应器中的主要菌群。随着侧流反应器的介入,放线菌门和厚壁菌门的相对丰度分别从10.28%、5.24%降至5.06%、2.13%,同时浮霉菌门(Planctomycetes)和疣微菌门(Verrucomicrobia)的相对丰度分别从2.40%、0.59%增长至6.03%、2.51%。
还有研究尝试将膜生物反应器(MBR)与侧流磷回收相结合,取得了较好的效果。LI等[8]248-255利用好氧MBR反应器(投加FeCl3)、侧流厌氧发酵罐和侧流缺氧反应器构建MBR-侧流磷回收工艺,该工艺从好氧MBR中抽取部分活性污泥进入发酵罐,与米饭厌氧共发酵释磷,富磷上清液经沉淀回收后进入缺氧反应器进行反硝化。该工艺与上述活性污泥工艺差别较大,且主流MBR工艺中存在化学除磷,其微生物群落结构略有不同。好氧MBR和缺氧反应器中的微生物群落结构相似,丰度较高的微生物为变形菌门、拟杆菌门和厚壁菌门。侧流厌氧发酵罐中的微生物种群则与之有明显差别,拟杆菌门丰度最高,其以普雷沃菌属(Prevotella)为主,这可能与在发酵罐中加入米饭进行共发酵有关,因为普雷沃菌属有利于分解碳水化合物和蛋白质,产生短链脂肪酸[17];其次丰度较高的微生物是变形菌门和厚壁菌门。梭菌科(Clostridiaceae)是其中的优势功能菌群,包括了典型的铁还原细菌Alkaliphilsmetalliredigenes和拜氏梭菌(Clostridiumbeijerinckii),这可能与系统中投加Fe(Ⅲ)进行化学除磷有关。
不同侧流磷回收工艺中的优势菌群汇总见表1。由于工艺与运行条件的差异,每个运行系统均拥有独特的微生物组成与分布。已有研究表明,侧流磷回收会影响系统内微生物群落结构,甚至会出现与原系统完全不同的微生物类群。但目前各研究中微生物组成分析的分类水平不尽相同,无法一一比较,且科及以上较大分类水平的微生物丰度变化无法直接体现出其与系统性能之间的联系。因此,后续侧流磷回收工艺对主流工艺的微生物影响机制应从属分类水平,尤其是脱氮除磷等相关功能微生物的动态变化上进行深入探究。
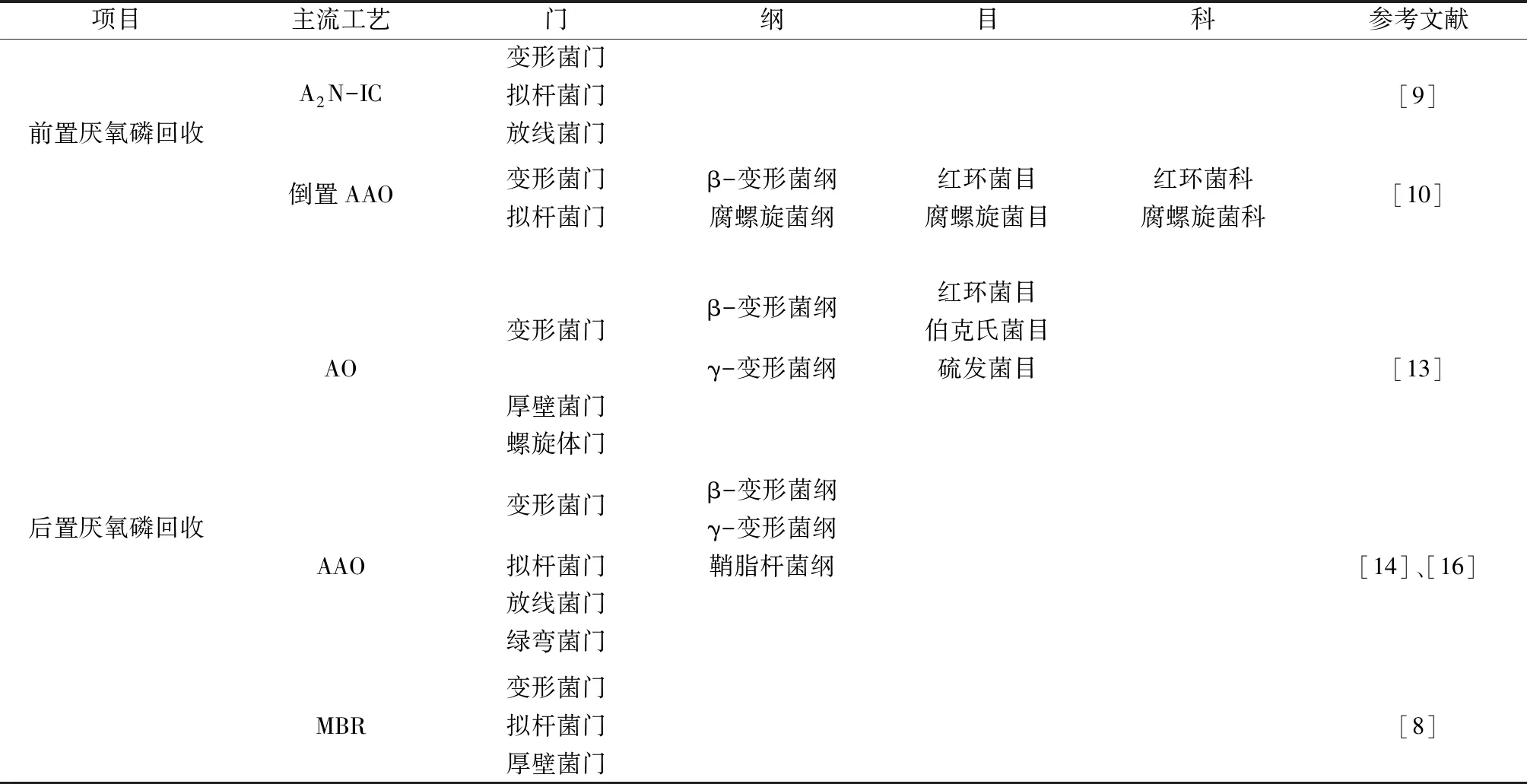
表1 不同侧流磷回收工艺中的优势菌群Table 1 Dominant microorganisms in different side-stream phosphorus recovery systems
1.2 磷相关功能微生物
1.2.1 优势PAOs
污水处理中起主要除磷作用的是PAOs,目前普遍认为属于β-变形菌纲的Ca. Accumulibacter是EBPR系统中最主要的一类PAOs[18-19],因而对于PAOs的研究也多集中于此。利用多聚合磷酸盐激酶的单拷贝基因ppk1作为标记基因进行分类,可将Ca. Accumulibacter分为TypeⅠ和Type Ⅱ两种类型[20],并进一步区分出14个进化枝,其中TypeⅠ有5个进化枝(Clades ⅠA~Clades ⅠE),Type Ⅱ有9个进化枝(Clades ⅡA~Clades ⅡI)[21-22],[23]2692。另外,有学者指出Ca. Accumulibacter的种群结构由环境条件决定[23]2692。在不同的运行条件下(碳源、电子受体、温度等),由于各进化枝的生理特征、代谢特性存在差异,系统中进化枝的组成和丰度可能会发生变化。
尽管Ca. Accumulibacter一直被认为是EBPR系统中重要的除磷微生物,但仅有少量侧流磷回收系统中Ca. Accumulibacter是优势PAOs。同时,不少研究表明,侧流结构的运行会增强系统的反硝化性能,有利于反硝化聚磷菌(DPAOs)的富集。ZHU等[2]770-771在运行的AAO-SBSPR反应器中检测到Ca. Accumulibacter、脱氯单胞菌(Dechloromonas)、不动杆菌(Acinetobacter)等PAOs,其中Ca. Accumulibacter为主要除磷微生物。另外还发现侧流磷回收装置的介入和长泥龄会引起Ca. Accumulibacter和脱氯单胞菌的增殖,系统的缺氧吸磷能力有所增强。
一些研究认为脱氯单胞菌也是PAOs[24],其可以硝酸盐作为电子受体进行吸磷,因此也被认为是DPAOs。ZHAO等[16]605发现运行侧流磷回收工艺后,系统内脱氯单胞菌的相对丰度从初期的1.1%~1.4%显著增加至8.5%~12.8%。DAI等[9]1093从实验室规模的A2N-IC反应器中检测发现,Ca. Accumulibacter和脱氯单胞菌是反硝化污泥中丰度最高的PAOs,在运行侧流磷回收工艺后,Ca. Accumulibacter相对丰度由25.39%降至23.03%,脱氯单胞菌相对丰度由15.90%降至10.58%,表明侧流磷回收对其产生负面影响。ISLAM等[13]304发现脱氯单胞菌的丰度显著高于Ca.Accumulibacter、四联球状菌(Tetrasphaera)、红环菌(Rhodocyclus)等其他PAOs。以ppk1为标记基因对Ca. Accumulibacter进行实时荧光定量聚合酶链式反应(qPCR)分析,在Type Ⅰ、Clades ⅡA、Clades ⅡB、Clades ⅡC、Clades ⅡD、Clades ⅡF 中检测到了Type Ⅰ、Clades ⅡA和Clades ⅡB 3种,丰度最高的是Type Ⅰ,其次是Clades ⅡB和Clades ⅡA。该团队在另一研究中发现[25],进水氨氮浓度较高时,反硝化EBPR内Type Ⅰ的丰度水平明显高于对照组。鉴于Ca. Accumulibacter Type Ⅰ能利用硝酸盐作为缺氧吸磷的电子受体,而Clades ⅡA不能[26],研究者认为这可能与系统的反硝化作用有关,但该推测仍需进一步证实,因为目前Ca. Accumulibacter各进化枝对不同电子受体的利用能力尚未完全明确,相关研究报道存在争议与矛盾[27-30]。同时,宏基因组学研究结果与之相左:Clades ⅡC和部分Clades ⅠC能够编码硝酸还原酶基因;Clades ⅠA、Clades ⅠB、Clades ⅡA、Clades ⅡF只能编码周质硝酸盐还原酶基因,这种酶的作用尚不明确[31-32]。
综上所述,侧流磷回收工艺的介入会影响PAOs的组成与丰度,大部分研究中侧流装置的运行可以促进PAOs及DPAOs增殖,但也有研究显示其会带来负面影响,目前尚无定论,还需进一步探究。由于主流工艺和进水等运行条件不同,各侧流磷回收工艺中的优势PAOs不同,主要集中为Ca. Accumulibacter和脱氯单胞菌两种PAOs。其中Ca. Accumulibacter含有多个进化枝,但只有少数研究会将其进一步细分,各进化枝在侧流磷回收工艺中的分布尚不明确,在今后的研究中可以考虑对此进行探究。
1.2.2 磷回收情况下PAOs的代谢
通常认为,PAOs在厌氧时主要通过分解poly-P为吸收挥发性脂肪酸(VFAs)提供能量,通过分解糖原提供还原力和部分能量。但进行磷回收会导致活性污泥细胞内的poly-P含量下降。许多研究表明[33-36],低poly-P环境中PAOs的代谢途径会发生改变,因此,侧流磷回收工艺中的PAOs代谢机制可以从这些研究中获得一些启发。
当细胞中poly-P含量降低无法提供足够的能量时,PAOs会提高糖原利用程度来获得能量,糖原的厌氧分解及好氧合成量均有所增长。而糖原分解量的增加也产生了更多的还原力,需要通过丙酮酸-琥珀酸丙酸途径获得平衡,进而导致合成的聚β-羟基戊酸酯(PHV)在PHA中占比增加,表现出类似聚糖菌(GAOs)的代谢特征[37],[38]1898,即较低的污泥含磷率会促进PAOs由磷酸盐积累(PAM)代谢向糖原积累(GAM)代谢模式转变。
这一代谢模式的转变是不同PAOs作用的结果。ACEVEDO等[38]1889观察到随着poly-P含量降低,优势PAOs中的Ca. Accumulibacter 由Type Ⅰ变成Type Ⅱ。WELLES等[39]则发现Type Ⅰ和Type Ⅱ两种Ca. Accumulibacter均能从原来各自的PAM或PAM-GAM混合代谢向GAM代谢转变,其中Type Ⅱ更占据优势,乙酸盐吸收速率更快。Ca. Accumulibacter存在诸多分支,系统内富集的具体分支不同,呈现出的代谢能力自然存在差异,在较大分类水平上(Type Ⅰ、Type Ⅱ)分析得到的结论很可能不够精确。MENG等[40]5在试验中进一步发现,Clades ⅡC和Clades ⅡD是优势PAOs,poly-P含量降低使得原有的少量Type Ⅰ、Clades ⅡA、Clades ⅡB丰度急剧降低。同时,该研究还发现了适应低poly-P环境的潜在PAOs——Thiothrixcaldifontis(相对丰度由0.53%增至5.75%)。这些研究丰富了对Ca. Accumulibacte代谢多样性的理解,也为低poly-P环境下特定进化枝的筛选与富集提供了思路。
GAOs在厌氧条件下与PAOs存在底物的竞争关系,因此会影响EBPR系统的运行性能及稳定性。低poly-P条件下,进行GAM代谢的PAOs与GAOs同样存在竞争。一些研究者在长期试验中观察到GAOs的增殖,其分布与碳源种类、进水碳源浓度等因素有关[41-42]。总体而言,以乙酸钠为单一碳源、进水碳源浓度较高时更有利于GAOs的生长,这与以往的经验相符。不同的是,PAOs仍能保持相当的丰度而未被淘汰,代谢模式的转化可能是解释该现象的原因之一。近期更微观的研究结果显示[40]9,PAOs比GAOs的比表面积更大、核酸含量更低,这也可能为PAOs在缺乏poly-P的环境中提供了生存优势,因为细胞体积越小、比表面积越大,物质传输交换的效率越高,同时核酸含量更高的细菌具有更多的代谢功能,生存所需能量更高。
综上所述,在侧流磷回收工艺中PAOs(主要为Ca.Accumulibacter)有可能会更多地利用糖原,向GAM代谢模式转变。同时,由于细胞内poly-P含量降低,优势PAOs的组成与丰度也可能发生改变,但PAOs仍具有一定的生存优势,而不被系统淘汰,但这仅仅是根据低poly-P下PAOs的相关研究做出的推测,真正的侧流磷回收工艺中的PAOs代谢机制还需要在今后的探究中逐步明晰。
2 侧流磷去除工艺
侧流磷去除工艺(主要是侧流EBPR)与传统EBPR的主要差别在于侧流厌氧水解发酵构筑物的加入使得厌氧时间延长,且可以给主流工艺持续提供复杂多样的VFAs,进而能够促进PAOs生长代谢[7]11。同时,侧流厌氧水解发酵还有可能刺激系统内PAOs的糖酵解活性,除磷能力增强[43]。
在微生物群落结构方面,侧流EBPR工艺比常规EBPR具有更高的微生物多样性,这表明其功能可能更加完整,从而具有更强的适应性与稳定性[44]。
2.1 优势PAOs分析
与侧流磷回收工艺不同,四联球状菌是侧流EBPR工艺中常见的优势PAOs,其含有3个分支,生理学表现不同于Ca. Accumulibacter,无法合成或分解PHA,且厌氧条件下可以利用多种有机物(乙酸、葡萄糖、氨基酸等),对环境的变化具有良好的适应力[45]160,[46]263。与Ca. Accumulibacter相比,四联球状菌具有更加多样的功能,如反硝化、发酵等[47]543,[48]。近年来,不少研究认为其一直以来在EBPR系统中的作用被低估,提出在EBPR过程中四联球状菌和Ca. Accumulibacter一样具有重要的作用[49-50]。
一项针对丹麦28个城市污水处理厂的调研结果显示[51],不管是否含有侧流水解设施,所有EBPR系统中四联球状菌的相对丰度(平均为27.0%)均显著高于Ca.Accumulibacter(平均为3.7%)。这一结果在ONNIS HAYDEN等[52]对北美污水处理厂的研究中得到了验证。其同样发现四联球状菌为优势PAOs,且荧光原位杂交(FISH)定量分析结果显示,侧流EBPR中Ca. Accumulibacter(相对丰度4.6%~7.6%)和四联球状菌(相对丰度>15%)的丰度水平与传统EBPR一致。WANG等[7]8在美国俄勒冈州的Rock Creek污水处理厂以相同的进水条件同时运行了外加碳源的侧流EBPR和AAO工艺,侧流EBPR工艺将AAO中的厌氧池从主流工艺中分离出来作为侧流反应器,进水直接进入缺氧池。系统中四联球状菌的相对丰度(FISH定量分析结果10.7%~20.7%)高于Ca. Accumulibacter,但该数值与16S rDNA扩增子测序的结果(0.07%)相差较大。这一方面可能是因为DNA提取、PCR扩增过程中存在偏差[53]745;另一方面四联球状菌某些分支呈丝状形态[46]259,由FISH定量分析可能会高估其丰度。Ca. Accumulibacter在AAO和侧流EBPR系统中的相对丰度没有明显差异,但两个系统内的Ca. Accumulibacter可能属于不同的进化枝。
目前,四联球状菌占优势的研究均集中于实际规模的污水处理厂,同时四联球状菌在传统EBPR与侧流EBPR中的丰度并无显著差别。研究表明,Ca. Accumulibacter和四联球状菌具有不同的生态位,四联球状菌具有发酵功能,可以利用多种大分子有机物,而Ca. Accumulibacter更倾向于直接利用VFAs等发酵产物[45]159。同时,和Ca. Accumulibacter相比,四联球状菌对乙酸盐的竞争力可能比其他有机质更弱[46]265。因此,进水成分复杂、VFAs含量较低的污水处理厂中或外源有机物有限的情况下,四联球状菌可能更具有竞争优势。
2.2 侧流EBPR中的优势PAOs代谢
如前文所述,能否合成/分解PHA是四联球状菌与Ca. Accumulibacter生理学上的重大差别。四联球状菌细胞中与之对应的功能储存物质也成为了相关研究的关注点之一。KRISTIANSEN等[47]543通过对四联球状菌中的4个菌株进行基因组测序注释以及纯培养实验构建代谢模型,模型提出在厌氧条件下四联球状菌能够将葡萄糖进行发酵生成VFAs,利用此步骤及分解poly-P产生的能量还可以将葡萄糖吸收储存为糖原;在好氧条件下,四联球状菌分解糖原提供能量以吸收磷酸盐合成poly-P。这一模型与Ca. Accumulibacter的代谢模型相似,只是其中糖原取代PHA成为胞内储存物。
一些氨基酸也可以被四联球状菌吸收储存用来进行磷的代谢。MARQUES等[45]167分别以葡萄糖、谷氨酸、天冬氨酸作为单一碳源进行厌氧/好氧批次试验,发现这些碳源的发酵导致了厌氧吸磷而非厌氧释磷,且厌氧吸磷量高于后续好氧阶段。这一现象的出现可能是由于四联球状菌将这些碳源进行发酵产生的能量已足以用来进行生命活动甚至吸磷,而无需进行poly-P的分解。虽然这有可能是一种新的除磷机制,但当吸磷量饱和后也有可能导致系统除磷能力的丧失[53]749。四联球状菌在不同环境中发酵能力的变化,也给其能否在EBPR中发挥稳定的除磷效果带来了不确定性,对于四联球状菌的代谢及除磷机制还需要深入探究。
结合Ca. Accumulibacter会发生代谢模式转化来看,由于这些PAOs存在多个亚种/进化枝,代谢方式多样,丰度高并不一定意味着对磷去除的贡献大。在今后的微生物学研究中,除了关注丰度水平,应进一步结合代谢特性分析以便能更好地评估各PAOs在去除磷过程中的角色。
3 结 语
针对侧流磷回收与磷去除工艺中的微生物学研究大多集中于微生物群落结构及多样性分析,对于其中功能微生物的基因表达、代谢途径等内在作用机制的研究远远不够。同时,研究中采用的方法如FISH、16S rDNA扩增子测序等,也可能在操作过程中存在偏差,导致在进行定量或微生物群落结构分析时具有一定的限制。因此,未来针对侧流磷回收与磷去除领域的研究,应结合拉曼光谱-FISH等更高层次的分子生物学分析技术进一步展开,以下3方面有可能是潜在的研究方向:(1)从脱氮除磷等相关功能微生物的动态变化中探究侧流结构对主流工艺的微生物影响机制;(2)定量分析主要PAOs(四联球状菌及Ca. Accumulibacte)的丰度,探究各进化枝在侧流磷回收与磷去除工艺系统中的分布;(3)明晰侧流磷回收与磷去除工艺中优势PAOs的代谢机理以及除磷机制,综合评估其在系统除磷中的贡献。
