异养硝化-好氧反硝化菌的脱氮特性及其对猪场废水处理的研究*
2021-04-06陈均利彭英湘张树楠肖润林何铁光吴金水
陈均利 彭英湘 罗 沛 张树楠 肖润林 何铁光 吴金水 刘 锋
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙农业环境观测研究站,湖南 长沙 410125;2.中国科学院大学,北京 100049;3.湖南省环境监测中心站,湖南 长沙 410014;4.广西壮族自治区农业科学院农业资源与环境研究所,广西 南宁 530007)
畜禽养殖废水通常含有高浓度的氮、磷和有机物,是农业污染防控的重中之重[1]。传统生物脱氮技术是目前处理养殖废水的主要方法[2]。但由于好氧硝化菌和厌氧反硝化菌对氧气和碳源需求的差异,造成好氧和厌氧反应器需单独设立和运行,导致工艺复杂、成本提高。而异养硝化(HN)-好氧反硝化(AD)菌集传统硝化菌和反硝化菌的优势,能进行同步硝化反硝化,引起了人们广泛的关注[3]。
许多研究表明,HN-AD菌易受pH、DO、温度等环境因子的影响,不同环境条件下脱氮效果差异显著[4]。因此,研究环境条件对其脱氮能力影响的特征是非常必要的。另外,固定化是其工程化应用的重要途径。聚乙烯醇(PVA)因无毒无害,成本低而被认为是一种理想固定化材料,但却存在机械强度低,易聚集成团的缺陷。在PVA中添加适量的海藻酸钠(SA)、活性炭(AC)或CaCl2能显著改善这个问题[5]。
本研究以粪产碱杆菌(Alcaligenesfaecalis)WT14(以下简写为WT14)为研究对象,重点分析WT14在不同环境条件下的氨氮去除能力,并用PVA加入SA、CaCl2和CA制备的凝胶小球对WT14进行固定化,再填充至固定床反应器中进行30 d的猪场废水处理试验,验证其实际应用的可行性,相关研究为HN-AD菌在养殖废水处理方面应用提供科学依据。
1 材料和方法
1.1 微生物菌株和培养基
WT14(GenBank号:MN578054)由亚热带农业生态过程重点实验室从湿地底泥基质中分离并保存。
HN培养基:(NH4)2SO4、柠檬酸钠、MgSO4·7H2O、K2HPO4、NaCl、MnSO4·4H2O、FeSO4分别为0.38、4.08、0.05、0.2、0.12、0.01、0.01 g/L,去离子水1 L,pH=7。
1.2 菌株的HN-AD性能
HN培养基中分别加入约100 mg/L的氨氮、硝态氮、亚硝态氮和羟胺作为唯一氮源,同时接种5 mL菌悬液,于30 ℃、120 r/min下培养24 h。培养结束检测氨氮、硝态氮、亚硝态氮和羟胺浓度变化,并计算去除率。
1.3 环境因素影响
将100 mL HN培养基置于250 mL锥形瓶中,氨氮调整为200 mg/L左右,碳氮质量比(C/N)为9,菌悬液接种量为5 mL,30 ℃、pH=7、120 r/min培养48 h。改变单因素时其他条件不变,单因素试验设置如下:温度(10、20、30、40 ℃);转速(60、80、100、120 r/min);C/N(3、6、9、12);pH(5、7、9、11)。每隔8 h取水样10 mL测定氨氮浓度变化,并计算去除率。
1.4 固定化菌应用
采用直径32.5 cm、高40.0 cm的透明有机玻璃柱作为固定床反应器(见图1),内部填充固定化菌,有效填充高度为34.7 cm,进水取长沙某猪场废水,进水氨氮、硝态氮、总氮、COD分别为252.75~296.38、1.11~2.91、261.26~311.98、1 304.17~1 484.98 mg/L。

图1 固定床反应器Fig.1 Schematic diagram of fixed-bed reactor
固定化菌制备方法:将10 g PVA、2 g SA、2 g AC浸泡于100 mL蒸馏水中,高压蒸汽灭菌(121 ℃,20 min),冷却至室温加入60 mL菌悬液搅拌均匀。用蠕动泵将混合液匀速滴入含有2%(质量分数)CaCl2的饱和硼酸溶液中,边滴边搅拌形成凝胶小球。将成型的小球放入4 ℃的冰箱中交联24 h,再用无菌水洗涤3次,之后得到固定化菌。
固定床反应器在30 ℃下运行,DO为2.30~2.70 mg/L,水力停留时间为12 h。固定化菌制备完成后直接填充至反应器,参照YANG等[6]1463-1466的研究结果,固定化反应器先进行7 d的稳定,再进行30 d定期采样监测以了解系统稳定运行时的去除效果。每天采水样1次,每次50 mL,测定氨氮、硝态氮、总氮和COD。
1.5 分析方法和数据处理
使用全自动流动分析系统(AA3,德国)测定氨氮、硝态氮和总氮,重铬酸钾氧化法测定COD。HN速率(Qb,mg/(L·h))计算如下:
(1)
式中:c0、ce分别为培养基中氨氮初始、平衡质量浓度,mg/L;te为试验达到平衡的时间,h。
2 结果与讨论
2.1 HN-AD性能
由图2可见,WT14可有效去除氨氮,且去除率最高。以羟胺为唯一氮源时,羟胺去除率很低,这表明WT14基本不能利用和去除羟胺。一般来说,亚硝态氮和硝态氮对微生物是有毒的,废水中游离的亚硝酸为0.05 mg/L就对不动杆菌(Acinetobactersp.)的生长有明显的抑制作用[7]。此外,粪产碱杆菌NR[8]、WY-01[9]和No.4[10]不能以亚硝态氮为唯一氮源供应自身生长和去除。WT14不仅能以亚硝态氮和硝态氮作为唯一氮源供应生长,而且能有效去除亚硝态氮和硝态氮,同时去除率明显高于报道的其他HN-AD菌,这表明WT14可能是一株与已报道的粪产碱杆菌不同的菌株。
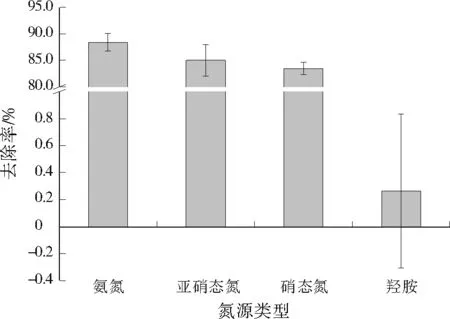
图2 WT14对不同形态氮的去除Fig.2 Removal of different forms of nitrogen by WT14
2.2 环境因子对WT14的氨氮去除能力影响
2.2.1 温 度
由图3可见,10、20、30、40 ℃时,48 h的氨氮去除率分别为61.58%、97.42%、89.11%、83.30%。这表明,WT14的最适温度为20 ℃。10 ℃时,24 h内WT14对氨氮去除作用不明显;20 ℃时,WT14一直保持较稳定的氨氮去除速率;30 ℃时,WT14在24 h就去除了85.11%的氨氮,后期氨氮一直维持在21.40~29.80 mg/L;40 ℃时,WT14的氨氮去除速率较30 ℃降低。

图3 温度对WT14去除氨氮的影响Fig.3 Effect of temperature on the ammonia nitrogen removal by WT14
由表1可见,10、40 ℃时,WT14的平均HN速率分别为2.57、3.47 mg/(L·h)。这与一些HN-AD菌在28~30 ℃下的HN速率(1.15~3.10 mg/(L·h)[11])相当。大多数HN-AD菌在10 ℃会受到严重抑制,20 ℃时会有明显的氨氮去除停滞期,超过35 ℃时脱氮能力急剧下降[12-13]。而本研究中,WT14在10 ℃时有轻微抑制现象,出现了大约24 h的氨氮去除停滞期。随着温度升高到20 ℃,停滞期消失,氨氮去除率和HN速率达到最大。

表1 WT14在不同环境因子下的HN速率Table 1 HN rate of WT14 under different environmental factors
2.2.2 pH

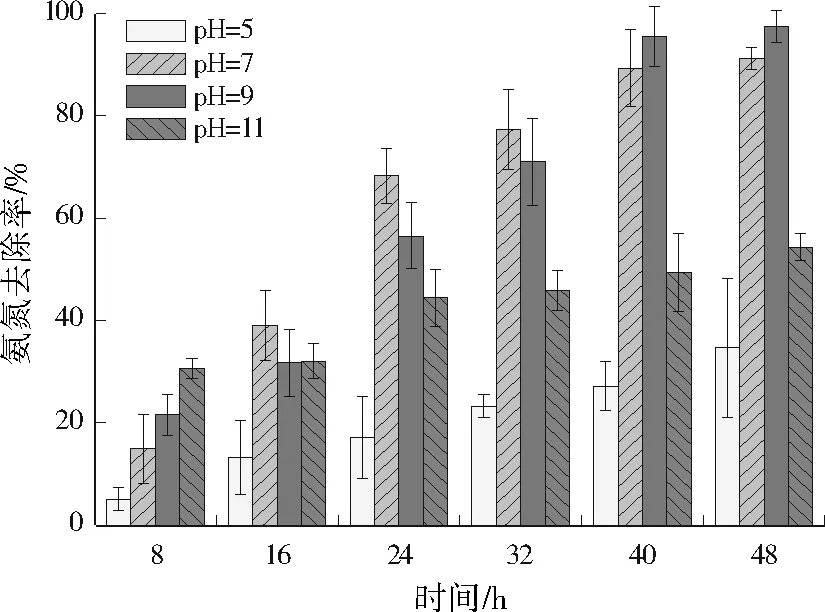
图4 pH对WT14去除氨氮的影响Fig.4 Effect of pH on the ammonia nitrogen removal by WT14
2.2.3 C/N
C/N为3时,WT14的平均HN速率较低(1.68 mg/(L·h)),48 h的氨氮去除率仅39.33%(见图5)。C/N为6时,平均HN速率比C/N为3时增加了约1倍,40 h就已去除了约80%的氨氮。C/N为9时,平均HN速率达到3.78 mg/(L·h),32 h的氨氮去除率就已达到88.30%。但C/N为12时,前32 h的氨氮去除率均低于C/N为9时,40 h后氨氮去除率才开始超过C/N为9时,48 h的氨氮去除率为97.07%,平均HN速率为4.03 mg/(L·h)。因此,C/N宜为9~12。

图5 C/N对WT14去除氨氮的影响Fig.5 Effect of C/N on the ammonia nitrogen removal by WT14
总体而言,氨氮去除率随C/N的升高而增高。REN等[16]发现,琼氏不动杆菌(Acinetobacterjunii)YB在高C/N(15)下能去除所有氨氮,而在低C/N(2和5)仅有25%和50%的氨氮去除率。这与本试验类似,48 h时,在高C/N(12)时有97.07%的氨氮去除率,而在低C/N(3)下仅为40.48%。C/N为3时WT14的HN速率和氨氮去除率与C/N为6时相比均降低约50%,这表明C/N为3~6是WT14的下限制性范围。C/N为12时,WT14虽然最终有着较高的氨氮去除率,但前32 h氨氮去除率明显低于C/N为9时,这表明过高的C/N对WT14有一定抑制作用,影响氨氮的去除速率。
2.2.4 转 速
当转速60 r/min时,48 h的氨氮去除率和HN速率最大,最佳转速为60 r/min;当转速为80 r/min时,48 h的氨氮去除率最低;各转速均在32 h时就已去除了80%以上的氨氮。WT14表现出较广的DO适应范围,转速为60、80、100、120 r/min时均表现出较好的HN性能,平均HN速率分别为4.00、3.69、3.90、3.81 mg/(L·h),48 h的氨氮去除率分别为95.88%、88.54%、93.44%、91.36%(见图6),HN速率和氨氮去除率相差不大。这表明,WT14有较弱的氧依赖性,不同于苍白杆菌(Ochrobactrumanthropic)LJ81[17]只有在高DO条件才有较高的氨氮去除率(92%,150 r/min),而且LJ81最大HN速率为3.85 mg/(L·h),低于WT14。
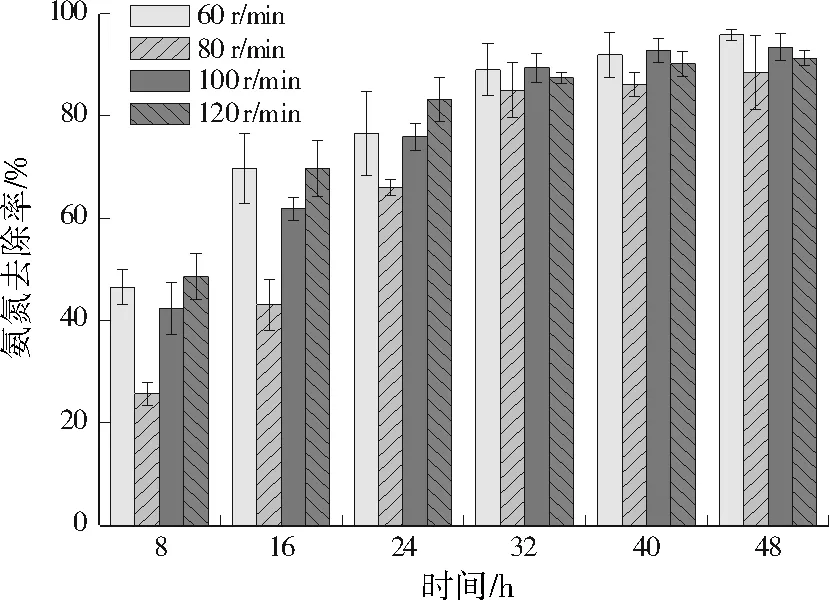
图6 转速对WT14去除氨氮的影响Fig.6 Effect of shaking speed on the ammonia nitrogen removal by WT14
2.3 固定化菌对猪场废水的处理
由图7可见,1~30 d,出水氨氮为2.57~15.50 mg/L,氨氮去除率为94.71%~98.90%,总氮去除率为77.87%~94.85%;WT14在反应器中展现出良好的COD去除能力,平均去除96.30%的COD。1~3 d,出水水质不稳定,出水平均氨氮、总氮分别为12.66、45.54 mg/L;4~30 d,出水平均氨氮、总氮分别基本维持在6.12、21.53 mg/L。猪场废水中硝态氮本身就在较低水平(1.11~2.91 mg/L),经反应器处理后平均97.25%的硝态氮被去除。
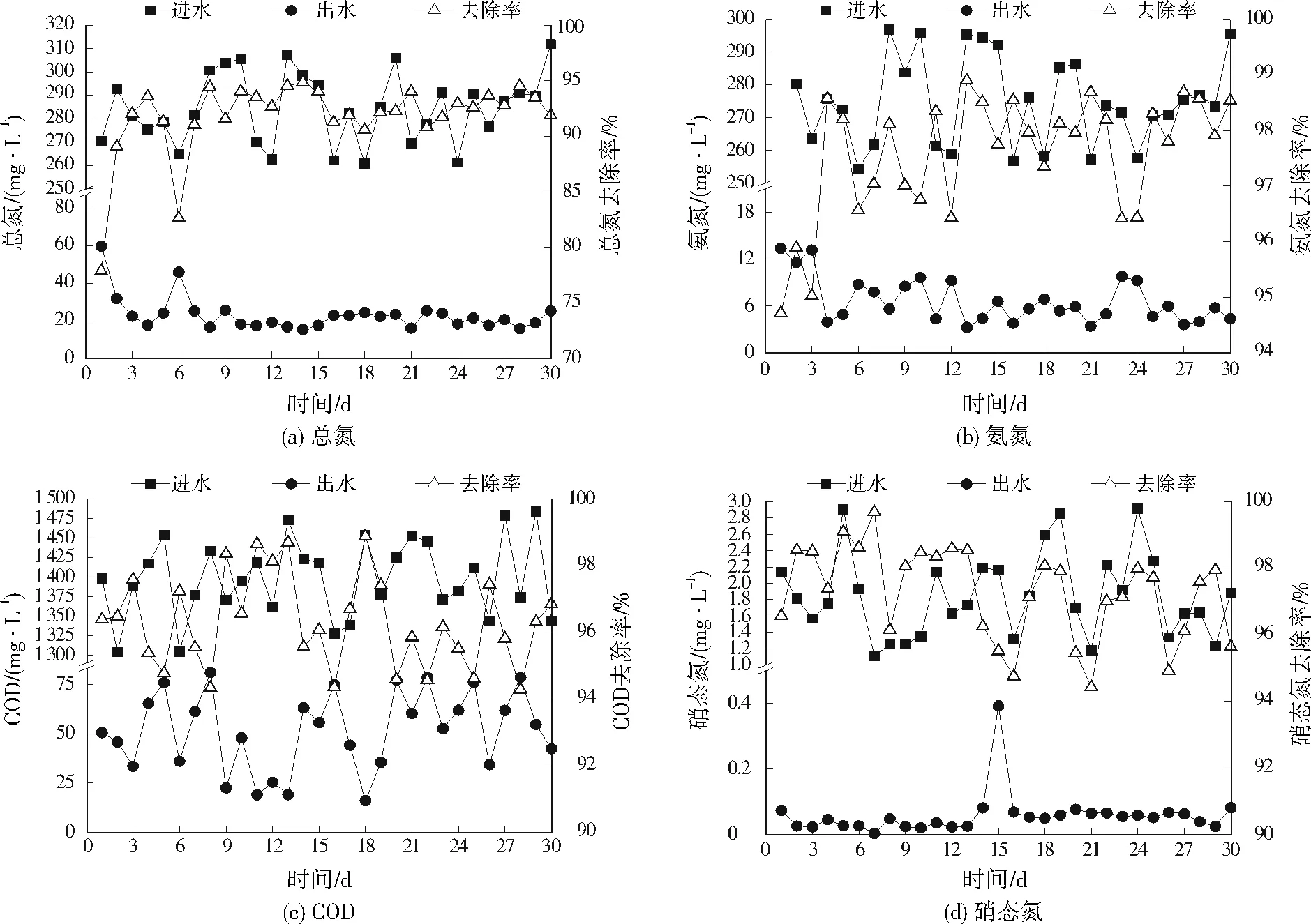
图7 固定床反应器对猪场废水中总氮、氨氮、COD和硝态氮的去除Fig.7 Removal of total nitrogen,ammonia nitrogen,COD and nitrate nitrogen from swine wastewater by fixed bed reactor
接种WT14固定化菌的固定床反应器对于实际猪场废水有较好的处理效果,实现了氮和有机碳的同步去除。1~3 d出水水质不稳定,这可能是由于7 d的稳定适应期太短,WT14还未完全适应从实验室环境到猪场废水环境的转变,这与不动杆菌TX5类似,在固定床反应器中需160~200 h[6]1463-1466的稳定期才能稳定处理养殖废水,第4天开始出水水质基本稳定,直到30 d试验结束氨氮、硝态氮、总氮、COD平均去除率保持在96.70%、97.25%、91.80%、96.30%。YANG等[6]1463-1466通过固定化技术制备不动杆菌TX5固定化菌处理实际养殖废水,总氮、COD去除率分别为92%、82%。YANG等[18]报道了在序批式反应器系统中接种枯草芽孢杆菌(Bacillussubtilis)A1,能同时去除81.30%的总氮和96.50%的COD。本研究通过固定床反应器的方式处理实际猪场废水的效率与上述研究相当或优于它们的处理效果。
3 结 论
(1) WT14能将氨氮、硝态氮或亚硝态氮作为唯一氮源进行有效去除,异于以前分离的粪产碱杆菌。
(2) WT14有高效的氨氮去除能力,对200 mg/L左右氨氮的平均HN速率最高可达到4.06 mg/(L·h),最佳脱氮条件为20 ℃、C/N 9~12、pH=9、转速60 r/min。
(3) 接种WT14固定化菌的固定床反应器处理实际猪场废水,试验结束氨氮、硝态氮、总氮、COD平均去除率保持在96.70%、97.25%、91.80%、96.30%,证明WT14在猪场废水处理上具有良好前景。
