短链全氟羧酸对小麦生长的生态毒理效应*
2021-04-06赵淑艳
游 奎 钟 喆 赵淑艳
(大连理工大学海洋科学与技术学院,工业生态与环境工程教育部重点实验室,辽宁 盘锦 124221)
全氟化合物(PFASs)是化合物分子中与碳连接的氢原子被氟原子取代的一类人工合成的有机化合物[1],因其具有优良的稳定性、疏水疏油性和高表面活性而被广泛应用于消防、造纸与电镀等工业和商业领域[2]。其中,全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)是PFASs的典型代表,在环境中检出频率较高[3],在我国PFASs污染的土壤中,PFOA(0.03~2.32 ng/g)和PFOS(0.01~1.88 ng/g)污染水平也较严重[4]。PFOS具有极强的环境持久性、生物蓄积性和生物毒性[5]。
近年来,由于对以PFOA和PFOS为代表的中长链PFASs的管控,短链PFASs作为长链PFASs的替代物而被广泛应用[6]。上海城市污水中短链PFASs含量普遍高于长链PFASs[7]。研究发现,上海市农业区表层土壤样品中全氟丙酸(PFPrA)、全氟丁酸(PFBA)、全氟戊酸(PFPeA)、全氟己酸(PFHxA)、全氟庚酸(PFHpA)分别为0~1.25、0.21~1.15、0~1.37、0~0.44、0.15~0.42 ng/g[8]。且与长链PFASs相比,短链PFASs在植物体内具有更高的富集和迁移能力[9]。然而,短链全氟羧酸(PFCAs)对植物的生态毒理效应目前尚未明确。
小麦作为全球最主要的粮食作物之一,常被用来研究化学品生态毒性效应[10]。本研究以小麦为模式生物,为避免土壤中微生物等诸多可能影响PFCAs性质的因素,选用水培方式,探究5种短链PFCAs(PFPrA、PFBA、PFPeA、PFHxA和PFHpA)对小麦种子萌发和幼苗生长的毒性效应。
1 材料与方法
1.1 主要实验材料
甲醇(色谱纯);PFPrA、PFPeA(纯度97%);PFBA、PFHpA和PFHxA(纯度98%)。
1.2 实验设计
挑选籽粒饱满、无虫害的小麦种子,在3%(质量分数)H2O2中表面灭菌5 min,再用1%(质量分数)硝酸钙浸泡2 h,去离子水淋洗2~3次,待用。
分别配制5种短链PFCAs的甲醇储备液,加入Hoagland营养液中,根据预实验结果及相关文献,设置PFCAs质量浓度分别为0.1、0.5、1.0、2.0、5.0 mg/L[11]216,设置6个平行(3个平行用于发芽测定,3个平行用于生长指标、叶绿素和酶活性测定),并设置空白对照。在每个培养皿(9 cm)中加15粒种子,10 mL相应溶液,保证溶液浸透滤纸并完全浸润小麦种子,每天定期添加去离子水,放置于恒温光照培养箱中(25.0±0.5) ℃黑暗条件下培养,待发芽阶段结束后,培养条件改变为(25.0±0.5) ℃白天光照14 h,(22.0±0.5) ℃夜间黑暗10 h,定期更换培养皿的位置以保证光照均匀。
1.3 测量指标和方法
小麦种子发芽势、发芽率分别在第3、7天测定[12]。第14天收集小麦,测定小麦的生物量。采用直尺测定根长及株高。利用朗伯-比尔定律[13]1086测定叶绿素a和叶绿素b含量。
取小麦根组织0.5 g于研磨器中,加入2 mL磷酸缓冲液,4 ℃下进行冰浴研磨,匀浆,离心,取上清液置于-80 ℃下保存待测。根据超氧化物歧化酶(SOD)能抑制氮蓝四唑还原的原理[14]测定SOD活性。利用过氧化物酶(POD)酶促H2O2氧化愈创木酚原理,在470 nm处测定吸光度的方法测定POD活性;通过催化分解H2O2,在240 nm处测定吸光度的方法测定过氧化氢酶(CAT)活性[15]。依据硫代巴比妥酸法[13]1087测定丙二醛(MDA)含量。
1.4 数据处理
数据描述性分析采用平均值±标准差,利用SPSS 17.0软件进行单因素方差分析,Tukey法进行差异显著性检验(P<0.05),Origin 2018软件进行作图。
2 结果与讨论
2.1 短链PFCAs对小麦种子萌发的影响
短链PFCAs质量浓度对小麦种子发芽势、发芽率的影响见图1。相对于空白对照,5种短链PFCAs对小麦种子发芽势影响较小,但0.1、0.5 mg/L短链PFCAs对小麦种子发芽率总体具有促进作用。研究认为,由于PFCAs具有良好的表面活性,能改变细胞膜通透性,影响植物细胞代谢[16]557。较低PFCAs可导致细胞产生兴奋效应,在一定程度上刺激小麦种子的萌发。同时,小麦萌发早期,发芽所需的能量供应主要来源于胚内物质,只有当暴露浓度达到阈值时,PFCAs毒性能抑制小麦种子发芽[17]。当质量浓度为2.0、5.0 mg/L时,短链PFCAs能抑制小麦种子发芽率,且在5.0 mg/L时抑制率为6.75%~39.19%。在PFHxA(2.0、5.0 mg/L)和PFHpA(5.0mg/L)处理组中,PFCAs对发芽率抑制显著,这可能是由于随着碳链长度的增长,PFCAs毒性作用也会逐渐增强。总体上,短链PFCAs对小麦种子发芽势和发芽率影响不显著,短链PFCAs对小麦种子萌发影响较小。

注:*表示处理组与空白对照之间的差异显著(P<0.05),图2至图5同。图1 短链PFCAs质量浓度对小麦种子发芽势、发芽率的影响Fig.1 Effects of short-chain PFCAs mass concentrations on seed germination potential and germination rate of wheat
2.2 短链PFCAs对小麦幼苗生长的影响
短链PFCAs质量浓度对小麦幼苗根长、株高、生物量的影响见图2。与空白对照相比,1.0 mg/L短链PFCAs均能诱导小麦根长显著增加16.62%~50.35%;在PFPrA(1.0 mg/L)、PFBA(1.0 mg/L)和PFHxA(0.5 mg/L)处理组中,小麦株高显著增加27.45%~47.14%;在PFBA(0.5、1.0 mg/L)、PFPeA(0.5 mg/L)和PFHpA(0.5、1.0 mg/L)处理组中,小麦幼苗生物量显著增加10.84%~27.84%。小麦幼苗根长、株高及生物量对短链PFCAs的响应呈现先升后降的Hormesis趋势[18]。可能原因是:(1)低浓度短链PFCAs能导致小麦植物细胞产生兴奋效应,刺激小麦幼苗的生长。(2)表面活性剂能诱导植物细胞膜通透性增加[19],因PFCAs具有良好的表面活性,可对小麦吸收营养成分具有一定促进作用。这与LAN等[20]30910研究PFBA和PFHxA对小麦植株生态毒理效应影响结果相似,即在低暴露质量浓度(<0.20 mg/kg)条件下,PFBA和PFHxA能诱导小麦幼苗的生物量增加。研究发现,PFOA在高暴露质量浓度(>0.20 mg/kg)条件下,能引起小麦幼苗的根和茎叶的细胞损伤,抑制小麦生长[21]。在相同处理条件下,相对于株高,小麦根长受影响更大。有研究指出,有机污染物的生态毒性效应不仅与暴露浓度有关,还与直接作用的植物化学特性及毒性机制有关[22]。本实验中,小麦幼苗的根直接暴露于含PFCAs的营养液中,因此小麦根对污染物毒性的响应更直接、敏感[23]。
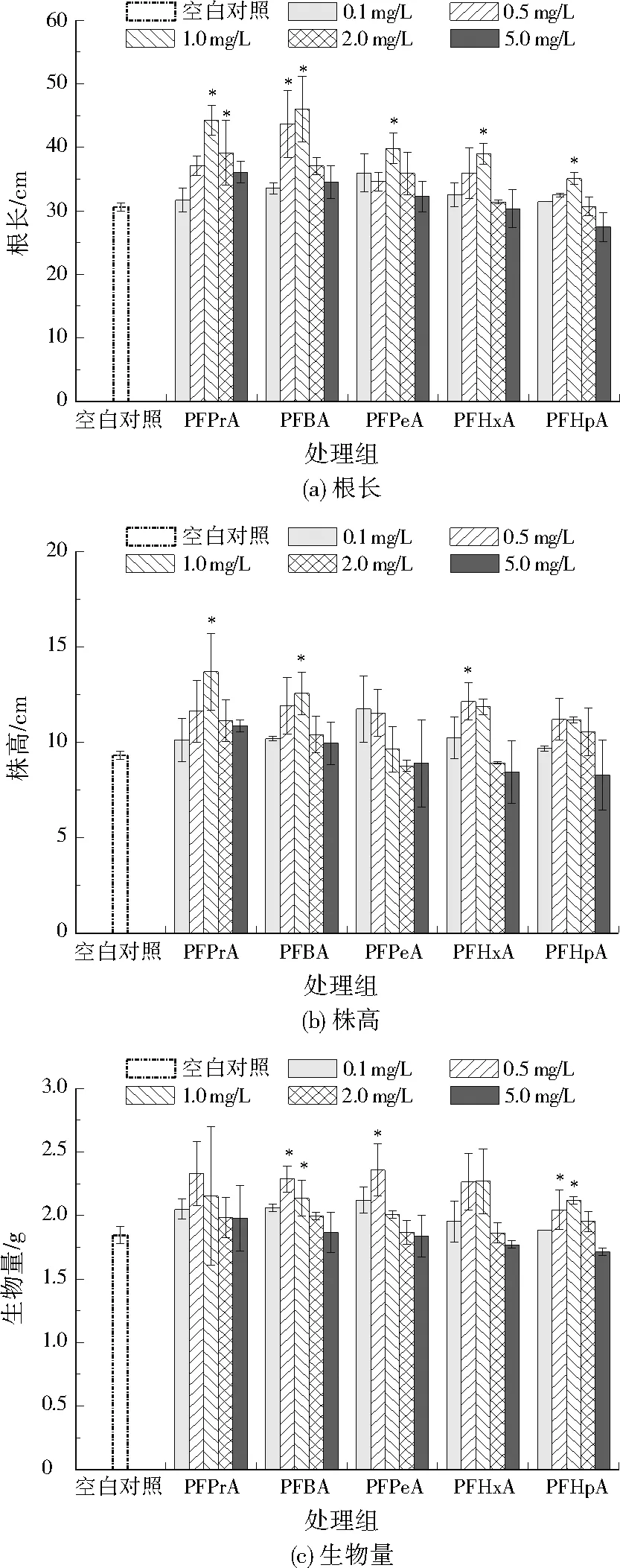
图2 短链PFCAs质量浓度对小麦幼苗根长、株高、生物量的影响Fig.2 Effects of short-chain PFCAs mass concentrations on the root length,plant height and biomass of wheat
2.3 短链PFCAs对小麦幼苗叶绿素的影响
植物体内叶绿素是衡量植物体氧化损伤和生长抑制的重要指标。短链PFCAs质量浓度对小麦幼苗叶绿素的影响见图3。受短链PFCAs影响,小麦幼苗叶绿素均比空白对照低,表明PFCAs对小麦具有生态毒理效应。其中,0.5~2.0 mg/L PFPrA能显著抑制叶绿素,抑制率为23.65%~27.52%。QIAN等[11]218研究PFOS对芦苇(Phragmitescommunis)的毒理效应影响时发现,随PFOS暴露浓度的升高,芦苇植株内叶绿素含量呈现下降趋势。本研究结果与此相似,即暴露于PFCAs条件下,小麦茎叶内叶绿素合成会受到抑制。这可能是由于PFCAs毒性作用,小麦茎叶内光吸收复合物的合成受到抑制[20]30911;PFCAs可能会作用于叶绿体的电子传输过程,导致叶绿素下降[24]。同时发现,相同暴露浓度条件下,相比于PFHpA,PFPrA对小麦茎叶内叶绿素抑制更强,可能由于链长较短的PFCAs在植物茎叶具有更高的迁移、富集能力[25],对叶绿素合成的抑制作用更明显。

图3 短链PFCAs质量浓度对小麦幼苗叶绿素的影响Fig.3 Effects of short-chain PFCAs mass concentrations on the chlorophyll of wheat
2.4 短链PFCAs对小麦根抗氧化酶活性的影响
植物体内的抗氧化酶水平可灵敏反映植物受到污染后的响应程度[26]。短链PFCAs质量浓度对小麦根抗氧化酶活性的影响见图4。小麦根SOD和POD活性均显著高于空白对照,且变化趋势相似。当PFCAs为1.0、2.0 mg/L时,CAT活性显著增大至峰值,增加率为66.40%~111.55%。小麦根中抗氧化酶活性对短链PFCAs的响应表现出先升后降的“倒U”型趋势。QU等[16]558通过研究PFOS对小麦生态毒理效应的影响时发现,低质量浓度(0.1~10.0 mg/L)PFOS能诱导小麦植株SOD和POD活性增强,高浓度则能抑制抗氧化酶活性。本研究结果与上述现象类似,当植物受到外源有机污染物胁迫时,通常会产生较多活性氧(ROS),主要包括H2O2、羟基自由基和超氧阴离子。SOD可将超氧阴离子转化为H2O2,然后POD和CAT能经过催化氧化消除H2O2[27]。较低浓度PFCAs时,短链PFCAs影响小麦根细胞通透性,进而影响小麦根细胞代谢活动,刺激抗氧化酶活性增强[16]557。高浓度PFCAs胁迫时,ROS累积过多,细胞发生氧化损伤,抗氧化酶活力下降[28]。

图4 短链PFCAs质量浓度对小麦根抗氧化酶活性的影响Fig.4 Effects of short-chain PFCAs mass concentrations on antioxidant enzymes activities in root
2.5 短链PFCAs对小麦根MDA的影响
短链PFCAs质量浓度对小麦根MDA的影响见图5。0.5、1.0 mg/L的PFCAs对小麦根MDA抑制作用总体最大,抑制率为4.72%~26.38%,且小麦根MDA在5.0 mg/L的PFCAs时达到峰值。小麦根MDA对短链PFCAs的响应呈现“U”型趋势。有研究指出,脂质过氧化常作为植物受胁迫时产生氧化应激反应的标志物[29]。而MDA是脂质过氧化的最终分解产物,其含量可间接表明ROS水平[30]。低暴露浓度短链PFCAs能抑制小麦根MDA,可说明此时ROS含量较低,细胞氧化损伤较小。MDA下降原因可能是低浓度PFCAs能刺激抗氧化酶活性增强,ROS能及时被清除,细胞未出现明显的脂质过氧化反应[31]。但当PFCAs暴露浓度较高时,小麦根细胞中MDA逐渐增加,脂质过氧化反应加剧,细胞受到氧化损伤。

图5 短链PFCAs质量浓度对小麦根MDA的影响Fig.5 Effects of short-chain PFCAs mass concentrations on MDA in root
3 结 论
(1) 短链PFCAs对小麦种子发芽势和发芽率影响总体不显著,短链PFCAs对小麦种子萌发影响较小。
(2) 小麦幼苗根长、株高及生物量对短链PFCAs的响应呈现先升后降的Hormesis趋势。
(3) 受短链PFCAs影响,小麦幼苗叶绿素均比空白对照低,表明PFCAs对小麦具有生态毒理效应。
(4) 小麦根SOD和POD活性均显著高于空白对照,且变化趋势相似。当PFCAs为1.0、2.0 mg/L时,CAT活性显著增大至峰值,增加率为66.40%~111.55%。
(5) 小麦根MDA对短链PFCAs的响应呈现“U”型趋势,高浓度PFCAs能导致小麦根脂质过氧化反应加剧。
