不同病因致肝硬化患者凝血等参数差异的比较研究
2021-04-06韩晶王桂立
韩晶,王桂立
肝硬化(cirrhosis)为临床常见的慢性进行性肝脏病,由一种或多种病因长期、反复作用形成弥漫性肝损害[1]。常见的病因包括:病毒性肝炎、酒精中毒、血吸虫病等[2]。典型病理表现为广泛的肝细胞坏死、残存肝细胞结节性再生、结缔组织增生、纤维隔形成,使肝小叶结构破坏、假小叶形成,肝脏逐渐变形、变硬,发展为肝硬化[3]。有报道显示,肝硬化患者常存在凝血功能障碍,当肝细胞受损到一定程度时,凝血因子合成减少引起不同程度的凝血障碍及血小板参数变化[4-5]。基于此,笔者选择120例不同病因导致的肝硬化患者为研究对象,观察患者凝血参数、血小板参数的差异,为早期诊治肝硬化提供科学依据。
1 资料与方法
1.1 一般资料 120例肝硬化患者选自海淀医院2016年12月至2018年12月的住院患者,根据病因不同将120例患者分为A组(病毒性肝硬化45例)、B组(酒精性肝硬化42例)、C组(血吸虫性肝硬化33例)。A组:男25例,女20例;年龄(45.68±6.52)岁,范围21~70岁。B组:男23例,女19例;年龄(45.71±6.54)岁,范围20~70岁。C组:男18例,女15例;年龄(45.75±6.57)岁,范围21~70岁。选择同期入院行健康体检者30例作为对照组,男17例,女13例;年龄(45.73±6.55)岁,范围22~70岁。4组患者年龄、性别等基础资料差异无统计学意义(P>0.05)。
1.2 纳入、排除标准 肝硬化组纳入标准:(1)符合全国病毒性肝炎学术会议修订的临床诊断标准[6];(2)可接受凝血参数、血小板参数检查;(3)2周内未使用过影响凝血功能、血小板的药物;(4)均有明确可查的导致肝硬化的原因;(5)患者对研究知情同意。排除标准:(1)肝脏恶性肿瘤或其他脏器恶性肿瘤者;(2)无法接受凝血参数、血小板参数检查;(3)发病原因不明的肝硬化。健康体检者纳入标准:肝功能正常,无肝脏疾病,各型肝炎病毒标志物检测均为阴性。
1.3 研究方法 凝血参数检测:采集受试对象空腹静脉血于枸橼酸钠溶液抗凝的真空采血管至3 ml刻度。采用日本希森美康医用电子有限公司CS-5100全自动凝血分析仪及配套试剂检测,指标包括:凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(Fib)、凝血酶时间(TT)。血小板参数检测:采集空腹静脉血2 ml于EDTA-K2抗凝的真空采血管中。采用深圳迈瑞生物医疗电子股份有限公司BC-6800全自动血液细胞分析仪及配套试剂检测,指标包括:血小板计数(PLT)、平均血小板体积(MPV)、血小板分布宽度(PDW)、大血小板比率(P-LCR)等。生化指标检测:采用罗氏cobas 8000全自动生化分析仪检测血清总胆汁酸(TBA)、前白蛋白(PA)、胆碱酯酶(CHE)、白蛋白(ALB)含量。配套试剂购自北京巴瑞医疗器械有限公司。
1.4 统计学处理 统计学分析软件为SAS 9.3,计量资料以均数±标准差(x±s)表示,多组间的比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 凝血参数指标比较 4组PT、APTT、Fib、TT等凝血指标差异有统计学意义(P<0.05)。A组PT、APTT、TT显著高于B组、C组、对照组,A组Fib显著低于B组、C组、对照组(P<0.05)。B组PT、APTT、TT显著高于C组、对照组,B组Fib显著低于C组、对照组(P<0.05)。C组PT、APTT、TT显著高于对照组,C组Fib显著低于对照组(P<0.05)。见表1。
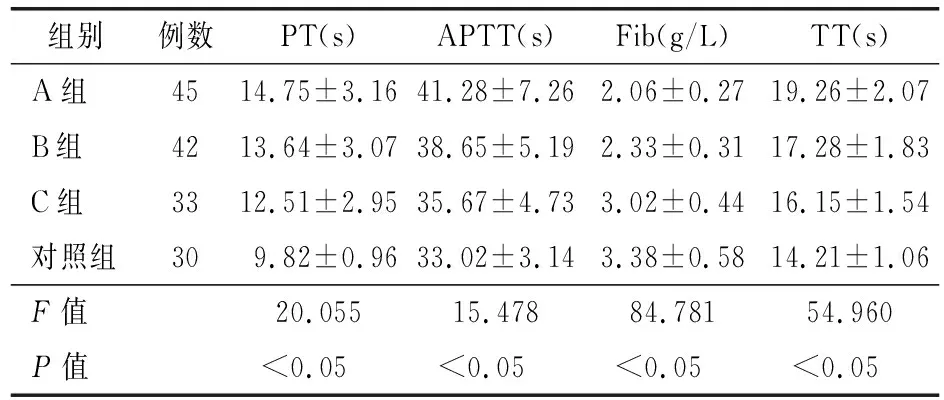
表1 4组肝硬化患者凝血参数指标比较(x±s)
2.2 血小板参数比较 4组PLT、MPV、PDW、P-LCR差异有统计学意义(P<0.05)。A组PLT、MPV、PDW均显著低于B组、C组、对照组,A组P-LCR显著高于B组、C组、对照组(P<0.05)。B组PLT、MPV、PDW均显著低于C组、对照组,B组P-LCR显著高于C组、对照组(P<0.05)。C组PLT、MPV、PDW均显著低于对照组,C组P-LCR显著高于对照组(P<0.05)。见表2。

表2 4组肝硬化患者血小板参数比较(x±s)
2.3 生化指标比较 4组TBA、PA、CHE、ALB含量差异有统计学意义(P<0.05)。A组TBA含量显著高于B组、C组、对照组,A组PA、CHE、ALB含量显著低于B组、C组、对照组(P<0.05)。B组TBA含量显著高于C组、对照组,B组PA、CHE、ALB含量显著低于C组、对照组(P<0.05)。C组TBA含量显著高于对照组,C组PA、CHE、ALB含量显著低于对照组(P<0.05)。见表3。
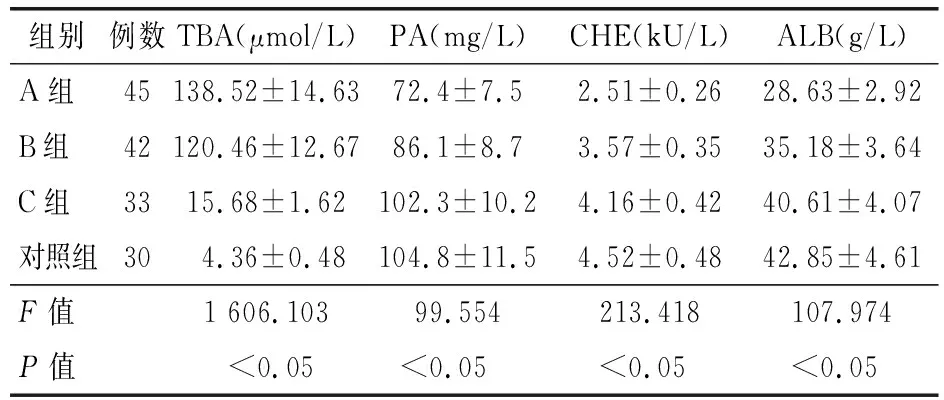
表3 4组肝硬化患者生化指标比较(x±s)
3 讨论
肝硬化为常见的慢性肝病之一,由1种或多种病因长期或反复作用引起,可使患者出现肝功能损伤、门脉高压等表现[7]。根据病因不同,肝硬化可分为:病毒性肝硬化、酒精性肝硬化、血吸虫性肝硬化等[8]。临床报道显示[9],肝硬化患者中存在明显的造血系统损害,如血液中白细胞、血小板数量减少、凝血因子合成减少、凝血因子消耗过多、血小板质量改变等[10-12],这些因素易增加患者出血倾向,引起程度不同的凝血功能障碍。而血管、血小板、凝血、纤维蛋白溶解系统的相互作用、动态平衡,可维持凝血系统的完整性。肝硬化时患者肝功能受损,可破坏血管、血小板、凝血、纤维蛋白溶解系统的动态平衡,导致自发性出血、出血后难以凝固的现象[13]。在不同病因导致的肝硬化患者中是否存在凝血、血小板功能异常及其临床特点成为临床研究的热点问题。本研究比较了乙型肝炎肝硬化、酒精性肝硬化、血吸虫性肝硬化凝血参数、血小板参数及生化指标的差异,为早期诊断、治疗肝硬化提供科学依据。
本研究结果显示,肝硬化组PT、APTT、TT较对照组延长,其中以病毒性肝硬化组延长程度最大。究其原因,一方面,凝血参数中PT为反映凝血因子Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅹ含量或循环抗凝物质的指标[14]。APTT为测定内源途径凝血因子Ⅷ、Ⅸ、Ⅻ的活性,受凝血因子Ⅰ、Ⅱ、Ⅴ、Ⅹ的影响[15]。TT可反映血浆内肝素及类肝素抗凝物质水平[16]。而凝血因子Ⅱ、Ⅶ、Ⅹ、Ⅸ为维生素K依赖因子,对肝细胞损害较敏感,当机体存在肝细胞损伤时,PT、APTT、TT均较正常人明显延长。另一方面,研究表明,病毒性肝硬化造成的肝细胞损伤往往较酒精性肝硬化、血吸虫性肝硬化严重,致使肝细胞更多地变性坏死,导致凝血因子合成更少,肝素样物质堆积更多,从而导致PT、APTT、TT更长。此外,本研究结果显示,A、B、C 3组Fib水平明显低于对照组,而病毒性肝硬化组Fib水平明显低于酒精性肝硬化组、血吸虫性肝硬化组,可能是因为乙型肝炎病毒剪接特异性蛋白与Fibγ链间的相互作用可使Fib显著减少。乙醇可通过改变凝血因子结构也引起凝血功能障碍,当乙醇摄入量较少时,多种凝血因子减少,Fib相应下降。而血吸虫感染可激活纤维蛋白溶解酶活性,从而促进纤维蛋白溶解,导致Fib减少。其中以病毒性肝硬化组Fib减少最甚可能与肝炎病毒大量复制增殖,呈指数级增长,对Fib的破坏可呈一定程度的放大效应有关。
凝血过程中,血浆中的可溶性纤维蛋白原转变为不可溶的纤维蛋白,纤维蛋白将血小板、血液其他成分网罗形成血凝块[17]。故血小板在凝血过程中也发挥了重要的作用。PLT为反应血小板生成、衰亡的指标,MPV为反映骨髓中巨核细胞增生代谢、血小板生成的参数。PDW为反映PLT容积大小差异程度的参数,PDW增加说明PLT大小离散程度增加[18]。P-LCR为反映体积≥12 fl的血小板比率[19]。病毒性肝硬化时,肝细胞出现变性、坏死,可引起门静脉压力升高,脾脏瘀血重大,继发脾功能亢进,而使血小板数量减少。血吸虫性肝硬化可通过虫卵释放可溶性虫卵抗原,引起机体免疫反应,多种因子被激活,活化的肝星状细胞合成细胞外基质增加,过度沉积而形成纤维化,继而引起肝窦血流障碍,最终形成以门脉高压为主要表现的血吸虫病。酒精性肝硬化不涉及病毒感染问题,MPV作为应激反应的指标,可随血清蛋白浓度下降而引起巨核细胞释放出的血小板增多,或低蛋白血症状态下结合于血小板的纤维蛋白原增多,引起血小板聚集而发生程度不同的减少,MPV升高。
血清PA为肝细胞合成的血清蛋白质,肝硬化时,血清PA浓度下降,可反映早期肝脏功能变化。血清ALB浓度可反映肝脏合成功能。TBA为胆汁中最大的有机酸,血清TBA浓度变化可反映患者肝脏分泌、合成、损害状态,肝硬化晚期时TBA水平显著升高,可作为检测慢性肝炎肝损害的敏感指标。血清CHE主要来源于肝脏的拟胆碱酯酶,可反映肝脏的蛋白合成功能,同时可反映肝脏储备功能[20]。本研究中,肝硬化组PA、CHE、ALB水平均明显低于对照组,TBA明显高于对照组,其中以病毒性肝硬化组PA、CHE、ALB下降程度最明显,TBA上升程度最明显,提示血清PA、CHE、ALB、TBA联合检测可较早反映肝脏合成代谢储备功能,浓度变化可反映肝功能状态,可能是病毒性肝硬化组病程多较长,肝细胞多呈较重、面积较大的慢性肝损伤,机体代偿功能较差,因此血清PA、CHE、ALB、TBA水平的异常程度更大。
综上所述,不同病因所致的肝硬化患者凝血参数、血小板参数、生化指标存在差异,联合检测凝血指标、血小板指标、生化指标可有助于鉴别诊断不同病因导致的肝硬化。
