运动抗衰老:端粒机制的研究进展
2021-04-06董云峰邱俊强
董云峰,邱俊强
随着人类寿命的延长,与年龄相关疾病的患病率呈上升趋势,因此,迫切需要找到适当的干预措施来延缓衰老,同时减少与衰老有关疾病的发病率。近年,研究揭示了端粒长度及其完整性在衰老过程中的重要性,以及延缓衰老的潜在干预措施,如体育锻炼和健康饮食(Mercken et al.,2012)。由于端粒长度在细胞衰老中具有关键作用,同时端粒缩短与预期寿命下降和慢性疾病风险增加有关,因此,端粒磨损已被描述为衰老重要的生物学特征之一(Lópezotín et al.,2013)。
1 衰老与端粒
1.1 衰老
研究表明,世界上60岁及以上人口的比例正在迅速增加,预计到2050年将上升20%,超过世界儿童的数量,说明大多数国家的人口结构正在趋于老龄化(Stambler,2017)。因此,开发能够延缓衰老速度或减少与衰老相关疾病发生的干预措施,已成为当务之急,同时这对于提高生活质量和降低医疗成本具有巨大的应用价值(Chakrabarti et al.,2016;Konar et al.,2016)。针对人和动物模型的研究表明,多种遗传、饮食、运动和药物干预可以延长寿命,同时这些延长寿命的方法也有助于延缓与年龄有关疾病的发生(Kenyon,2010;Robi et al.,2013)。
1.2 端粒
端粒是线性染色体末端的特殊结构,即染色体(DNA分子)末端重复核苷酸序列区域,哺乳动物端粒由重复的富含G和C的DNA序列(5’-TTAGGG-3’/3’-CCCTAA-5’)组成,染色体末端沿着 5’到 3’方向的链富含GT(De Lange,2005)。双链端粒DNA与6个亚单元端粒蛋白复合物(shelterin)结合,6个亚单位包括:端粒重复序列结合因子 1(telomeric repeat binding factor 1,TRF1)、端粒重复序列结合因子2(telomeric repeat binding factor 2,TRF2)、端粒保护蛋白1(protection of telomeres 1 protein,POT1)、TRF1和TRF2相互作用的核蛋白2(TRF1-and TRF2-interacting nuclear protein 2,TIN2)、TIN2和POT1相互作用蛋白 1(TIN2 and POT1 interacting protein 1,TPP1)和阻遏物激活蛋白1(repressor activator protein 1,RAP1),它们之间相互连接(图1),其中TRF1、TRF2和POT1可直接识别TTAGGG重复序列(Blackburn et al.,2015)。同时,Shelterin复合物也有助于形成带有T环和D环的套索状结构,从而可以隐藏端粒末端(Balan et al.,2018)(图1)。这种构象可抑制端粒处的DNA损伤反应(DNA damage response,DDR),从而阻止共济失调的毛细血管扩张突变(ataxia-telangiectasiamutation,ATM)和 RAD3相 关(RAD3-related,ATR)激酶的激活,这些激酶可诱导细胞周期停滞,以应对DNA双链断裂和其他类型的DNA损伤。
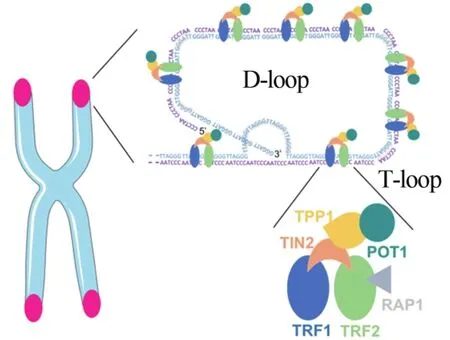
图1 端粒DNA与Shelterin复合物促进D和T环的形成(Balan et al.,2018)Figure 1. Telomeric DNAwith the Shelterin Complex Facilitating the Formation of D-and T-loop
1.3 端粒酶
端粒酶是一种负责在染色体末端合成DNA的酶,通过在RNA模板上添加重复序列来延长端粒DNA的末端区域,是一种依赖RNA的DNA聚合酶(核糖核酸蛋白),能够合成端粒DNA序列,为无限的增殖潜能提供分子基础(Blackburn,2001;Cong et al.,2002)。由于“末端复制问题”,DNA聚合酶在细胞分裂过程中无法维持端粒长度,体细胞端粒会随着年龄的增长而逐渐缩短,此时端粒酶会起到延缓端粒缩短的作用(Harley et al.,1990;Odile et al.,2005;Starkweather et al.,2014)。端粒酶由两个核心组成:催化亚基端粒酶逆转录酶(telomerase reverse transcriptase,TERT)和 RNA 模板(telomerase RNA template,TERC),其中TERT中的核苷酸多态性与降低乳腺癌风险密切相关(Helbig et al.,2017)。许多类型的人类细胞缺乏端粒酶,它可通过在染色体末端添加核苷酸来负责端粒的合成(Zhang et al.,2016)。此外,端粒酶可以抵消端粒侵蚀,在某些情况下还可以延长端粒长度,而且端粒酶活性的调节在抗衰老以及治疗癌症方面有着重要作用(Aviv,2002;Cong et al.,2002)。
1.4 端粒长度与衰老
端粒有重要的生物学功能,可稳定染色体,防止染色体DNA降解、末端融合,保护染色体结构基因DNA,调节正常细胞生长,同时也起着有丝分裂时钟的作用,因为其在每一次体细胞分裂时都会发生磨损,所以端粒的长度可以作为这些细胞复制潜能的一个指标(Arnoult et al.,2015;Blackburn,2010)。细胞分裂越多,端粒越短,随着年龄的增长,端粒DNA在体细胞分裂过程中自然缩短,当端粒长度变得非常短时,端粒功能受损,导致基因组不稳定、细胞衰老和凋亡(Blackburn et al.,2015)。
生物老化指的是独立于时间老化的过程,其降低了机体的生存能力,增加了机体的脆弱性,而端粒长度被认为是生物衰老的标记物,因为其记录了时间和生物年龄(Brown et al.,2017)。当端粒长度缩短到阈值以下时,会导致端粒长度极度变短,易于染色体端粒融合,融合的染色体在有丝分裂过程中分裂不均匀,导致细胞分裂过程中基因组的不稳定和染色体重排,对DNA造成损伤,进而导致细胞产生非功能蛋白,这些蛋白可能会以两种不同的方式产生作用(Cleal et al.,2018;Hemann et al.,2001;Maciejowski et al.,2017):1)非功能性细胞导致凋亡,凋亡是人类衰老的大致过程;2)非功能细胞继续产生非功能蛋白,这些蛋白可能成为非功能细胞,最终成为癌症。虽然端粒缩短被认为是一种防止肿瘤发展的措施,但端粒功能的丧失会导致细胞衰老,破坏组织的更替,导致整个机体衰老(Vakonaki et al.,2018)。因此,维持端粒长度,延缓端粒磨损,对于防止机体衰老具有重要意义。
2 运动与端粒长度
随着生活方式的改变,老年人的寿命和生活质量有所提高,尤其是规律的体育锻炼,但这其中的相关机制还不清楚,这也在一定程度上促使了对运动与端粒生物学关系的研究,如运动是否能够延缓衰老和改善疾病等问题。从目前的研究表明(表1),运动对维持端粒长度的确有一定保护作用,但同时又存在两种关系:正相关关系和倒U型关系,这可能与具体的运动处方有关,包括运动强度、运动类型、运动持续时间等(Chilton et al.,2017;Ludlow et al.,2013)。
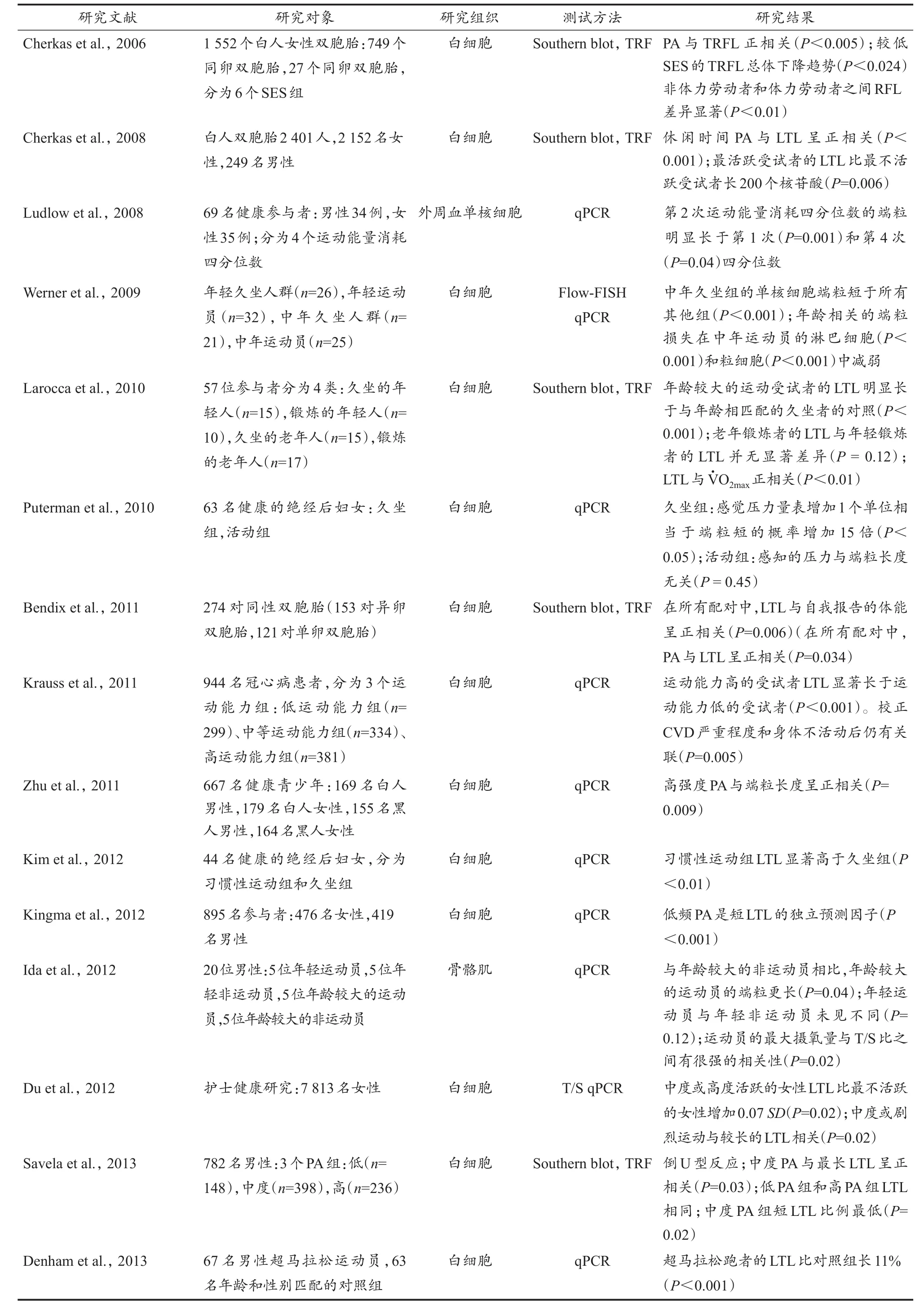
表1 运动与端粒长度显著相关的研究Table 1 ASummary of Studies Showing PositiveAssociations between PhysicalActivity and Telomere Length
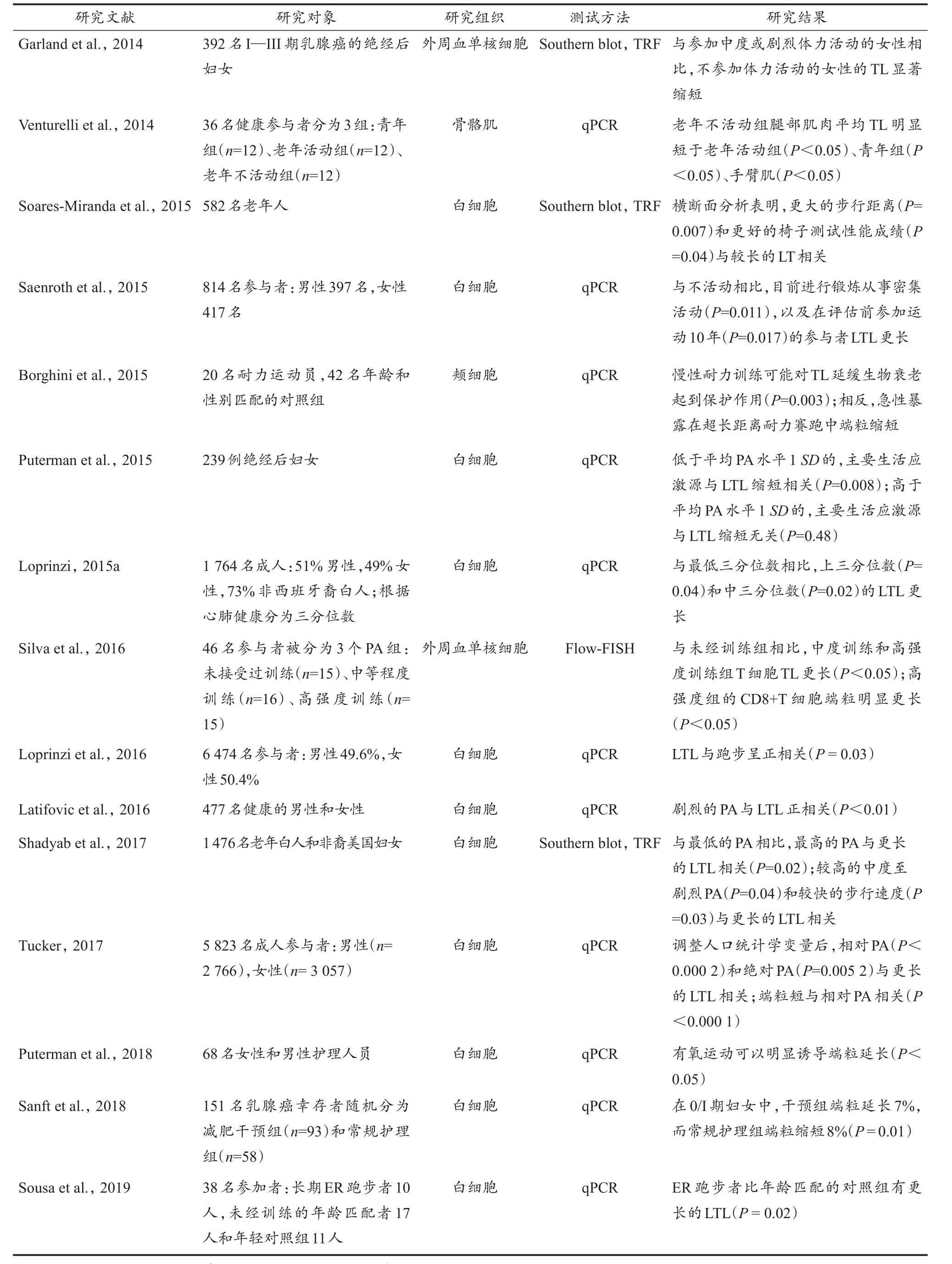
续表1
2.1 运动强度对端粒的影响
有研究显示,久坐行为会增加端粒的损耗,而进行一定程度的体育锻炼能够更好地延缓端粒磨损,这提示运动强度在运动与端粒长度的关系中有一定作用(Puterman et al.,2010;Sjögren et al.,2014)。Kim 等(2012)在研究定期的体育锻炼对绝经后妇女端粒长度的影响时发现,绝经后妇女在平均19个月内每周进行3次以上的60 min器械抗阻练习和有氧运动后,其外周血单个核细胞(peripheral blood mononuclear Cell,PBMC)端粒长度明显长于久坐的同龄人。处于I—III期乳腺癌的绝经后妇女参加中等强度到高强度的体力活动时,PBMC端粒长度也明显长于不运动的妇女(Garland et al.,2014)。Denham等(2013)的研究也表明,高强度的运动(75%O2max)比相同时间的中等强度运动(50%O2max)更能促进骨骼肌端粒的转录。以上研究表明,运动强度可能是运动影响端粒长度的一个重要决定因素,同时推测对于端粒长度的维持,是否存在一个理想的运动强度阈值,而且只有到达阈值后,运动才会对端粒长度起作用,但此阈值是否与年龄、性别、自身健康情况等有关,尚待进一步研究。
2.2 运动类型对端粒的影响
目前在运动与端粒长度关系的研究中,大部分的运动类型以耐力运动为主,少数为抗阻运动。耐力运动员由于大量的有氧运动训练而具有较高的心肺功能,其心血管疾病和癌症死亡率也比久坐的人低,同时寿命比久坐的人长(Garatachea et al.,2014)。研究发现,在平均每周跑80 km的中年(51岁)田径运动员中,端粒长度磨损减弱,且PBMC端粒长度与年轻(21岁)运动员相似(Werner et al.,2009),Larocca等(2010)的研究也发现了同样的结果。也有数据表明,平均每周跑40~100 km的超耐力运动员的白细胞端粒比正常人长11%,在另一组耐力(铁人三项、长跑和骑自行车)受试者中,耐力运动员的白细胞端粒更长,生物老化减弱(Denham et al.,2013)。基于以上,耐力运动训练可以保护端粒长度、延缓端粒磨损,同时,为了取得显著效果,建议坚持定期运动训练(Laine et al.,2015)。尽管目前还不清楚端粒长度在耐力运动员中有所保持的原因,但有证据显示,这可能是因为端粒长度对心肺功能的适应有一定作用。此外,抗阻训练对端粒长度的影响相对未知,值得进一步关注。
2.3 运动持续时间对端粒的影响
有研究显示,运动时间控制在每周至少4 h及以上的情况下,端粒长度变化与身体活动有关,同时久坐在屏幕前(看电视、玩电子游戏、使用电脑)每增加1 h,端粒缩短的概率就会增加7%,提示,运动持续时间在运动对端粒长度的影响中有着重要作用(Loprinzi et al.,2015b;Weischer et al.,2014)。Ornish等(2008)研究也发现,30名经活检诊断为低风险前列腺癌的男性进行每次30 min,每周6天,共3个月的步行活动后,端粒酶活性有显著增加。此外,一项667名青少年参与者的研究显示,通过佩戴7天的加速计来客观评估体力活动与白细胞端粒长度关系,发现两者并无关联,经过相关变量模型调整后显示,端粒长度与运动强度呈正相关,这提示对于年轻人而言,运动强度可能比运动持续时间更重要(Zhu et al.,2011)。综上所述,目前鲜见关于单独运动持续时间对端粒影响的研究,但结合已有的研究可看出,大部分的运动为长时间的有氧运动,而且通过对实验方案进一步的总结后发现,运动持续时间多为每次30 min或以上,每周3~6天,总持续时间3~12个月,甚至更长,这说明了运动持续时间的重要性(Denham et al.,2016)。结合相关研究(表1),推测运动持续时间所起的作用是否与年龄有关,目前还不确定,尚待进一步关注。
影响运动与端粒长度关系的因素除了上述几点,可能还与一些可控制因素(如受试者的年龄、体力活动的范围、端粒长度的测量)和不可控制的因素(如饮食和心理压力)有关(Mason et al.,2013;Mathur et al.,2013)。
3 运动延缓端粒长度磨损的可能机制
虽然目前的研究表明,运动可以延缓端粒磨损(Chilton et al.,2017;Denham et al.,2013),但运动对端粒发挥作用的机制尚未可知,目前关于运动影响端粒长度的作用机制存在如下解释。
3.1 端粒酶活性
端粒长度主要由端粒酶调节,端粒酶是一种催化端粒重复添加到染色体末端并促进基因组完整性和稳定性的酶,目前端粒酶已被证明可以增加端粒长度,促进细胞生长和寿命。作为端粒酶复合物的催化亚基TERT,它被认为是限制人体体细胞端粒酶活性的重要因素,运动后端粒酶活性的增加可以减少端粒长度的耗损(Aviv,2002)。Cluckey等(2017)对11名年轻人(男性5人、女性6人)和8名老年人(男性4人、女性4人)进行了高强度间歇骑车锻炼研究,测试他们对端粒酶活性的不同反应,以及这种反应是否具有性别特异性,结果表明,年轻人比老年人在运动后端粒酶活性有更大的增加;同时还发现,与女性相比,男性对急性耐力训练的TERT反应更高,而女性的这种反应与年龄无关。Zietzer等(2017)的研究表明,30 min的跑步时间足以增加22名年轻健康受试者外周血单核细胞端粒酶活性。因此推测,运动后端粒酶活性的增加可能是运动防止衰老的机制之一。
但有部分研究表明,端粒酶活性的增加在急性运动后似乎是短暂的。Puterman等(2018)对68名女性和男性护理人员的端粒酶活性和端粒长度进行了研究,结果发现,在有氧训练组中,训练后白细胞端粒长度增加,而非运动组的端粒长度则略有缩短,同时干预后两组PBMC端粒酶活性均无变化。因此可以推测,运动诱导的PBMC端粒酶活性升高可能是一种短暂的机制,并且在运动几小时后恢复到基础水平,但确切的动力学机制仍然需要确定(Puterman et al.,2018)。
3.2 炎症
炎症是机体对内源性和外源性损伤因子所作出的一种防御反应。Nimmo等(2013)研究发现,体力活动水平与炎症标志物之间成反比关系。Khan等(2012)研究表明,白细胞端粒长度缩短与促炎细胞因子白介素-6(Interleukin 6,IL-6)和肿瘤坏死因子(tumor necrosis factor-α,TNF-α)浓度升高有关,同时慢性炎症也可提高白细胞的周转率,从而增加端粒消耗率。因此推测,体育锻炼可能通过减轻炎症来保护端粒长度磨损。Parish等(2009)在研究中指出,运动训练可引起炎症标志物的下降,同时慢性炎症也可引起衰老、氧化应激和端粒酶活性的下调,如促炎细胞因子TNF-α可能通过下调端粒酶活性从而使端粒长度缩短(Khan et al.,2012)。因此,炎症的减弱可能是体育锻炼对端粒长度起保护作用的一种潜在作用机制。
3.3 氧化应激
氧化应激诱导的DNA损伤是细胞功能障碍、机体衰老、动脉粥样硬化、糖尿病和癌变的关键因素,尤其端粒DNA更容易受到氧化损伤(Hewitt et al.,2012),而大部分研究已证实,适当的体育锻炼可以改善机体的氧化应激反应(Sallam et al.,2016),因此从氧化应激角度探讨运动对端粒长度的影响,显得尤为必要。Rosado-Perez等(2018)在研究有氧能力和血液中氧化应激生物标志物之间的关系时发现,氧化应激会降低端粒酶活性,加速端粒磨损。Sallam等(2016)研究表明,适度、有规律的体育锻炼可以通过减轻氧化应激水平来延缓衰老。从机制上讲,这种抗氧化反应会导致氧化还原敏感转录因子的活化,如NF-kB、活化蛋白1和过氧化物酶体增殖物激活受体 γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)(Meyer et al.,1994)。其具体过程为运动激活AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)并通过核易位激活PGC-1α的转录和活化(Sallam et al.,2016;Wu et al.,1999),进入细胞核后PGC-1再诱导核呼吸因子1(nuclear respiratory factor 1,NRF1)的转录。因此推测,运动可通过激活PGC-1α氧化还原信号通路,刺激线粒体发生,进而改善线粒体随年龄增长而下降的抗氧化能力(Wu et al.,1999)。Chilton等(2017)研究证实,通过有规律的运动可以有效调节机体的内源性抗氧化能力,维持端粒长度进而降低癌症发生的风险,而且氧化应激似乎在端粒长度增加癌症风险的过程中发挥了重要作用,因此推测,运动可以通过减弱机体的氧化应激反应来维持端粒长度,但具体作用机制还有待深入研究。
3.4 TERRA调节
目前在研究运动对端粒长度影响的机制中,含有RNA的端粒重复序列(telomeric repeat-containing RNA,TERRA)。Azzalin等(2007)实验表明,端粒可以被转录成TERRA分子,一旦转录完成,TERRA仍与部分端粒相关,并发挥着保护端粒等重要功能(Rippe et al.,2015)。Denham等(2013)在细胞培养中发现,NFR1是人类端粒转录的重要调控因子,而PGC-1和AMPK是端粒转录的重要分子中间体。由于AMPK可以通过高强度或长期耐力运动被激活,因此有研究者进行了急性耐力训练能否上调人类骨骼肌端粒转录的实验,结果发现,AMPK活化的标志物乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)在运动后被诱导磷酸化,尤其是在高强度组更明显。同时发现在PGC-1易位到细胞核和TERRA诱导的过程中也存在同样的活化模式,而且由于NRF1能够激活端粒转录,因此推测,在运动诱导生成活性氧(reactive oxygen species,ROS)使机体产生氧化应激时,TERRA的上调则可能成为骨骼肌抗氧化反应的一部分(Denhamet al.,2013)。此外,由于TERRA在容易氧化的鸟嘌呤残基中含量较高,这也可能为TTAGGG端粒重复序列免受ROS的侵害起到一定保护作用。综上所述,运动可以诱导端粒转录,而且从长期来看,这可能为TERRA更新和保护骨骼肌端粒提供一种解释机制。
3.5 microRNAs调节机制
端粒长度受一系列表观遗传因素的影响,包括亚端粒DNA的甲基化、组蛋白修饰、端粒蛋白复合体的翻译修 饰 和 小 RNA(microRNAs,miRNAs)(Chilton et al.,2017),其中miRNAs在调节一系列不同生物学过程(癌症和衰老)中发挥着重要作用。有研究表明,miRNAs参与了运动后端粒酶活性和端粒长度的功能调节(Chilton et al.,2014)。Chilton等(2014)研究表明,急性运动诱导miR-186和miR-96在跑步后显著上调,同时下调与其结合的靶向端粒重复结合因子2相互作用蛋白(telomeric repeat binding factor 2 interacting protein,TERF2IP)。急性运动也会导致miR-15a在运动后显著上调,miR-15a的过度表达与其靶向肿瘤抑制因子TP53基因的抑制表达有关,这表明TP53作为端粒酶逆转录酶(telomerase reverse transcriptase,TERT)启动子的重要抑制因子,其C末端与端粒酶活性相互作用并抑制其活性(Rampazzo et al.,2017)。Chilton等(2017)的研究表明,在跑步运动后miR-155的表达下降,而miR-155的主要作用是抑制端粒重复因子1的翻译,因此推测运动可能通过促进TRF1的翻译,进而激活端粒酶活性,延缓端粒磨损。综上所述,目前的研究主要说明了miRNAs与端粒酶活性和端粒长度之间的相关性,同时这些研究结果更有助于理解运动对端粒酶活性和端粒长度的影响以及miRNAs的调控作用,但是对miRNAs介导的端粒内环境稳定作用的明确认识仍处于起步阶段,并且关于运动-miRNAs-端粒相互作用的具体途径,尚待进一步探索。
3.6 调节端粒长度的相关蛋白信号机制
为了阐明运动对端粒长度的保护作用机制以及更好地理解端粒如何响应生理应激等问题,有研究对运动如何改变啮齿动物组织中端粒相关蛋白的表达进行了探析。Werner等(2009)研究了端粒和端粒相关蛋白在左心室、主动脉、血管和免疫组织中的作用,以阐明运动如何使细胞产生适应性,以及是如何抵抗内环境变化。在研究C57BL/6小鼠的短期训练效果中(21天的自主跑),他们观察到与久坐对照组相比,运动组TERT蛋白、TRF2、Ku70和Ku80 mRNA表达水平升高,这些数据说明,啮齿类动物的短期运动训练与端粒长度和衰老保护表达谱的增加有关。为了确定21天的运动效果是否依赖于TERT蛋白,给予TERT基因敲除动物组3周跑步。结果发现,与野生型运动动物相比,运动对TRF2、p16、Chk2和p53的影响在运动敲除的动物中不存在(Werner et al.,2009)。这些数据提供了运动通过端粒相关蛋白(TERT蛋白)使机体产生适应的证据,同时表明在啮齿动物组织中TERT可能具有端粒外功能,如作为转录因子或染色质重塑复合物的一部分。
在不同品系的小鼠(CAST/Ei)中,Ludlow等(2012b)观察到,44周的自主跑时,端粒蛋白复合体(shelterin)和端粒酶的组织特异性反应。在骨骼肌中,运动导致端粒缩短,但端粒酶活性增加。在心肌中,运动可以减弱shelterin基因表达的年龄相关性降低,而在肝组织中则没有观察到明显的变化。这些数据表明,虽然运动对骨骼肌、心肌和肝脏3种组织都有益,但端粒长度调节蛋白的适应性反应是有组织特异性的。
综上所述,运动可以保护细胞环境,防止端粒缩短,进而保护心脏、血管和免疫细胞的衰老表型,同时shelterin和端粒酶以一种组织特异性的方式适应运动训练,运动可能导致端粒维持途径的组织特异性适应,然而,无论组织特异性如何变化,运动引起的组织表型都具有端粒保护作用。但是目前鲜见与端粒生物学改变有关的运动特异性信号传导机制的研究,对于这些机制的详细作用途径还需要进一步研究。
4 结论与展望
端粒缩短导致的细胞衰老可以通过运动来减缓,但维持端粒长度的最佳运动处方(运动强度、运动类型、运动持续时间)仍需进一步研究。运动对端粒长度的有益影响可能是通过端粒酶活性的增加、氧化应激的减轻、炎症的减轻和骨骼肌的TERRA上调等条件来介导的,同时还有miRNAs的调控及端粒相关蛋白的作用,但更为具体的作用机制仍有待进一步探究。
