一株新分离的猪伪狂犬病毒的评估
2021-04-05张智明李建华何世岷
方 超,张智明,李建华,何世岷
(哈药集团 生物疫苗有限公司,哈尔滨150069)
伪狂犬病(Pseudorabies,PR)是由伪狂犬病毒(PRV)引起的一种大多数哺乳动物及一些禽类的急性、烈性、高度接触性传染病,是一种能感染神经系统的疾。动物感染后出现发热、瘙痒等神经症状、脑脊髓炎或死亡等临床症状。PR是影响全球猪养殖业的主要的传染病之一,给世界各国养猪业造成的经济损失十分巨大。因此,世界各国对此病十分重视,并开启和实施了根除PR的计划,且取得了阶段性的胜利[1-5]。但自2010年起,PRV出现新的变异株,使PR在全球尤其是我国出现新一轮的暴发,有很多PRV变异毒株被分离和鉴定[6-9]。黑龙江省是一个养猪大省,部分地区也存在PR的流行,因此,在黑龙江省进行PRV的分离与鉴定,有助于了解病毒的流行情况,并为伪狂犬病的防控提供帮助[10]。
本研究对经过鉴定、纯化的PRV现地分离株进行继代培养,与经典PRV Ra株对比绘制病毒生长曲线,以确定其最佳培养时间,并检测该分离株对不同动物的致病力,以期为后续试验的顺利开展做好铺垫。
1 材料
1.1 样品
已纯化的PRV现地分离株,中国兽医药品监察所惠赠;经典PRV Ra株,购于中国兽医药品监察所,由哈药集团生物疫苗有限公司研发中心传代保存。
1.2 细胞及主要试剂
F16代Vero传代细胞系,由哈药集团生物疫苗有限公司研发中心保存;DMEM F12培养基,含0.25% EDTA胰酶,购自GIBCO公司;胎牛血清,购自CLARK公司;PBS溶液,由哈药集团生物疫苗有限公司研发中心配制;DNA/RNA提取试剂盒,购自天根生化科技(北京)有限公司;PRV引物,生工生物工程(上海)有限公司合成;其他试剂均为国产分析纯。
1.3 试验动物
体重1.5~2.0 kg家兔4只,由东北农业大学实验动物中心提供;体重18~22 g小白鼠10只,购自哈尔滨医科大学附属第二医院;PRV血清中和抗体为阴性的4~6周龄断奶仔猪3头,购自哈尔滨周边某猪场。
2 方法
2.1 细胞的复苏
将液氮中保存的F16代Vero细胞取出1支,迅速放入准备好的37℃左右的温水中并不断晃动,使冻存的细胞快速解冻。待细胞完全解冻后,在1 000 r·min-1条件下离心5 min,弃上清液,用含有8%胎牛血清的DMEM F12细胞培养液轻轻悬浮并分散均匀,然后转入T 25细胞瓶中。复苏的细胞置37℃、5% CO2的培养箱中培养,根据细胞的生长情况,可于复苏24 h左右进行1次换液处理,待细胞形成90%以上单层时进行传代或接毒,用于病毒的分离培养。
2.2 病毒的分离培养
取形成单层的Vero细胞,弃去细胞培养液,用无菌的PBS液轻轻洗涤2次,将纯化好的PRV现地分离株按照培养体积10%的比例接种于细胞单层上,接种完成后置于37℃、5% CO2的培养箱中吸附作用1 h,期间轻轻晃动2~3次,补加含有2%胎牛血清的DMEM F12细胞维持液后继续培养,每天观察细胞病变情况。同时设条件相同的不接毒细胞作为空白对照。
接种后,当观察到细胞病变达到80%以上时收获,置-80℃冰箱反复冻融3次,按照上述方法进行传代,直至出现稳定的细胞病变;当观察不到细胞病变时,在细胞培养后的4~5 d收获,按照上述方法进行盲传,盲传3代后仍观察不到病变,则判定此次病毒分离的结果为阴性。
2.3 病毒含量的测定
待Vero细胞形成单层后,按照1:3的传代比例进行传代,传代后将细胞悬液按照每孔100μL的量加入96孔细胞培养板中,37℃、5%CO2条件下培养48~72 h,待Vero细胞形成单层后,弃去培养板中的细胞培养液,备用。将收获的病毒液用无血清DMEM F12培养液进行10倍倍比稀释,取10-1、10-2、10-3、10-4、10-5、10-6、10-77个 稀 释 度,接种到上述的96孔细胞培养板中,每个稀释度接种6孔,每 孔100μL。同 时 设 正 常 细 胞 对 照6孔,置37℃、5% CO2培养箱中培养4~5 d,每天观察细胞病变情况,按Reed-Muench法计算病毒的半数细胞培养物感染量(TCID50)。
2.4 病毒的鉴定
2.4.1 引物设计
按照《伪狂犬病诊断方法》(GB/T 18641—2018)中检测PRV gD基因的引物序列合成引物,上游引物序列为5'-CAGGAGGACGAGCTGGGGCT-3',下游引物序列为5'-GTCCACGCCCCGCTTGAAGCT-3',扩增片段长度217 bp。引物由生工生物工程(上海)有限公司合成。
2.4.2 反应条件
将收获的病毒液按天根生化科技(北京)有限公司的病毒基因组DNA/RNA提取试剂盒说明书的相关操作流程提取DNA,用2.4.1中的引物进行鉴定,PCR扩增反应体系(25μL):2×GC Buffer 12.5μL,dNTP 2.0μL,上游引物1.0μL,下游引物1.0μL,灭菌去离子水7.0μL,DNA模板1.0μL,Taq酶0.5μL。PCR扩增反应条件:95℃预变性5 min;94℃变性30 s;56℃退火30 s,72℃延伸30 s,循环35次;72℃延伸10 min,4℃终止循环。
2.4.3 反应结果的观察
将反应产物经1%琼脂糖凝胶电泳,电泳后在凝胶成像系统下或紫外灯下进行PCR反应结果的观察。
2.5 病毒生长曲线的绘制
将病毒以0.01 MOI的接种量接种于形成单层的Vero细胞12瓶,按照2.2的方法,在吸附1 h后,换加细胞维持液进行病毒培养。在病毒接种后,每隔6 h收获1瓶接毒细胞,直至接毒的细胞全部收获完毕。将上述收获的细胞冻融3此后,按照2.3所述的方法进行各收获时间病毒含量的测定并绘制病毒的一步生长曲线。
2.6 病毒的致病力试验
2.6.1 对家兔的致病力试验
取4只体重为1.5~2.0 kg的成年家兔,其中2只经后腿肌肉接种分离的病毒液,2.0 mL·只-1,另外2只按相同的方式接种细胞维持液,2.0 mL·只-1。攻毒组和空白组在相同条件隔离饲养,逐日观察并记录家兔的发病和死亡情况。
2.6.2 对小白鼠的致病力试验
取10只体重18~22 g小白鼠,随机分成2组,每组5只。一组经后退肌肉接种分离的病毒液,0.2 mL·只-1,另外一组按照相同的方式接种细胞维持液,0.2 mL·只-1。攻毒组和空白组在相同条件隔离饲养,逐日观察并记录小白鼠的发病和死亡情况。
2.6.3 对分离动物的致病力试验
取3头4周龄断奶仔猪,随机选择其中2头,分别经滴鼻和肌肉注射的方式接种分离的病毒液4.0 mL,滴鼻和肌肉注射各2.0 mL,另外1头仔猪按照肌肉注射的方式接种细胞维持液,4.0 mL·头-1,攻毒组和空白组在相同条件下隔离饲养,逐日观察并记录断奶仔猪的发病和死亡情况。
3 结果与分析
3.1 病毒的分离培养
将病毒接种于长满单层的Vero细胞,接种后24 h细胞出现圆缩、膨大以及融合等PRV典型的细胞病变,随着时间的增加,细胞病变也加重,在48 h的时候有超过80%的细胞病变并脱落,见图1。此时终止培养并收获培养液,反复冻融3次后进行传代,结果细胞出现稳定的细胞病变。表明分离得到一株病毒培养物(ZJS)。
3.2 病毒的鉴定
取收获的病毒液,用核酸提取试剂盒进行核酸的提取和PCR鉴定,结果病料扩增出与PRV Ra株大小一致的片段,扩增结果见图2。此结果也证明了分离获得的病毒产物是PRV。

图1 PRV分离结果(10×)
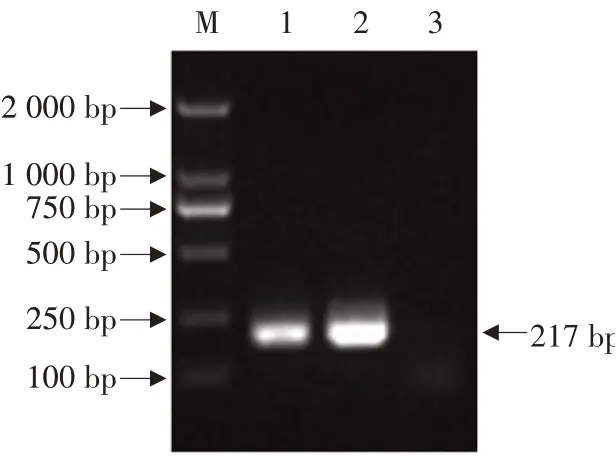
图2 病料的PCR检测结果
3.3 病毒的生长曲线
将病毒分离株和经典Ra株分别以0.01 MOI的接种量接种到形成单层的Vero细胞上,在不同的时间取样收获病毒培养物,进行病毒含量的测定,结果见表1。由表1中数据可知,病毒分离株(ZJS)的繁殖速度较快,在接种后6 h时病毒含量即可达到100.5TCID50·mL-1,在42 h时病毒含量达到最高值108.17TCID50·mL-1,随后达到平台期,随着培养时间的延长,培养的病毒含量有所下降;Ra株的起始繁殖速度较分离株慢,在6 h仍然测不出病毒含量,随后病毒开始增值,在48 h时病毒含量达到最高值,为107.25TCID50·mL-1,随后达到平台期,随着培养时间的延长,培养的病毒含量有所下降。按照测定的数据绘制分离株和Ra株的一步生长曲线,见图3。

表1 不同培养时间的病毒含量测定结果

图3 病毒的一步生长曲线
由图3可知,分离株和Ra株的有着相似的生长特性,但分离株ZJS的最高病毒含量要高于Ra株的,病毒含量达到峰值的时间也较Ra株的时间短。
3.4 致病力试验
3.4.1 对家兔的致病力
家兔接种PRV分离株后,每天观察临床症状。结果在接毒24 h后家兔开始发病,表现为精神比较兴奋、厌食,接种部位有发痒的症状,家兔开始回头舔咬,接毒48 h后家兔出现精神亢奋、狂躁不安、食欲基本废绝,接种部位瘙痒加剧,家兔啃咬接种部位的频率加快,即便接种部位的皮肤脱毛甚至出血也不能让家兔啃咬的动作停下来,之后很快出现肌肉震颤等神经症状,在接种48 h左右,2只接种兔子分别出现角弓反张、卧地不起症状,最后相继死亡。而对照家兔在观察期内未见明显的临床症状变化,健康状况良好。表明分离的PRV对家兔有较强的致病性。
3.4.2 对小白鼠的致病力
小鼠接种PRV分离株后,每天观察临床症状。结果在接毒24 h后没有观察到明显的临床症状,小鼠饮食、活动正常;在攻毒48 h后小鼠开始出现伪狂犬病比较典型的临床症状,如多动、活跃、开始啃咬接种部位,食欲下降等;在攻毒72 h后有2只小鼠死亡,其余攻毒小鼠出现烦躁、亢奋、频繁啃咬接种部位等症状;攻毒后84 h左右,攻毒小鼠全部死亡。未攻毒小鼠在观察期内未见明显的临床症状变化,健康状况良好。表明分离的PRV对小鼠有较强的致病性。
3.4.3 对断奶仔猪的致病力
断奶仔猪接种PRV分离株后,每天观察临床症状,并对所有仔猪进行测温。结果在接毒24 h后攻毒仔猪出现临床症状,表现为精神萎靡、食欲不振,体温升高等;攻毒48 h后表现为聚集、卧地不起、食欲废绝、体温升高以及呼吸加重等,有1头猪出现腹泻症状;攻毒后72 h时临床症状进一步加重,出现腹式呼吸、肌肉震颤以及站立不稳等症状;攻毒后96 h时有1头仔猪死亡,另外1头仔猪体温降低、卧地不起,张口呼吸,在102 h时死亡。未攻毒仔猪在观察期内未见明显的临床症状变化,健康状况良好。表明分离的PRV对仔猪有较强的致病性。
4 结 论
该现地分离株在细胞单层上分离培养效果良好,与PRV Ra株对比绘制的病毒生长曲线显示,该分离株和Ra株有着相似的生长特性,但同一时间,分离株的最高病毒含量要高于Ra株,病毒含量达到峰值的时间的也较Ra株短。从不同动物致病力试验结果可见,该分离株致病能力强。本研究为后续的疫苗制备筛选到一株优良的备选毒株。
