黄芪总皂苷对缺氧性肺动脉高压作用探讨
2021-04-04李旭东马勇邓润鹏苍雪玉吴飞燕李永涛金海峰
李旭东,马勇,邓润鹏,苍雪玉,吴飞燕,李永涛,金海峰
目前,世界卫生组织将肺动脉高压分为动脉性肺动脉高压、与左心疾病相关的肺动脉高压、缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)、由肺动脉阻塞引起的肺动脉高压、未知和(或)多因素所致肺动脉高压5个亚类。研究显示,肺部疾病和(或)长期低氧造成的肺部持续性低氧状态可引起HPH[1]。HPH的病理特点是肺动脉的病理性重构及肺动脉压力的升高,进而导致右心室压力的超负荷,甚至右心室衰竭[2]。目前,临床尚缺乏有效治疗HPH的药物。黄芪(astragali radix)为传统中草药,其有效药用成分是黄芪总皂苷(astragaloside,AST)、多糖及黄芪总黄酮[3−4]。柳济成等[5]证实,黄芪注射液可通过调节大鼠肺组织中的内皮素−1和一氧化氮水平,治疗大鼠HPH。然而,有关黄芪中最有效药用成分之一的AST对HPH的治疗作用及其可能机制的研究少见报道。本研究通过建立HPH模型大鼠并给予AST,研究其对HPH模型大鼠肺动脉压力及肺动脉结构重建的影响,并探讨其可能作用机制。
1 材料与方法
1.1 材料AST[紫外分光光度法(UV)≥98%]购自上海源叶生物科技有限公司,批号:J30N9T76378。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)检测试剂盒均购自碧云天生物技术有限公司。兔抗还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(Nox2)多克隆抗体、兔抗Nox4单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG二抗、山羊抗小鼠IgG二抗购自ABclonal Technology。小鼠抗α−平滑肌肌动蛋白(α−SMA)单克隆抗体、兔抗β−actin单克隆抗体购自Santa Cruz Biotechnology。
1.2 方法
1.2.1 实验动物与分组28只SPF级雄性SD大鼠(体质量180~200 g,7周龄)购自齐齐哈尔医学院实验动物中心[实验动物合格证号:SCXK(黑)2016−001−001]。大鼠按随机数字表法 均 分为对照组、HPH组、HPH+AST15 mg/(kg·d)组(HPH+AST15组)、HPH+AST45 mg/(kg·d)组(HPH+AST45组)。采用间断式常压低氧建立大鼠HPH模型。HPH组、HPH+AST15组、HPH+AST45组大鼠置于10%O2体积分数的低氧箱中,低氧时间为18 h/d,持续28 d。AST利用DMSO配制成母液,用无菌生理盐水进一步配制成终浓度为0.5%的DMSO,腹腔注射于HPH+AST15组和HPH+AST45组大鼠。HPH组大鼠腹腔注射同等体积的含有0.5% DMSO的生理盐水。
1.2.2 血流动力学检测实验28 d后,各组大鼠行腹腔注射麻醉,并将充满肝素的PE导管经大鼠右侧颈静脉插入到右心室,利用BL−420S生物信号采集与分析系统监测各组大鼠肺动脉压力的指标右心室收缩压力(right ventricle systolic pressure,RVSP)。
1.2.3 肺组织HE染色将大鼠肺组织剪成3 mm×3 mm的组织块,并进行固定、脱水、透明、浸蜡、包埋等操作,再将组织块切成4μm厚的切片,进行HE染色。利用Image Pro Plus 6.0图像分析系统进行观察并测量肺动脉的血管总面积、中膜面积、外径以及内径。肺动脉厚度百分比(WT)=(外径−内径)/外径×100%;肺动脉面积百分比(WA)=中膜面积/血管面积×100%。
1.2.4 右心室肥厚指标检测游离出大鼠心脏,去除左、右心房,将心室分成右心室(right ventricle,RV)和左心室+室间隔(left ventricle plus septum,LV+S),并分别称质量。计算右心室肥厚程度:RV/(LV+S)。
1.2.5 肺组织免疫荧光染色肺组织切片经脱蜡、复水、抗原修复、内源性过氧化物酶阻断、血清封闭,行免疫荧光染色观察α−SMA,DAPI行细胞核染色。利用Image Pro Plus 6.0图像分析系统测量α−SMA的光密度(OD)值,判断肺动脉增生情况。
1.2.6 各组SOD、CAT及MDA水平检测抽取大鼠颈外动脉血2 mL,3 000 r/min离心15 min,提取血清;取适量大鼠肺组织制成10%匀浆,12 000 r/min离心10 min,提取上清液。参照检测试剂盒说明书,利用分光光度法检测大鼠血清及肺组织中的SOD、CAT及MDA水平。
1.2.7 Western blot法检测肺组织Nox2和Nox4蛋白提取大鼠肺组织总蛋白,用BCA试剂盒测定蛋白浓度。等量蛋白经SDS−PAGE电泳后转移至PVDF膜,5%牛奶封闭。孵育一抗,Nox2(1∶1 000),Nox4(1∶1 000),β−actin(1∶3 000),4℃过夜,洗膜,室温孵育辣根过氧化物酶标记山羊抗兔IgG(1∶3 000)1.5 h,洗膜。利用ECL发光试剂盒,检测大鼠肺组织中Nox2和Nox4蛋白表达变化。实验重复4次。
1.3 统计学方法采用SPSS 22.0统计学软件进行数据分析。符合正态分布的计量数据以均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD−t法,P<0.05为差异有统计学意义。
2 结果
2.1 AST对大鼠RVSP及右心室肥厚的影响与对照组比较,HPH组大鼠RVSP和RV/(LV+S)均升高(P<0.05);与HPH组比较,HPH+AST15组和HPH+AST45组 大 鼠RVSP和RV/(LV+S)均 降 低(P<0.05),HPH+AST15组和HPH+AST45组RVSP和RV/(LV+S)差异无统计学意义,见表1。
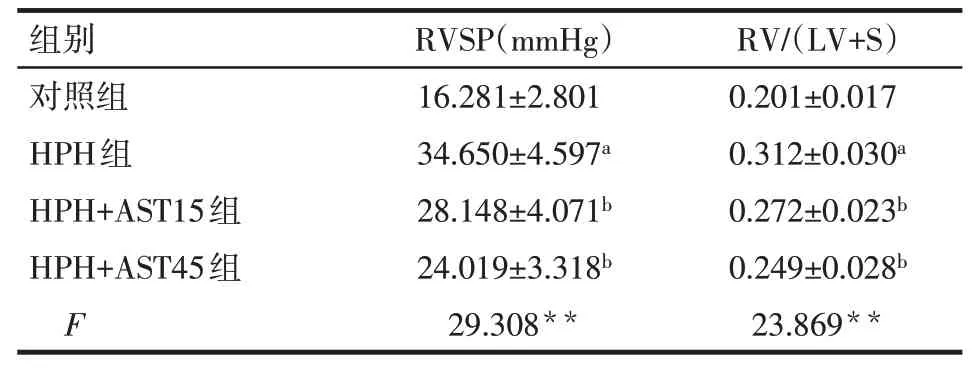
Tab.1 RVSP and RV/(LV+S)in the four rat groups表1 各组大鼠RVSP和RV/(LV+S) (n=7,x±s)
2.2 AST对大鼠肺动脉结构重建的影响大鼠肺组织HE染色及α−SMA免疫荧光染色结果显示,与对照组比较,HPH组WT、WA及α−SMA水平均升高(P<0.05);与HPH组比较,HPH+AST15组和HPH+AST45组大鼠WT、WA及α−SMA水平均降低(P<0.05),其中HPH+AST45组较HPH+AST15组WT、WA及α−SMA水平更低(P<0.05),见表2,图1、2。
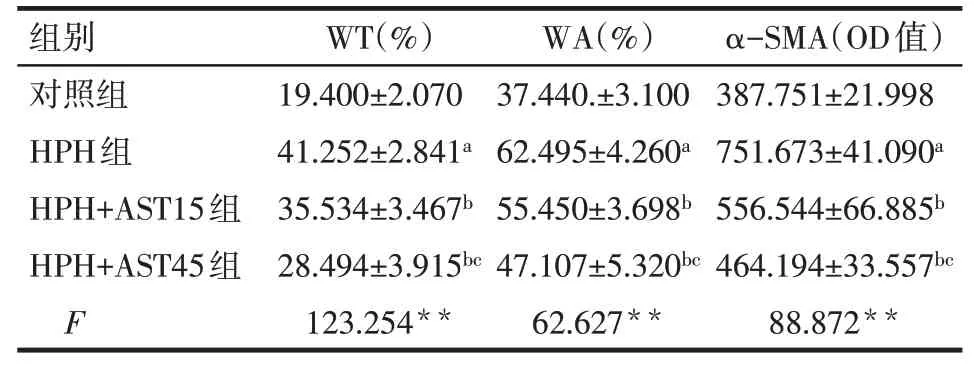
Tab.2 Comparison of WT,WA andα-SMA OD value of pulmonary arteries between the four rat groups表2 各组大鼠肺动脉WT、WA及α-SMA情况比较(n=7,x±s)
2.3 各组肺组织及血清中SOD、CAT、MDA比较与对照组比较,HPH组肺组织和血清SOD和CAT水平均降低,MDA水平升高(P<0.05);与HPH组比较,HPH+AST15组和HPH+AST45组肺组织和血清SOD和CAT水平升高,MDA水平降低(P<0.05)。HPH+AST45组肺组织MDA水平较HPH+AST15组更低(P<0.05),而HPH+AST15组和HPH+AST45组血清中的SOD、CAT、MDA水平差异无统计学意义,见表3。
2.4 AST对大鼠肺组织中Nox2和Nox4蛋白表达的影响与对照组比较,HPH组肺组织中的Nox2和Nox4蛋白表达水平升高(P<0.05);与HPH组比较,HPH+AST15组和HPH+AST45组肺组织中的Nox2和Nox4蛋白表达水平降低(P<0.05),而HPH+AST45组较HPH+AST15组Nox2和Nox4蛋白表达水平亦降低(P<0.05),见表4、图3。

Tab.3 Comparison of the SOD,CAT and MDA levels both in lung tissues and in serum between the four rat groups表3 各组大鼠肺组织及血清中的SOD、CAT、MDA水平比较 (n=7,x±s)
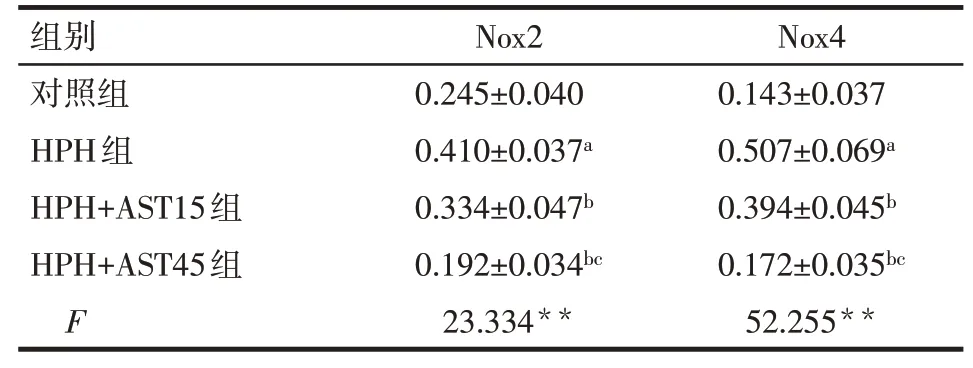
Tab.4 The protein levels of Nox2 and Nox4 in the different rat groups表4 各组大鼠肺组织中的Nox2和Nox4蛋白表达(n=4,x±s)
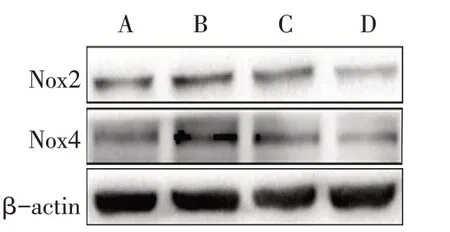
Fig.3 The protein levels of Nox2 and Nox4 in the different rat groups图3 各组大鼠肺组织中的Nox2和Nox4蛋白表达
3 讨论
黄芪作为我国传统中草药用于治疗各种相关疾病已有上千年历史[6]。AST是黄芪中皂苷类化合物的总提取物,目前已被证明其对心血管疾病、脑血管疾病、肾脏损伤、肝癌、肺纤维化、糖尿病等均具有治疗作用[3,7]。本研究结果显示,与对照组比较,HPH组大鼠RVSP、RV/(LV+S)、WT、WA及α−SMA水平均升高,表明HPH组大鼠出现明显的肺动脉压力升高、右心室肥厚、肺动脉的增生和结构重建,HPH+AST15组和HPH+AST45组大鼠RVSP、RV/(LV+S)、WT、WA及α−SMA水平较HPH组大鼠均明显降低,证明AST能够有效抑制大鼠HPH的病理进展。
在HPH的病理发展过程中,低氧诱导而过量产生的活性氧(reactive oxygen species,ROS)会导致肺动脉中层平滑肌细胞的过度增生,从而造成肺动脉结构重建、肺动脉管壁的增厚、管腔变狭小、肺动脉压力的进行性升高以及右心室的肥厚[8]。研究显示,在低氧条件下,生物体内的线粒体、NADPH氧化酶系统等会产生大量过氧化氢(H2O2)、超氧化物阴离子(O2·−)等ROS物质,这些物质会参与肺血管张力的改变、肺动脉内皮细胞的功能失调、肺动脉平滑肌细胞的过度增生等血管病变发展过程[9−10]。在促进肺动脉平滑肌细胞增生方面,ROS可作为第二信使激活磷脂酰肌醇3−激酶/蛋白激酶B(PI3K−Akt),丝裂原活化蛋白激酶/细胞外信号调节酶(MAPK−ERK)等与增殖相关的信号通路,从而在低氧诱导的平滑肌细胞过度增生过程中发挥着重要作用[11]。NADPH氧化酶包括7个亚型,肺组织主要表达Nox1、Nox2、Nox4及Nox5亚型[12]。其中,Nox2和Nox4在肺动脉内皮细胞、肺动脉中层平滑肌细胞以及肺动脉外膜成纤维细胞中均有表达,并且在ROS的产生过程中起着主导性作用[13]。为应对过量ROS对组织或细胞的损伤,机体分泌的SOD和CAT等抗氧化酶在清除过量ROS及调节氧化应激损伤中发挥着重要作用[14]。MDA为脂质过氧化反应的标志物,其水平可间接反映机体氧化应激的损伤程度。在HPH的病理发展过程中,长期低氧会造成机体抗氧化酶的功能失常及活性降低,从而导致清除ROS能力减弱,引起MDA水平升高。因此,在HPH的病理发展过程中,如何有效抑制低氧诱导的NADPH氧化酶活性,从而降低ROS的过量产生,并提高抗氧化酶活性,是防治HPH的有效方法。Ma等[15]研究显示,在心肌缺血模型大鼠中,AST能够通过提高大鼠体内SOD水平,降低MDA水平,从而抑制ROS对心肌细胞的损伤。另外,Qiu等[16]证实在高同型半胱氨酸血症模型大鼠中,AST可通过降低大鼠血管ROS水平,并提高SOD和CAT水平,对血管内皮细胞具有良好的保护作用。本研究结果显示,AST不但能够有效提高SOD和CAT两种抗氧化酶水平,降低MDA水平,而且能够有效抑制低氧诱导的Nox2和Nox4两种氧化酶在大鼠肺组织中的高表达,提示AST抑制大鼠HPH的病理进展可能是通过降低Nox2和Nox4的表达及改善SOD和CAT活性来实现的。另外,HPH+AST45组大鼠肺组织中的Nox2和Nox4蛋白表达水平和MDA水平均低于HPH+AST15组,证实AST在大鼠肺组织中降低氧化酶活性及抑制氧化损伤方面,高剂量作用效果更加显著。
综上所述,AST作为一种良好的抗氧化物质,可通过抑制体内的氧化应激损伤,对HPH模型大鼠肺动脉压力的升高、肺动脉增生及结构重建产生良好的抑制作用。
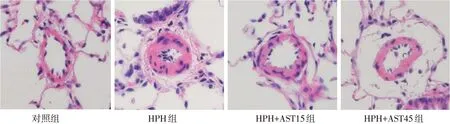
Fig.1 HE staining of pulmonary arteries in the different rat groups(×400)图1各组大鼠肺动脉HE染色(×400)
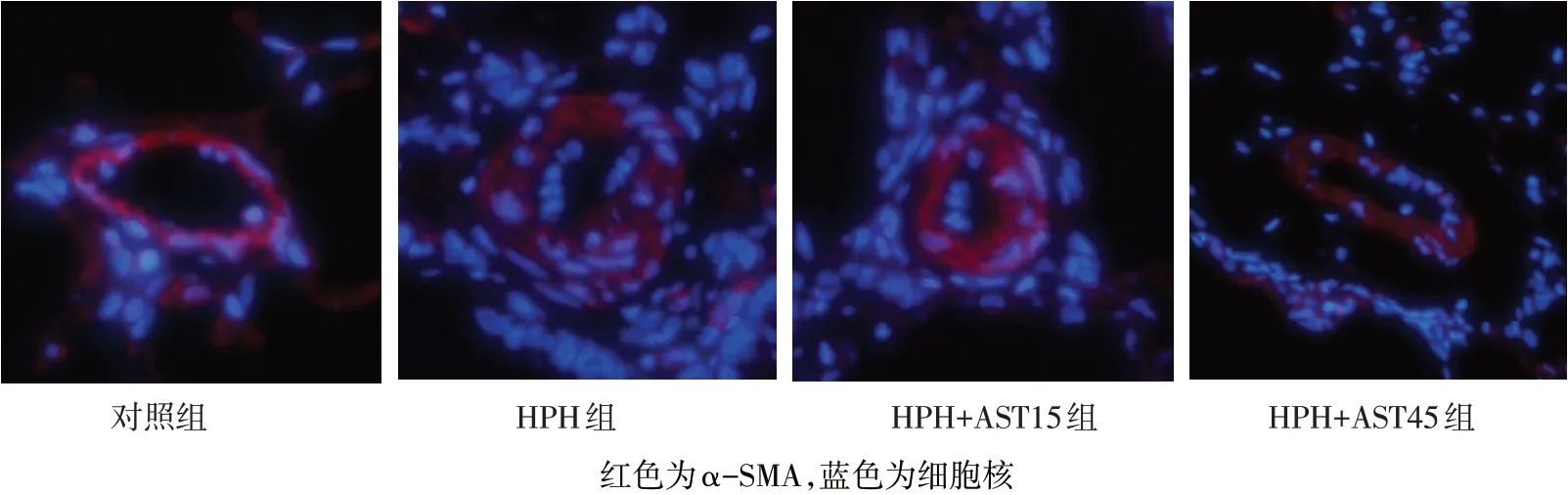
Fig.2 Theα-SMA immunofluorescence staining of pulmonary arteries in the different rat groups(×400)图2各组大鼠肺动脉α-SMA免疫荧光染色(×400)
