共振论在有机化学解题中的应用探究*
2021-04-02李海浪祝姗姗叶廷秀罗红元毕丽伟彭跃颜
李海浪,祝姗姗,叶廷秀,罗红元,秦 飞,毕丽伟,彭跃颜
(厦门医学院药学系,福建 厦门 361023)
有机化学作为化学学科的一个重要分支,研究有机化合物的来源、结构、性质、分离、制备、应用以及有关理论的一门学科[1]。有机化学一个显著的特点是信息量大,知识之间的逻辑关系相对于其他课程要弱一些,学生在学习时会觉得需要记忆大量的知识内容[2]。学习有机化学的最终目的是掌握有机化合物之间的相互转变规律,为我所用合成有价值的有机分子。有机反应普遍都要经历一个甚至多个过渡态和中间体的过程,而过渡态尤其是中间体对产物的生成起到至关重要的作用[3]。在有机化合物相互转变的过程中不可避免会涉及到化学键的断裂与生成。有机化合物分子是由较多原子结合而成的复杂分子,当它和一个试剂发生反应时,分子的各个部位都可能会受到影响[4]。共振论可以把大量的有机化学和结构化学事实联系起来,按照共振论给出的一套做法确实可以得出不少正确的答案[5]。本文利用共振论解决含不饱和键(C=C、C≡C、C=O)有机化合物的亲电加成与亲核加成问题为例,介绍通过合理整合知识点以重构学习资源,努力探索教育教学新方法,以期最大程度提高课堂教学效果。
1 有机化学反应的实质就是分子中旧键的断裂和新键的形成
1.1 均裂和自由基型反应
共价键的均裂是指组成共价键的一对电子,在共价键断裂后平均分布到共价键连接的两个原子或基团上。
A:B → A·+B·
共价键均裂后产生的带有单电子的原子或基团称为自由基。自由基的稳定性顺序为:3 ℃·>2 ℃·>1 ℃·>H3C·。从左到右方向为化学键的均裂,从右到左方向为自由基机理化学键的形成。
1.2 异裂和离子型反应
共价键的异裂是指共价键断裂后,成键的一对电子完全归成键的一个原子或原子团所有,产生正离子和负离子。
A:B → A++ B-
碳正离子、碳负离子也是有机化学反应中的活泼中间体。简单烷基碳正离子的稳定顺序为:3 ℃+>2 ℃+>1 ℃+>H3C+;从左到右方向为化学键的异裂,从右到左方向为离子型机理化学键的形成[6]。
2 共振论
Pauling和Wheland认为,当一些分子、离子或自由基,按价键规则无法用一个经典的Lewis结构式圆满地表达时,则可用若干经典结构式来表达其结构,真实结构是这些经典结构的叠加体[1]。
2.1 能力学原理
两个中心距离为r的球,它们所荷正、负电荷分别为q1、q2,并且按球对称的方式分布。那么,两球之间的极限静电位能应当为-q1· q2/r。但实际上,荷电圆球之间还会产生诱导作用,并相互改变对方的电荷分布,而电荷分布的改变一定是按照降低位能的方向进行,因此,诱导作用是使体系的位能进一步降低的因素[5]。
2.2 键型变异原理
在有机分子和其他共价分子中,共价键只要有可能使键能增大,则一定会偏离极限键型而发生变异,而键型的变异也就一定会导致额外的键能[5]。C-C单键、C=C双键、C≡C叁键、C=O双键、C-H键、C-O键、C-N键以及C-X键等共价键是经典结构式和Lewis电子结构式抽象出来的极限键型。实际上,由于分子中不相邻原子间的相互作用,在一个实际分子中,化学键总是或多或少程度上偏离这些极限键型。
3 共振论在不饱和键亲电加成中的应用
3.1 烯烃与HBr的亲电加成
以CH2=CH-CH3为例,CH2=CH-CH3存在如下三个共振式:
(1) (2) (3) (4)
其中,共振式(4)占比不高,理由是碳负离子直接与给电子基团甲基相连会造成负电荷密度增大,电荷密度越高越不稳定。烯烃与H Cl的反应为离子型成键机理,即:
A++ B-→ A-B。显然,产物为CH3-CHCl-CH3。如果把CH2=CH-CH3的甲基换成强吸电子基团-C≡N,则CH2=CH-C≡N存在如下共振式:
(1) (2) (3) (4)
其中,共振式(3)占比不高,理由是碳正离子直接与强吸电子基团-C≡N相连会造成正电荷密度增大,电荷密度越高越不稳定。烯烃与H Cl的反应为离子型成键机理,即:A++ B-→ A-B。显然,产物为CH2Cl-CH2-C≡N。如果把CH2=CH-CH3的甲基换成既有p-π共轭给电子又有吸电子诱导效应的Cl,则:CH2=CH-Cl存在如下共振式:
(1) (2) (3) (4)
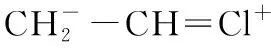
3.2 烯烃与HBr的自由基加成
以CH2=CH-CH3为例,CH2=CH-CH3存在如下四个共振式:
CH2=CH-CH3↔CH2=CH-CH2H↔
(1) (2)
(3) (4) (5)
自由基反应采取的是A·+B·→A:B的成键方式,因此,共振式(4)、(5)在烯烃的自由基反应中不重要。在共振式(3)CH2·-·CH-CH3中,当Br·与2°自由基成键时,形成中间体CH2·-CHBr-CH3,该中间体含有1°自由基很不稳定,反应活化能很高,因此,这条反应路径难以进行;当Br·与1°自由基成键时,形成中间体CH2Br-·CH-CH3,该中间体含有2°自由基比较稳定,反应活化能较低,因此,这条反应路径比较容易进行。接着,中间体CH2Br-·CH-CH3从HBr分子中截取一个氢原子H·形成产物CH2Br-CH2-CH3。CH2=CH-CH3与HBr反应分为两种情况:一种情况是没有过氧化物存在,另一种情况是有过氧化物存在。这两种情况得到两种不同的产物,国内外有机化学教材都分别给这两种情况分别称为马氏规则与反马氏规则。
有机化学这门学科反应多、知识点多、知识点之间相互联系相对不是那么紧密,给学习者造成有机化学的学习跟英语学习一样的假象。笔者认为,分散的、点点滴滴的规律越少越好,杂乱的规律数量太多容易造成混乱,最好是一招鲜吃遍天的规律,也就是普适性的规律。其实,有机化学反应普遍都要经历一个甚至多个过渡态与中间体,中间体是一个能量比反应物高的、瞬间存在的物种。中间体越不稳定、能量越高,则反应的活化能也越高,反应就越不容易进行。从分析中间体的稳定性入手,往往发现答案的捷径。从CH2=CH-CH3与HBr反应的两种情况看,一个普适性的规律就是分析C+和C·中间体的稳定性,即可顺理成章得出正确答案。
4 结 语
共振论能够把大量有机化学和结构化学的事实联系起来,而按照它给出的一套做法,一般也是可以得出大体上正确的答案。本文采用共振论对有机化学反应问题进行了集中的分析和讨论,通过具体例子将碳正离子和自由基中间体的稳定性与有机反应产物关联起来。以共振论为指导,可以显著降低了有机反应相关知识内容的学习难度,并对学生的创新思维起到了有效的锻炼和促进作用。
