青花菜BoSCL3基因的克隆和渍水胁迫下的表达特征分析
2021-04-02裴徐梨付双荆赞革唐征林燕黄丽
裴徐梨, 付双, 荆赞革,*, 唐征, 林燕, 黄丽
青花菜基因的克隆和渍水胁迫下的表达特征分析
裴徐梨1, 付双1, 荆赞革1,2*, 唐征2, 林燕1, 黄丽1
(1. 昆明学院农学与生命科学学院, 昆明 650214; 2. 温州科技职业学院农业与生物技术学院, 浙江 温州 325006)
为了解(scarecrow-like 3)基因的功能,从青花菜(var.)中克隆得到1个基因,命名为,其cDNA全长1 355 bp,编码446个氨基酸。BoSCL3分子量为49.96 kD,为疏水性蛋白,与油菜()、芜菁()中SCL3蛋白的亲缘关系最近,同科植物的SCL3具有较高的同源性。荧光定量PCR分析结果表明,青花菜基因表达量随渍水胁迫时间延长先下降后上升,推测其可能参与渍水胁迫响应。这为探讨青花菜基因响应渍水胁迫的分子机制提供理论依据。
青花菜;;基因克隆;渍水胁迫
基因是植物特有的一类转录因子,由、和等3个基因家族成员的特征字母命名而来[1–2]。GRAS家族通常包含SAW、亮氨酸重复序列I (LFRI)、NLS、VHIID和亮氨酸重复序列II (LHRII)、PFYRE和LXX-LL等几个典型的结构域,可分为SHR、SCL、SCR、RGA、RGL (RGA- like)、GAI和PAT1等8个分支[3]。目前,GRAS转录因子已在拟南芥()、水稻(a)、白菜()、蓖麻()、玉米()和番茄()等植物中克隆出来[4–9]。
GRAS家族成员数量众多,在植物逆境胁迫应答中发挥着重要作用。Torres-Galea等的研究表明干旱、盐、低温等非生物胁迫可促进拟南芥的表达[1]。李雪燕等报道柽柳()的GRAS转录因子启动子含有多个逆境相关元件,推测其可参与植物的逆境胁迫响应[10]。过表达水稻中的基因和甘蓝型油菜中的基因,可提高植株对干旱胁迫的耐受性[11]。
青花菜(var.)为十字花科(Brassicaceae)芸薹属一二年生草本植物。水分是青花菜生长发育过程中重要的调控因子,水分过多会严重影响生长,甚至造成整株死亡。因此对青花菜渍水胁迫的响应机理进行研究,对于青花菜生产具有重要的现实意义。
本试验从青花菜中克隆得到1个基因,对其编码的BoSCL3蛋白进行生物信息学分析,并采用荧光定量PCR技术检测基因在渍水胁迫下的表达特性,为揭示青花菜基因响应渍水胁迫的分子机制提供理论依据。
1 材料和方法
1.1 材料
供试材料为青花菜(var.‘WN12-95’)。种子催芽后,播种到营养钵中, 放置于光照培养箱内进行培养。昼夜温度为25℃/ 18℃, 光照周期为16 h/8 h。待植株长至五叶期时开始渍水胁迫处理,每处理3次重复。分别在处理后0、2和6 d采集叶片,液氮冷冻后置于超低温冰箱保存。
1.2 总RNA提取及cDNA合成
参照TaKaRa Mini BEST Plant RNA Extraction Kit试剂盒(TaKaRa公司)的操作说明提取青花菜叶片的总RNA。总RNA质量检测合格后,使用Prime Script 1st Strand cDNA Synthesis Kit反转录试剂盒(大连TaKaRa公司)反转录合成cDNA第一条链。
1.3 基因的克隆
根据转录组unigene库中青花菜基因设计全长克隆引物,F:5ʹ-TCGCTTTGATATGGTGGTT- ATGT-3ʹ;R:5ʹ-TCATTCACTTCTTGCATCTCCA-3ʹ。PCR反应体系包括1L cDNA,上、下游引物各1L、10Lmixture,7L ddH20。扩增程序为:94℃预变性5 min;94℃变性30 s,60℃复性50 s,72℃延伸1 min,36个循环;72℃延伸10 min。PCR产物回收后进行TA克隆,选取阳性克隆测序。
1.4 生物信息学分析
采用InterPro软件(http://www.ebi.ac.uk/interpro/)进行结构域分析;采用在线软件ProtParamtool(http://web.expasy.org/protparam/)预测氨基酸多肽链的氨基酸组成、等电量、相对分子量、分子式等[12–14]; 使用DNAMAN软件预测多肽链的亲/疏水性; 采用GOR4工具(https://npsa-prabi.ibcp.fr/cginbin/ npsa_automat.pl?page=npsa_gor4.html)对编码蛋白的二级结构进行预测。蛋白序列同源性比对和进化树的构建采用Mega 6.0软件[15]。
1.5 BoSCL3基因的表达分析
根据获得青花菜基因的cDNA序列,设计定量引物,F: 5ʹ-CTTAACGCAACTCAGACAA-3ʹ和R: 5ʹ-CCATCTTCTCACCTTCCA-3ʹ。以基因(引物分别为5ʹ-GACAACTTACAACTCCATCAT-3ʹ和5ʹ-CTCATACGGTCAGCGATA-3ʹ)为内参基因。使用SYBR Premix Ex Taq (大连TaKaRa公司)试剂盒在ABI Prism 7500定量扩增仪上进行实时荧光定量分析。反应体系为:cDNA 1L,上、下游引物各1L, SYBR 10L,ddH2O 12L。反应程序为94℃预变性2 min;94℃变性20 s,60℃退火30 s,72℃延伸40 s,40个循环,最后72℃延伸10 min。每个反应设3次重复,采用2-ΔΔCT法计算基因的相对表达量。
2 结果和分析
2.1 BoSCL3基因的克隆及序列特征分析
采用特异引物,经PCR扩增后,从青花菜叶片中克隆了基因(图1)。序列分析表明该基因cDNA全长1 355 bp,推导编码446个氨基酸(图2)。InterPro分析表明,该基因具有保守的结构域,属于基因家族。
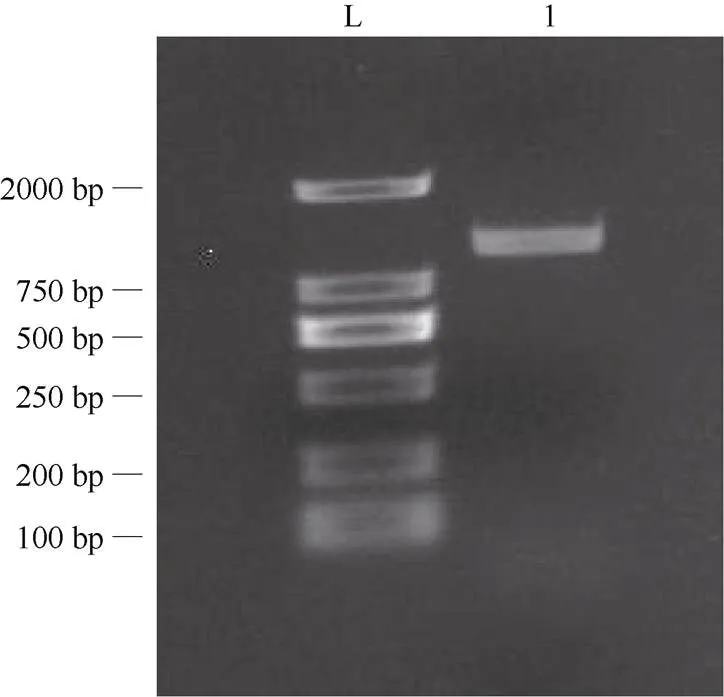
图1 青花菜BoSCL3基因的PCR扩增。L: DL 2000 Marker; 1: BoSCL3。
2.2 BoSCL3蛋白的生物信息学分析
青花菜BoSCL3蛋白的分子量为49.96 kDa,理论等电点为6.14;带负电残基总数为51,带正电残基总数为45;疏水性最大值为3.04,亲水性最大值为2.38,同时疏水性氨基酸多于亲水性氨基酸,说明该蛋白为疏水性蛋白。
通过GOR4工具对蛋白氨基酸序列的二级结构进行分析, 结果表明,青花菜BoSCL3蛋白的二级结构包括无规则卷曲(Cc)(44.62%)、延伸链(Ee) (12.33%)和-螺旋(Hh)(43.05%)。
2.3 系统进化树
利用BLAST对BoSCL3蛋白的氨基酸序列同源性进行分析,结果表明,基因编码的氨基酸序列与甘蓝()、油菜()、芜菁()、白菜、萝卜()、拟南芥中的SCL3氨基酸序列的同源性分别是100%、98%、98%、98%、91%和90%, 与烟草、长叶马先蒿、可可、毛果杨的相似性也都在60%以上。
将青花菜BoSCL3蛋白的氨基酸序列与甘蓝、油菜、芜菁、白菜、萝卜、拟南芥(subsp.)、榴莲()、长蒴黄麻()、黄花蒿()、除虫菊()、莴苣()、绒毛烟草()、蓖麻()、毛果杨()等14种植物的SCL3氨基酸序列进行多重比对并构建进化树(图3),可见,青花菜的BoSCL3与甘蓝、油菜的SCL3亲缘关系较近。同属于十字花科的甘蓝、油菜、芜菁、萝卜、白菜和拟南芥聚在同一分支上,表明同科植物的SCL3蛋白具有较高的同源性。

图2 BoSCL3基因的全长序列和推测的氨基酸序列。下划线为引物序列。

图3 基于SCL3蛋白氨基酸序列构建的系统进化树
2.4 渍水胁迫下BoSCL3基因的表达
利用实时荧光定量PCR技术检测青花菜渍水处理不同时间的表达特征。结果表明(图4),青花菜基因在渍水胁迫处理2 d时的表达受到抑制,相对表达量仅为0.11。其后随着渍水胁迫时间的延长,表达量呈现上升的趋势,处理6 d的相对表达量为1.18。

图4 渍水胁迫下BoSCL3基因的表达
3 结论和讨论
本研究从青花菜中成功克隆到基因,对其编码蛋白的亲/疏水性、结构域、二级结构和同源性进行了预测分析并构建了系统进化树。对渍水胁迫下青花菜基因的表达进行了分析,为进一步揭示青花菜基因响应渍水胁迫的应答机制提供了一定的理论依据。
转录因子对于增强植物对逆境的抵抗力和适应能力具有重要作用[16–17]。本试验克隆得到1个青花菜基因,其编码的蛋白具有GRAS家族的保守结构域,为疏水性蛋白。石瑞等[18]报道的佛手(var.)的GRAS和陈裕坤等[19]报道的龙眼()胚性愈伤组织DlGRAS4与DlGRAS54的结构、性质相似。将BoSCL3蛋白的氨基酸序列与荠蓝、油菜、萝卜、白菜、拟南芥等植物中GRAS家族的SCL3的氨基酸序列进行比对,表明约有80%以上的同源性,推测SCL3在功能上存在一定的保守性。
逆境胁迫是限制作物生长的重要因子,严重时可导致植株形态发生变化。基因可在植物受到逆境胁迫时,产生应答机制来提高植物的抗逆性,直接表现为表达量的变化。本研究中,渍水胁迫处理可对基因的表达量产生影响,说明基因可能参与了青花菜的渍水胁迫响应。前人的研究表明,水稻的表达量在受到盐、干旱和外源ABA的胁迫时表达上调[20]。郭华军等的研究也表明拟南芥13个基因在干旱和渗透胁迫处理下的表达均比对照显著上升[21]。本试验中青花菜基因的表达量随着渍水胁迫时间的延长,呈先急剧下降后快速上升的变化趋势,表明基因可能在青花菜渍水胁迫调控过程中具有重要作用。
[1] Torres-Galea P, Hirtreiter B, Bolle C. Two GRAS proteins,SCARE-CROW-LIKE21 and PHYTOCHROME A SIGNAL TRANS- DUCTION1, function cooperatively in phytochrome a signal trans- duction [J]. Plant Physiol, 2013, 161(1): 291–304. doi: 10.1104/pp.112. 206607.
[2] ZHOU L J, YANG Z M, ZHANG F C, et al. Expression analysis and cloning of GRAS transcription factor gene from[J]. Acta Bot Boreali-Occid Sin, 2013, 33(6): 1091–1097. doi: 10.3969/ j.issn.1000-4025.2013.06.004.周莲洁, 杨中敏, 张富春, 等. 新疆盐穗木GRAS转录因子基因克隆及表达分析 [J]. 西北植物学报, 2013, 33(6): 1091–1097. doi: 10. 3969/j.issn.1000-4025.2013.06.004.
[3] PYSH L D, WYSOCKA-DILLER J W, CAMILLERI C, et al. Thegene family in: Sequence characterization and basic expression analysis of thegenes [J]. Plant J, 1999, 18(1): 111–119. doi: 10.1046/j.1365-313X.1999.00431.x.
[4] HOU M Y. Cloning, transformation and functional analysis of GRAS transcription factor family genes in rice [D]. Jilin: Jilin University, 2013: 9. 侯梦筠. 水稻GRAS转录因子家族基因克隆、遗传转化与功能分析 [D]. 吉林: 吉林大学, 2013: 9.
[5] TIAN C G, WAN P, SUN S H, et al. Genome-wide analysis of thegene family in rice and[J]. Plant Mol Biol, 2004, 54(4): 519–532. doi: 10.1023/b:plan.0000038256.89809.57.
[6] SONG X M, LIU T K, DUAN W K, et al. Genome-wide analysis of thegene family in Chinese cabbage (ssp) [J]. Genomics, 2014, 103(1): 135–146. doi: 10.1016/j.ygeno.2013.12. 004.
[7] HAN W Y, LI G R, FENG L, et al. Genome-wide analysis of GRAS transcription factors inand response to abiotic stresses [J]. J Plant Genet Resour, 2020, 21(1): 252–259. doi: 10.1016/ j.ygeno.2013.12.004.韩雯毓, 李国瑞, 风兰, 等. 蓖麻GRAS转录因子家族的全基因组分析及逆境胁迫响应 [J]. 植物遗传资源学报, 2020, 21(1): 252–259. doi: 10.13430/j.cnki.jpgr.20190521002.
[8] YIN L F, WANG Z Y, WU Z Y, et al. Cloning and functional analysis ofgene in maize [J]. Acta Agron Sin, 2019, 45(7): 1029– 1037. doi: 10.3724/SP.J.1006.2019.83070.殷龙飞, 王朝阳, 吴忠义, 等. 玉米基因的克隆及功能研究 [J]. 作物学报, 2019, 45(7): 1029–1037. doi: 10.3724/SP.J.1006. 2019.83070.
[9] REN L J. Cloning and functional analysis of tomato GRAS family gene[D]. Chongqing: Chongqing University, 2014: 12. 任丽军. 番茄GRAS转录因子家族基因的克隆及其功能研究 [D]. 重庆: 重庆大学, 2014: 12.
[10] LI X Y, JIN J J, ZHAO Y L, et al. Cloning and expression analysis of promoter of GRAStranscription factor from[J]. Chin Agric Sci Bull, 2016, 32(2): 28–32. 李雪燕, 金胶胶, 赵玉琳, 等. 柽柳GRAS转录因子基因启动子克隆和表达分析 [J]. 中国农学通报, 2016, 32(2): 28–32.
[11] XU K, CHEN S J, LI T F, et al., a rice GRAS transcription factor gene, is involved in drought stress response through regulating expression of stress-responsive genes [J]. BMC Plant Biol, 2015, 15(1): 141. doi: 10.1186/s12870-015-0532-3.
[12] PEI X L, JING Z G, TANG Z, et al. Cloning and expression analysis of a pollen development genein broccoli [J]. Biotechnol Bull, 2015, 31(3): 102–107. doi: 10.13560/j.cnki.biotech.bull.1985.2015.04.014.裴徐梨, 荆赞革, 唐征, 等. 青花菜花粉发育基因的克隆及表达特征分析 [J]. 生物技术通报, 2015, 31(3): 102–107. doi: 10.13560/ j.cnki.biotech.bull.1985.2015.04.014.
[13] LI X N, XIAO H Z, WAN S L, et al. Cloning and expression analysis ofgene inMuell. Arg. [J]. Chin J Trop Crops, 2017, 38(11): 2100–2105. doi: 10.3969/j.issn.1000-2561.2017.11.017. 李晓娜, 肖厚贞, 万三连, 等. 巴西橡胶树基因克隆与表达分析 [J]. 热带作物学报, 2017, 38(11): 2100–2105. doi: 10. 3969/j.issn.1000-2561.2017.11.017.
[14] CAO X S, WANG J, ZHANG Y Y, et al. Cloning and bioinformatic analysis ofgene from[J]. Chin J Trop Crops, 2017, 38(12): 2302–2309. doi: 10.3969/j.issn.1000-2561.2017. 12.017.曹先爽, 王进, 张瑶瑶, 等. 香樟基因的克隆与生物信息学分析 [J]. 热带作物学报, 2017, 38(12): 2302–2309. doi: 10.3969/j.issn. 1000-2561.2017.12.017.
[15] GUO Y Y. Gene cloning and functional analysis of the GRAS trans- cription factor family from Maize (L.) [D]. Taian: Shandong Agricultural University, 2015: 21. 郭玉玉. 玉米GRAS转录因子家族基因克隆与功能验证 [D]. 泰安: 山东农业大学, 2015: 21.
[16] LI A Y, LIU H, LI X Y, et al. Cloning and subcellular localization analysis of twogenes from[J]. Genom Appl Biol, 2012, 31(3): 240–248. doi: 10.3969/gab.031.000240.李阿英, 刘洪, 李晓颖, 等. 枳两个基因cDNA全长的克隆及其亚细胞定位分析 [J]. 基因组学与应用生物学, 2012, 31(3): 240–248. doi: 10.3969/gab.031.000240.
[17] NIU Y L. Bioinformatic analysis and identification of some resistance- associated genes ofgene family in tomato [D]. Harbin: North- east Agricultural University, 2017: 1. 牛义岭. 番茄基因家族生物信息学分析及部分抗性相关基因鉴定分析 [D]. 哈尔滨: 东北农业大学, 2017: 1.
[18] SHI R, CAO Y B, CHEN W R, et al. On cDNA cloning and expression analysis ofgene in fingered citron [J]. J Zhejiang Norm Univ (Nat Sci), 2011, 34(4): 446–451. doi: 10.3969/j.issn.1001-5051.2011. 04.016.石瑞, 曹诣斌, 陈文荣, 等. 佛手基因的克隆及表达分析 [J]. 浙江师范大学学报(自然科学版), 2011, 34(4): 446–451. doi: 10. 3969/j.issn.1001-5051.2011.04.016.
[19] CHEN Y K, LIN Y L, TIAN Q L, et al. Cloning and expression analysis ofandfrom embryogenic callus ofLour. [J]. Acta Bot Boreali-Occid Sin, 2014, 34(2): 215–224. doi: 10.7606/j.issn.1000-4025.2014.02.0215.陈裕坤, 林玉玲, 田奇琳, 等. 龙眼胚性愈伤组织与基因的克隆及表达分析 [J]. 西北植物学报, 2014, 34(2): 215–224. doi: 10.7606/j.issn.1000-4025.2014.02.0215.
[20] DING X E, LIU H Y, LUO L J. Cloning and diversity analysis of the1promoter in rice [J]. Acta Agric Shanghai, 2010, 26(4): 8–14. doi: 10.3969/j.issn.1000-3924.2010.04.003.丁雪峰, 刘鸿艳, 罗利军. 水稻启动子的克隆及多样性分析 [J]. 上海农业学报, 2010, 26(4): 8–14. doi: 10.3969/j.issn.1000- 3924.2010.04.003.
[21] GUO H J, JIAO Y N, DI C, et al. Discovery ofGRAS family genes in response to osmotic and drought stresses [J]. Chin Bull Bot, 2009, 44(3): 290–299. doi: 10.3969/j.issn.1674-3466.2009. 03.005.郭华军, 焦远年, 邸超, 等. 拟南芥转录因子GRAS家族基因群响应渗透和干旱胁迫的初步探索 [J]. 植物学报, 2009, 44(3): 290–299. doi: 10.3969/j.issn.1674-3466.2009.03.005.
CloningGene fromvar.and Expression Analysis under Waterlogging Stress
PEI Xu-li1, FU Shuang1, JING Zan-ge1,2*, TANG Zheng2, LIN Yan1, HUANG Li1
(1. College of Agriculture and Bioscience, Kunming University,Kunming 650214, China; 2. College of Agriculture and Biotechnology, Wenzhou Vocational College of Science and Technology,Wenzhou 325006, Zhejiang, China)
In order to understand the function of(scarecrow-like 3) gene, agene was cloned fromvar., named, which full length of cDNA sequence was 1355 bp and encoding 446 amino acids. The molecular weight of BoSCL3 was 49.96 KD, predicted to be hydrophobic protein. Phylogenetic analysis showed that the SCL3 invar.(BoSCL3) was closely related to those inand, and SCL3 in the same family had high homology. The real-time fluorescence quantitative PCR analysis showed that the expression ofdecreased at first and then increased with waterlogging stress time, indicating that this gene might be involved in response to waterlogging stress. Therefore, these would provide a theoretical basis for studying the molecular mechanism of BoSCL3 gene in response to waterlogging stress.
var.;; Gene clone; Waterlogging stress
10.11926/jtsb.4263
2020–06–10
2020–08–31
浙江省自然科学基金项目(LY18C150006); 云南省地方本科高校(部分)基础研究联合专项(2018FH001-044); 云南省科技厅基础研究专项青年项目(2019-1-C-25318000002236); 浙江省科技厅项目(2016C051-5-3); 温州市科技项目(2019ZX007-2)资助
This work was supported by the Project for Nature Sciences in Zhejiang (Grant No. LY18C150006); the Project for Fundamental Research of Local Undergraduate Universities (Partial) in Yunnan Province (Grant No. 2018FH001-044); the Special Project for Basic Research of Youth in Yunnan Science and Technology Department (Grant No. 2019-1-C-25318000002236); the Project of Department of Science and Technology in Zhejiang (Grant No. 2016C051-5-3); and the Project for Science and Technology in Wenzhou (Grant No. 2019ZX007-2).
裴徐梨(1990~ ),女,博士,讲师,主要从事蔬菜分子生物学研究。E-mail: xuliP@163.com
. E-mail: jingzange@aliyun.com
