冬季南亚热带森林演替中后期优势树种幼叶光保护策略
2021-04-06林威俞正超罗燕娜施楚亮赖宇波彭长连
林威, 俞正超, 罗燕娜, 施楚亮, 赖宇波, 彭长连
冬季南亚热带森林演替中后期优势树种幼叶光保护策略
林威, 俞正超, 罗燕娜, 施楚亮, 赖宇波, 彭长连*
(广东省植物发育生物工程重点实验室,华南师范大学生命科学学院, 广州 510631)
为了解演替中期和后期优势树种对冬季不同光强的适应性,对在全光照(100%自然光强)和低光照(30%自然光强)下生长的演替中期优势种木荷()、锥栗()和黧蒴()及演替后期优势种华润楠()、黄果厚壳桂()和厚壳桂()的生理生化响应进行了研究。结果表明,与全光照相比,低光照下演替中期优势树种幼叶的非光化学猝灭(NPQ)、类胡萝卜素与叶绿素的比值(Car/Chl)和花色素苷含量下降,细胞质膜渗透率增加;而演替后期优势树种幼叶的花色素苷含量增加、细胞质膜渗透率降低,且受光抑制的程度低(Fv/Fm高)。此外,除总抗氧化能力外,演替中期优势树种幼叶的花色素苷含量、NPQ和Car/Chl均显著低于演替后期优势种。因此,演替后期优势树种可以通过灵活多样的光保护策略来提高对冬季强光环境的适应能力,而演替中期优势种在光保护策略的多样性及光保护能力上均弱于演替后期优势种。
群落演替;花色素苷;非光化学猝灭;光保护;冬季
光对植物具有重要意义,是植物进行光合作用的能源基础,不仅影响植物的生长,同时对植物的分布具有重要影响。在森林演替过程中光也是促进群落内物种更替的主要环境因素之一[1]。在森林更替和群落演替过程中,不同物种及同种物种在不同的生长阶段对不同光照环境的响应与适应特性的差异是推动群落演替的重要内在驱动力[2–3]。在南亚热带森林,随着群落演替的进行,群落内部郁闭度逐渐增加,从林冠层往下光照强度逐渐下降,同时光质的组成也发生着变化,造成了群落内部复杂的光照环境。因此光因子成了制约植物生长的关键环境因子。光照过高或过低都会影响植物的生长。高光环境会导致植物体内活性氧的积累[4–5],这是由于高光环境下植物叶片捕获的光能超过光合作用所需光能,过剩光能可以诱导活性氧的产生,积累的活性氧会在植物体中引发氧化损伤,最终会导致生物大分子的破坏及植物细胞的死亡[6]。低光环境对有些植物也会造成胁迫,特别是阳生植物,原因在于低光环境下植物叶片中Rubisco含量下降,光合中间产物合成减少, 从而限制了叶片对CO2的吸收和传递电子能力, 在一定程度上限制了植物NADP+再生能力, 使较多电子流向O2, 提高了活性氧自由基的产生速率[7–8]。
过剩光能的产生和活性氧的积累对植物的生长必然是严重的阻碍,因此在胁迫环境下如何耗散过剩光能及清除活性氧对植物来说尤为重要。植物在长期的进化过程中已形成多种策略来抵御环境胁迫。花色素苷是一种水溶性的非光合色素,分布于植物表皮细胞、叶肉细胞的液泡或植物的表皮毛中[9–11]。大多数学者认为花色素苷具有屏蔽光能的作用[12–13]。也有学者认为花色素苷在清除活性氧方面起着重要作用[14–15]。花色素苷的积累是植物抵御环境胁迫的手段之一。在没有花色素苷积累的植物中,其他抗氧化物质在抵御环境胁迫中发挥着重要作用。在夏季南亚热带森林中演替后期树种在不积累花色素苷的情况下依靠类黄酮、总酚和类胡萝卜素的协调作用提高了幼叶对高温高光的光保护潜力[16]。暴露于高UV-B辐射的烟草()通过提高总抗氧化能力来防止自身受到光氧化破坏[17]。抗氧化能力通常是由一些低分子的抗氧化物质贡献的,包括类黄酮、花色素苷、类胡萝卜素、抗坏血酸、谷胱甘肽等[18–20],在植物体内构成非酶促抗氧化系统,起到清除活性氧的作用。此外,体内吸收的多余光能的耗散也是植物进行自我保护的一种重要机制[21–22]。许多研究表明,胁迫下植物通过上调NPQ进行过量光能的耗散,从而避免活性氧的形成[23–24]。
目前对鼎湖山森林群落演替的研究多数集中于研究不同演替阶段优势种对夏季光照环境的响应机制上,很少报道对冬季光照环境的响应机制。本研究通过比较物种幼叶的花色素苷、总抗氧化能力和热耗散能力,探讨不同演替阶段优势种对冬季光照环境的光保护机制的差异,以阐明其对冬季光照环境的适应能力。
1 材料和方法
1.1 材料
本试验以广东鼎湖山南亚热带森林3种演替中期优势树种木荷()、锥栗()、黧蒴()和3种演替后期优势树种华润楠()、黄果厚壳桂()、厚壳桂()为材料。从鼎湖山自然保护区采挖幼苗(株高1 cm左右),每树种20棵,在华南师范大学生命科学学院试验场以盆栽的方式种植,种植的土壤为3∶1混合的粘土和泥炭土,容器直径为50 cm,高35 cm,每盆种植1棵幼苗。夏季每天浇水1次, 冬季每3 d浇水1次, 每3个月使用复合肥施肥1次,定期进行除草。待幼苗成活后进行光处理,设置全光照(100%自然光强, full light, FL),模拟冠层光照;低光照(30%自然光强, low light, LL),模拟林下光环境[25]。树苗经遮光处理3~4 a后进行试验。
1.2 细胞质膜渗透率的测定
采集6种优势树种的新鲜幼叶和成熟叶,用水清洗叶片表面。避开主叶脉用8 mm打孔器获取5片叶圆片,放入装有10 mL去离子水的15 mL试管中。室温静置2 h,然后用电导仪(PP-15-P11, Sarto- rius, Germany)测溶液的电导值(1)。将试管置于沸水中30 min,冷却后测电导值(2),以相对电导率表示叶片细胞质膜的渗透率(1/2)。
1.3 叶绿素荧光参数测定
使用多功能植物测量仪MultispeQ (PhotosynQ, USA)测定优势树种叶片的最大光化学效率(Fv/Fm)和非光化学猝灭(NPQ)。在晴朗天气下,通过手机蓝牙将手机与多功能植物测量仪配对,打开手机PhotosynQ软件与仪器连接,通过仪器上部的感光装置接收自然光进行测定。每树种选取3~5株,分别测量5片幼叶和成熟叶,在不损伤植物叶片和保持环境状态不变的情况下用多功能植物测量仪夹住叶片进行测定,将数据上传至PhotosynQ官网,从PhotosynQ官网下载数据。
1.4 花色素苷含量测定
将采集的新鲜幼叶和成熟叶用水清洗干净,用8 mm打孔器取5片叶圆片(避开主叶脉)放入15 mL试管中,加入4 mL 1%盐酸-甲醇()在黑暗下4℃浸提24 h,向浸提液中加入2 mL蒸馏水和4 mL氯仿,待溶液充分混匀分层后取上清液用UV2450型分光光度计(Shimadzu, Tokyo, Japan)在400和700 nm处进行光谱吸收扫描。使用矢车菊素-3--葡萄糖苷来制作标准曲线,以吸收光谱中达到峰值时的吸光值计算叶片中花色素苷的含量。
1.5 总抗氧化能力测定
清洗新鲜的幼叶和成熟叶,避开主叶脉,用8 mm打孔器取2片叶圆片放入试管中,向试管中加入3 mL 95%甲醇,黑暗下4℃浸提24 h。样品的总抗氧化能力(total antioxidant capacity, TAC)根据提取液对DPPH的清除能力进行评估[26]。在避光条件下吸取20L提取液和3 mL 0.1 mol/L DPPH (用95%甲醇配制)加入4 mL离心管中,混匀静置5 min后测定517 nm波长处的吸光值,以95%甲醇溶液为空白对照。以梯度稀释的DPPH溶液(10~100mol/L)建立标准曲线,以单位叶面积清除DPPH的mol数来表示叶片的总抗氧化能力。
1.6 类胡萝卜素含量测定
新鲜叶片清洗干净后用8 mm打孔器取2片叶圆片,放入10 mL离心管中,加入少量的液氮并用金属棒将叶圆片捣碎成粉末状,加入4 mL 80%丙酮在4℃冰箱中浸提过夜。将提取液充分摇匀,静置后吸取上清液,在波长663、645和470 nm处测定吸光值,以80%的丙酮作为空白对照。参考Wellburn的公式[27]计算叶绿素a (Chl a)、叶绿素b (Chl b)、总叶绿素(Chl a+b)及类胡萝卜素(Car)的含量。
1.7 数据分析
以平均值±标准误表示数据。采用SPSS 25.0软件进行数据统计分析和多重比较。Duncan多重比较法检验不同演替阶段植物叶片在不同光强下生理指标的差异显著性,显著性水平为0.05。使用Sigma- plot 12.5软件进行作图。
2 结果和分析
2.1 细胞质膜渗透率的变化
植物在遭受非生物胁迫时通常会积累活性氧,从而出现膜脂过氧化现象。结果表明,在全光照(FL)下,演替后期的华润楠、黄果厚壳桂和厚壳桂幼叶的细胞质膜渗透率高于演替中期的木荷、锥栗和黧蒴幼叶(表1),其中黄果厚壳桂幼叶的膜渗透率最高,为0.271,是演替中期优势种木荷、锥栗和黧蒴幼叶的2倍。与FL相比,低光照(LL)下演替后期优势种幼叶的细胞质膜渗透率降低,其中黄果厚壳桂幼叶的降幅最大,为23%。而演替中期优势种幼叶细胞质膜渗透率则上升,其中黧蒴幼叶升幅达到68%。

表1 光照强度对优势种叶片细胞质膜渗透率的影响
2.2 叶绿素荧光参数的变化
Fv/Fm的变化反映了植物受到光抑制的程度。从图1可见,在不同光照条件间,演替中期和后期优势种成熟叶的Fv/Fm差异不显著。与演替中期优势种相比,FL下演替后期优势种幼叶的Fv/Fm明显更低,演替中期优势种幼叶的Fv/Fm大于0.6,而演替后期优势种幼叶的Fv/Fm小于0.6;LL下演替后期优势种幼叶的Fv/Fm显著高于FL,Fv/Fm值与演替中期优势种相近,而演替中期优势种幼叶在LL和FL间的Fv/Fm没有显著差异。无论是LL还是FL,演替后期优势种幼叶的NPQ都明显高于演替中期, 尤其是黄果厚壳桂和厚壳桂幼叶,分别为0.64和0.63,是演替中期优势种锥栗的3倍。与FL相比, LL下2个演替阶段优势种幼叶的NPQ都出现显著下降(图2),其中演替后期优势种降幅最大,黄果厚壳桂和厚壳桂幼叶的NPQ都比FL下降一半。
2.3 花色素苷含量变化
从图3可见,2个演替阶段优势种的成熟叶都不积累花色素苷。演替中期优势种除黧蒴幼叶积累少量花色素苷外,木荷和锥栗的幼叶在FL和LL下都不积累花色素苷。然而,在演替后期优势种的幼叶在FL和LL下都会积累花色素苷,其中FL下华润楠幼叶花色素苷的积累最高,分别为FL下木荷和锥栗幼叶的40和10倍。并且LL下演替后期优势种幼叶花色素苷的积累明显大于FL,其中黄果厚壳桂幼叶花色素苷的积累达到了0.841mol/cm2,为FL下的2倍。
2.4 总抗氧化能力的变化
从表2可见,幼叶的总抗氧化能力显著大于成熟叶。在FL下,2个演替阶段优势种幼叶的总抗氧化能力要显著高于LL下。与演替后期优势种相比,演替中期优势种叶片的总抗氧化能力更强。FL下3个演替中期优势种幼叶的总抗氧化能力均超过500mol/cm2,而演替后期优势种幼叶的总抗氧化能力均低于500mol/cm2。LL下演替中期优势种幼叶的总抗氧化能力尽管明显低于FL下,但依旧维持在与演替后期树种相等水平。

图1 光照强度对优势种叶片最大光化学效率(Fv/Fm)的影响。柱上不同字母表示差异显著(P<0.05)。FL: 100%自然光强; LL: 30%自然光强。下图同。

图2 光照强度对优势种叶片非光化学淬灭(NPQ)的影响
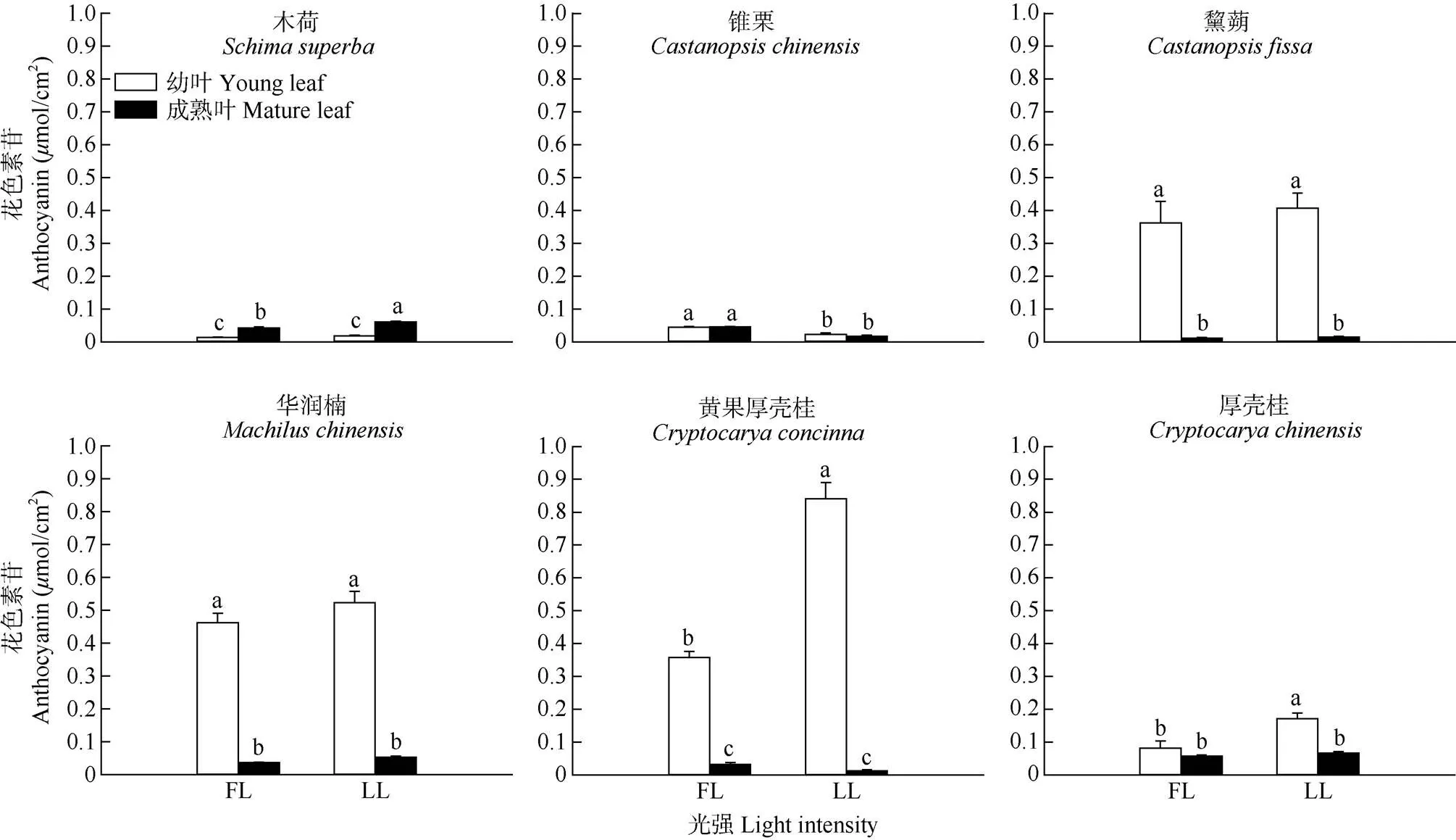
图3 光照强度对优势种叶片花色素苷含量的影响
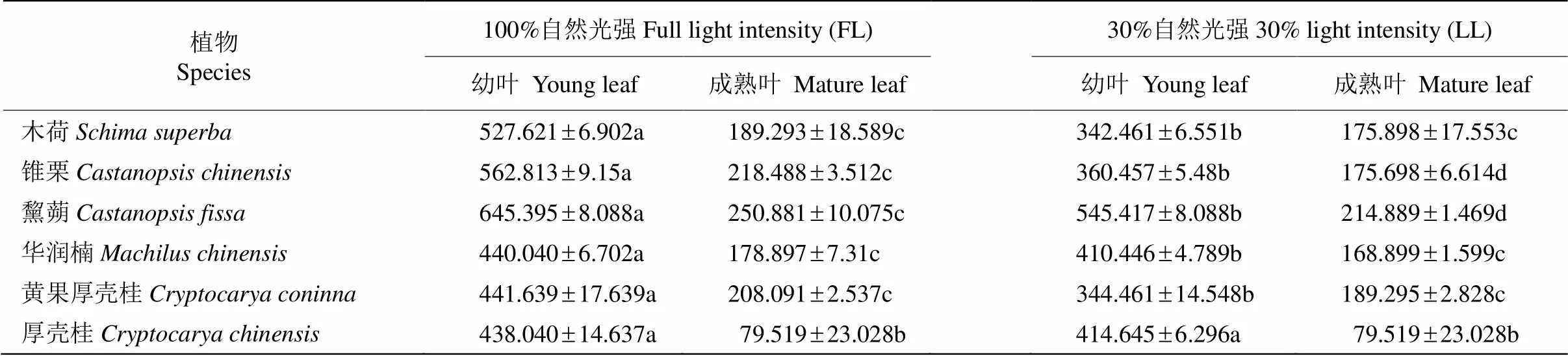
表2 光照强度对优势种叶片总抗氧化能力(TAC)的影响
2.5 Car/Chl的变化
Car/Chl是反映植物对光氧化防护能力的一个重要指标。从图4可见,在FL下,演替后期优势种幼叶的Car/Chl明显高于演替中期优势种,其中以黄果厚壳桂和厚壳桂最高,Car/Chl值超过0.5,为演替中期优势种的2~5倍。在LL下, 演替中期优势种木荷幼叶的Car/Chl显著增加,锥栗和黧蒴幼叶的Car/Chl与FL无显著差异。而在LL下,演替后期优势种华润楠幼叶的Car/Chl略微下降,但与FL间无显著差异,而黄果厚壳桂和厚壳桂幼叶的Car/Chl显著下降,但仍高于演替中期优势种。

图4 光照强度对优势种叶片Car/Chl的影响
3 结论和讨论
在南亚热带森林群落演替过程中,随着不同生长特性的植物入侵,森林群落内部逐渐形成复杂多样的光照环境,而不同演替阶段优势种对光照的要求是不同的。这就要求不同演替阶段优势种采用不同的光保护策略来适应复杂的光环境。冬季不同光照环境下演替后期优势种在花色素苷含量、总抗氧化能力、NPQ和Car/Chl的变化上比演替中期更加灵活多样,因而展现出了对冬季不同光照环境较强的适应能力,而演替中期优势种只在高光环境下具有较强的光保护能力。
在南亚热带森林中植物的生长受制于环境因子的多变性,尤其是复杂多变的光照环境对植物的影响最为明显。由于不同植物的生长在森林中形成了不同层次的森林群落,因此造就了不同层次群落之间复杂多变的光照条件[28]。在林冠层往往是高光照,而在林冠层以下,太阳辐射量逐层递减。然而,光强过高或过低都会影响植物的生长,因此植物对多变的光照环境的适应尤为重要。活性氧的积累是植物遭受胁迫伤害的结果。研究表明,当植物处于高光环境时,其捕获的光能中仅有部分用于光合作用,因此必然会产生过剩光能,这就导致了叶片中活性氧的增加[29–30]。另有学者认为遮阴环境也会导致植物体内活性氧的增加[31]。如果活性氧得不到及时清除就会破坏植物细胞膜,使膜脂出现过氧化现象。细胞膜渗透率的变化是衡量细胞膜损伤程度的一个重要指示,也是衡量胁迫环境下植物细胞膜结构完整性的重要指标[32]。从膜渗透率来看,与全光照相比,30%光照下的演替中期优势种幼叶膜渗透率更高,因此演替中期优势种在30%光照下受到更大的膜损伤,而演替后期优势种的生长在全光照下受到限制,因为全光照下演替后期优势种幼叶膜渗透率高于30%光照。植物对环境胁迫的响应也可体现在植物叶绿素荧光的变化上。Fv/Fm下降一般可用于衡量植物遭受光抑制的程度,Fv/Fm越低说明植物遭受的光抑制强度越强[33–34]。从Fv/Fm来看,演替后期优势种在全光照下受到的光抑制大于演替中期,但是在30%光照下演替后期优势种面临的环境胁迫压力明显变小,因为全光照下演替后期优势种幼叶的Fv/Fm要低于演替中期,并且30%光照下演替后期优势种幼叶的Fv/Fm显著更高。
植物在遭受到胁迫伤害时往往采用多种防御手段抵御环境胁迫。花色素苷的积累被认为是植物抵御环境胁迫的一种有效手段。在多数研究中,花色素苷都被发现具有清除活性氧及滤光的功能[35–36], 包括在高温、高光、低温、干旱和营养缺乏等胁迫环境中。本研究结果表明,花色素苷的积累模式与Fv/Fm的变化趋势一致。2种光强下演替后期优势种幼叶都积累了花色素苷,但是30%光照下花色素苷含量明显更高,这与30%光照下演替后期优势种幼叶Fv/Fm高于全光照的一致。而2种光强下演替中期优势种幼叶除黧蒴几乎不积累花色素苷外, 2种光强下花色素苷的变化也与其幼叶的Fv/Fm变化一致。这说明高含量的花色素苷为演替后期优势种提供较强防御光抑制的能力,尤其是在30%光照下。植物通过积累花色素苷来抵御环境胁迫只是其防御策略的一种,植物在面对环境胁迫时还可以通过积累其他的抗氧化物质来达到抗氧化作用,例如类黄酮、总酚等[37–38], 这体现在总抗氧化能力上。本研究结果表明,与演替后期优势种相比,总抗氧化能力在全光照下演替中期优势种幼叶中表现出更强的光保护潜力,表明在全光照下,演替中期优势种比演替后期优势种积累更多其他的抗氧化物质,这些抗氧化物质的积累可以弥补花色素苷积累缺少的缺陷而起到抵御环境胁迫的作用。然而与全光照相比,30%光照下演替后期优势种幼叶的总抗氧化能力仅略微下降,而演替中期的总抗氧化能力则明显下降,这与30%光照下演替中期优势种幼叶膜渗透率显著上升的趋势正好相反,表明30%光照下演替中期优势种抗氧化能力的下降导致环境胁迫对植物叶片的伤害增加。类胡萝卜素是植物进行光抑制防御的一种重要物质[39],Car/Chl在一定程度上反映了植物的光保护潜力[40]。无论是全光照还是30%光照,演替后期优势种幼叶的Car/Chl都大于演替中期的,这与Zhang等[41]报道演替后期优势种的叶黄素含量大于演替中期的结果是一致的,表明提高热耗散潜能是演替后期优势种幼叶应对不同光照环境的适应策略,尤其是在全光照下。NPQ是植物用于光保护的一种保护机制,通常用于耗散多余的吸收光能,防止活性氧的形成[42–43]。我们的研究表明,无论是全光照还是30%光照,演替后期优势种幼叶的NPQ都高于演替中期,表明利用NPQ来提高热耗散也是演替后期优势种对不同光照环境的一种适应策略。并且在全光照下,演替后期优势种除华润楠外,黄果厚壳桂和厚壳桂幼叶的NPQ比30%光照下高1倍,这可能是通过提高NPQ来弥补花色素苷积累的不足。
[1] ZHANG Q, CHEN Y J, Song L Y, et al. Utilization of lightflecks by seedlings of five dominant tree species of different subtropical forest successional stages under low-light growth conditions [J]. Tree Physiol, 2012, 32(5): 545–553. doi: 10.1093/treephys/tps043.
[2] HAMERLYNCK E P, KNAPP A K. Leaf-level responses to light and temperature in two co-occurring(Fagaceae) species: Impli- cations for tree distribution patterns [J]. For Ecol Manag, 1994, 68(2/3): 149–159. doi: 10.1016/0378-1127(94)90042-6.
[3] GRAVEL D, CANHAM C D, BEAUDET M, et al. Shade tolerance, canopy gaps and mechanisms of coexistence of forest trees [J]. Oikos, 2010, 119(3): 475–484. doi: 10.1111/j.1600-0706.2009.17441.x.
[4] ROBERT G, MELCHIORRE M, RACCA R, et al. Apoplastic super- oxide level in wheat protoplast under photooxidative stress is regulated by chloroplast redox signals: Effects on the antioxidant system [J]. Plant Sci, 2009, 177(3): 168–174. doi: 10.1016/j.plantsci.2009.05.001.
[5] GU J F, ZHOU Z X, LI Z K, et al. Photosynthetic properties and potentials for improvement of photosynthesis in pale green leaf rice under high light conditions [J]. Front Plant Sci, 2017, 8: 1082. doi: 10. 3389/fpls.2017.01082.
[6] DU Y X, HE C L, ZHANG L H, et al. Physiochemical response of several evergreen trees to low temperature stress in winter in Lushan [J]. Ecol Environ Sci, 2014, 23(6): 945–949. doi: 10.3969/j.issn.1674- 5906.2014.06.006.杜有新, 何春林, 张乐华, 等. 庐山若干常绿树种对冬季低温的生理生化响应 [J]. 生态环境学报, 2014, 23(6): 945–949. doi: 10.3969/ j.issn.1674-5906.2014.06.006.
[7] VRANOVÁ E, INZÉ D, VAN BREUSEGEM F. Signal transduction during oxidative stress [J]. J Exp Bot, 2002, 53(372): 1227–1236. doi: 10.1093/jxb/53.372.1227.
[8] ZHAN J C, HUANG W D, WANG L J. Research of weak light stress physiology in plants [J]. Chin Bull Bot, 2003, 20(1): 43–50. doi: 10. 3969/j.issn.1674-3466.2003.01.005.战吉宬, 黄卫东, 王利军. 植物弱光逆境生理研究综述 [J]. 植物学通报, 2003, 20(1): 43–50. doi: 10.3969/j.issn.1674-3466.2003.01.005.
[9] HOOIJMAIJERS C A M, GOULD K S. Photoprotective pigments in red and green gametophytes of two New Zealand liverworts [J]. New Zeal J Bot, 2007, 45(3): 451–461. doi: 10.1080/00288250709509728.
[10] HUGHES N M, SMITH W K. Attenuation of incident light in(Diapensiaceae): Concerted influence of adaxial and abaxial anthocyanic layers on photoprotection [J]. Amer J Bot, 2007, 94(5): 784–790. doi: 10.3732/ajb.94.5.784.
[11] ZHANG T J, CHOW W S, LIU X T, et al. A magic red coat on the surface of young leaves: Anthocyanins distributed in trichome layer protectleaves from photoinhibition [J]. Tree Physiol, 2016, 36(10): 1296–1306. doi: 10.1093/treephys/tpw080.
[12] HOCH W A, SINGSAAS E L, MCCOWN B H. Resorption protection: Anthocyanins facilitate nutrient recovery in autumn by shielding leaves from potentially damaging light levels [J]. Plant Physiol, 2003, 133(3): 1296–1305. doi: 10.1104/pp.103.027631.
[13] HATIER J H B, CLEARWATER M J, GOULD K S. The functional significance of black-pigmented leaves: Photosynthesis, photoprotection and productivity in‘Nigrescens’ [J]. PLoS ONE, 2013, 8(6): e67850. doi: 10.1371/journal.pone.0067850.
[14] LEE D W, GOULD K S. Why leaves turn red: Pigments called antho- cyanins probably protect leaves from light damage by direct shielding and by scavenging free radicals [J]. Amer Sci, 2002, 90(6): 524–531. doi: 10.1511/2002.39.794.
[15] NEILL S O, GOULD K S. Anthocyanins in leaves: Light attenuators or antioxidants? [J]. Funct Plant Biol, 2003, 30(8): 865–873. doi: 10. 1071/FP03118.
[16] YU Z C, LIU X T, HUANG X D, et al. Photoprotection of antho- cyanins in young leaves of dominant tree species at mid- and late- successional stages of low subtropical forest in summer [J]. J Trop Subtrop Bot, 2018, 26(4): 363–374. doi: 10.11926/jtsb.3838.俞正超, 刘晓涛, 黄烜栋, 等. 夏季南亚热带森林演替中后期优势种幼叶花色素苷的光保护作用 [J]. 热带亚热带植物学报, 2018, 26(4): 363–374. doi: 10.11926/jtsb.3838.
[17] SHEN J, JIANG C Q, YAN Y F, et al. Effect of increased UV-B radiation on carotenoid accumulation and total antioxidant capacity in tobacco (L.) leaves [J]. Genet Mol Res, 2017, 16(1): gmr16018438. doi: 10.4238/gmr16018438.
[18] NISHINO A, YASUI H, MAOKA T. Reaction and scavenging mecha- nism of-carotene and zeaxanthin with reactive oxygen species [J]. J Oleo Sci, 2017, 66(1): 77–84. doi: 10.5650/jos.ess16107.
[19] PANTELIDIS G E, VASILAKAKIS M, MANGANARIS G A, et al. Antioxidant capacity, phenol, anthocyanin and ascorbic acid contents in raspberries, blackberries, red currants, gooseberries and Cornelian cherries [J]. Food Chem, 2007, 102(3): 777–783. doi: 10.1016/j.food chem.2006.06.021.
[20] WU Z C, LIU S, ZHAO J, et al. Comparative responses to silicon and selenium in relation to antioxidant enzyme system and the glutathione- ascorbate cycle in flowering Chinese cabbage (L. ssp.var.) under cadmium stress [J]. Environ Exp Bot, 2017, 133: 1–11. doi: 10.1016/j.envexpbot.2016.09.005.
[21] HU W H, SONG X S, SHI K, et al. Changes in electron transport, superoxide dismutase and ascorbate peroxidase isoenzymes in chloro- plasts and mitochondria of cucumber leaves as influenced by chilling [J]. Photosynthetica, 2008, 46(4): 581–588. doi: 10.1007/s11099-008- 0098-5.
[22] GUO Y H, CAO K F. Effect of night chilling on photosynthesis of two coffee species grown under different irradiances [J]. J Hort Sci Bio- technol, 2004, 79(5): 713–716. doi: 10.1080/14620316.2004.11511831.
[23] HUANG W, YANG Y J, ZHANG S B. Specific roles of cyclic electron flow around photosystem I in photosynthetic regulation in immature and mature leaves [J]. J Plant Physiol, 2017, 209: 76–83. doi: 10.1016/ j.jplph.2016.11.013.
[24] NAMA S, MADIREDDI S K, YADAV R M, et al. Non-photochemical quenching-dependent acclimation and thylakoid organization ofto high light stress [J]. Photosynth Res, 2019, 139(1): 387–400. doi: 10.1007/s11120-018-0551-7.
[25] ZHU H, ZHANG T J, ZHANG P, et al. Pigment patterns and photo- protection of anthocyanins in the young leaves of four dominant sub- tropical forest tree species in two successional stages under contrasting light conditions [J]. Tree Physiol, 2016, 36(9): 1092–1104. doi: 10. 1093/treephys/tpw047.
[26] PENG C L, CHEN S W, LIN Z F, et al. Detection of antioxidative capacity in plants by scavenging organic free radical DPPH [J]. Prog Biochem Biophys, 2000, 27(6): 658–661. 彭长连, 陈少薇, 林植芳, 等. 用清除有机自由基DPPH法评价植物抗氧化能力 [J]. 生物化学与生物物理进展, 2000, 27(6): 658–661.
[27] WELLBURN A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophoto- meters of different resolution [J]. J Plant Physiol, 1994, 144(3): 307– 313. doi: 10.1016/S0176-1617(11)81192-2.
[28] SHI J H, HUANG Z L, ZHOU X Y, et al. Vertical pattern of plant community and biodiversity on the Dinghu Mountain [J]. Chin J Ecol, 2005, 24(10): 1143–1146. doi: 10.3321/j.issn:1000-4890.2005.10.006.史军辉, 黄忠良, 周小勇, 等. 鼎湖山森林群落多样性垂直分布格局的研究[J]. 生态学杂志, 2005, 24(10): 1143–1146. doi: 10.3321/j. issn:1000-4890.2005.10.006.
[29] CHEN Z, GALLIE D R. Violaxanthin de-epoxidase is rate-limiting for non-photochemical quenching under subsaturating light or during chilling in[J]. Plant Physiol Biochem, 2012, 58: 66–82. doi: 10.1016/j.plaphy.2012.06.010.
[30]VETOSHKINA D V, BORISOVA-MUBARAKSHINA M M, NAYDOV I A, et al. Impact of high light on reactive oxygen species production within photosynthetic biological membranes [J]. J Biol Life Sci, 2015, 6(2): 50–60. doi: 10.5296/jbls.v6i2.7277.
[31] DING X T, JIANG Y P, WANG H, et al. Effects of cytokinin on photosynthetic gas exchange, chlorophyll fluorescence parameters, antioxidative system and carbohydrate accumulation in cucumber (L.) under low light [J]. Acta Physiol Plant, 2013, 35 (5): 1427–1438. doi: 10.1007/s11738-012-1182-9.
[32] CHI C Y, DING G H, LIAN Y Q, et al. Effect of low temperature stress on proline content and membrane permeability in three kind cold- season turfgrass [J]. Chin Agric Sci Bull, 2007, 23(1): 101–104. doi: 10.3969/j.issn.1000-6850.2007.01.024.池春玉, 丁国华, 连永权, 等. 低温胁迫对三种冷季型草坪草脯氨酸含量及膜透性的影响[J]. 中国农学通报, 2007, 23(1): 101–104. doi: 10.3969/j.issn.1000-6850.2007.01.024.
[33] PRIETO P, PEÑUELAS J, LLUSIÀ J, et al. Effects of long-term experimental night-time warming and drought on photosynthesis, Fv/Fmand stomatal conductance in the dominant species of a Mediterranean shrubland [J]. Acta Physiol Plant, 2009, 31(4): 729–739.
[34] SHARMA D K, ANDERSEN S B, OTTOSEN C O, et al. Wheat cultivars selected for high Fv/Fmunder heat stress maintain high photosynthesis, total chlorophyll, stomatal conductance, transpiration and dry matter [J]. Physiol Plantarum, 2015, 153(2): 284–298.
[35] ZHANG K M, YU H J, SHI K, et al. Photoprotective roles of antho- cyanins in[J]. Plant Sci, 2010, 179(3): 202–208.
[36] HAJIMAHMOODI M, MOGHADDAM G, RANJBAR A M, et al. Total phenolic, flavonoids, tannin content and antioxidant power of some Iranian pomegranate flower cultivars (L.) [J]. Amer J Plant Sci, 2013, 4(9): 1815–1820. doi: 10.4236/ajps.2013. 49223.
[37] ZHANG T J, ZHENG J, YU Z C, et al. Functional characteristics of phenolic compounds accumulated in young leaves of two subtropical forest tree species of different successional stages [J]. Tree Physiol, 2018, 38(10): 1486–1501. doi: 10.1093/treephys/tpy030.
[38] JAHNS P, HOLZWARTH A R. The role of the xanthophyll cycle and of lutein in photoprotection of photosystem II [J]. Biochim Biophys Acta, 2012, 1817(1): 182–193. doi: 10.1016/j.bbabio.2011.04.012.
[39] ZHANG T J, ZHENG J, YU Z C, et al. Variations in photoprotective potential along gradients of leaf development and plant succession in subtropical forests under contrasting irradiances [J]. Environ Exp Bot, 2018, 154: 23–32. doi: 10.1016/j.envexpbot.2017.07.016.
[40] ZHANG Q, ZHANG T J, CHOW W S, et al. Photosynthetic charac- teristics and light energy conversions under different light environ- ments in five tree species occupying dominant status at different stages of subtropical forest succession [J]. Funct Plant Biol, 2015, 42(7): 609– 619. doi: 10.1071/FP14355.
[41] CHEN Z, GALLIE D R. Ethylene regulates energy-dependent non- photochemical quenching inthrough repression of the xanthophyll cycle [J]. PLoS ONE, 2015, 10(12): e0144209. doi: 10. 1371/journal.pone.0144209.
[42] TOWNSEND A J, WARE M A, RUBAN A V. Dynamic interplay between photodamage and photoprotection in photosystem II [J]. Plant Cell Environ, 2018, 41(5): 1098–1112. doi: 10.1111/pce.13107.
Photoprotection Strategies in Young Leaves of Dominant Species in Mid- and Late-Successional Stages of Low Subtropical Forest in Winter
LIN Wei, YU Zheng-chao, LUO Yan-na, SHI Chu-liang, LAI Yu-bo, PENG Chang-lian*
(Guangdong Key Laboratory of Biotechnology for Plant Development, School of Life Science, South China Normal University, Guangzhou 510631, China)
In order to understand the mechanism of photoprotection strategies of dominant species at different successional stages under different light environments in winter, the physiological and biochemical responsethree dominant species at mid-successional stage, i.e.,andand three dominant species at late-successional stage, i.e.,,grown on full light (100% natural light) and low light (30% natural light) were studied. The results showed that, compared with full light, the non-photochemical quenching (NPQ), ratio of carotenoid to chlorophyll (Car/Chl) and anthocyanin content in young leaves of dominant species at mid-successional stage under low light decreased, and the relative cytoplasmic membrane leakage increased. On the contrary, the anthocyanin content in young leaves of dominant species in the late-successional stage increased, the relative cytoplasmic membrane leakage decreased, and the degree of light inhibition was low (high Fv/Fm). In addition, the anthocyanin content, NPQ and Car/Chl in young leaves of mid-successional species were significantly lower than those of late- successional species except of total antioxidant capacity. So, the dominant species at late-successional stage could improve their adaptability to high light environments in winter through their flexible light protection strategies. However, the diversity of light protection strategies and light protection ability of dominant species at mid- successional stage were weaker than those at late-successional stage.
Community succession; Anthocyanin; Non-photochemical quenching; Photoprotection; Winter
10.11926/jtsb.4264
2020–06–13
2020–09–20
国家自然科学基金项目(31870374, 31570398);广东省自然科学基金项目(2017A030313167, 2015A030311023)资助
This work was supported by the National Natural Science Foundation of China (Grant No. 31870374, 31570398), and the Projects for Natural Science in Guangdong (Grant No. 2017A030313167, 2015A030311023).
林威,男,硕士,主要从事植物生理生态研究。E-mail: 1844052102@qq.com
. E-mail: pengchl@scib.ac.cn
