荆州市犬细小病毒病临床诊疗分析
2021-04-02刘诗雨赵懿侔赵梦杉郭帅郭灿森邱实吕熙张含露杨丰利万春云王家乡
刘诗雨 赵懿侔 赵梦杉 郭帅 郭灿森,2 邱实 吕熙,3 张含露 杨丰利* 万春云* 王家乡*
(1,长江大学动物科学学院 434025,2,武汉联合动物医院 430012,3,长江大学文理学院 434025)
犬细小病毒病(Canine provovirus disease,CPD)又称犬传染性肠炎或犬病毒性肠炎,是由犬细小病毒 (Canine provovirus,CPV)引起的以出血性肠炎和急性心肌炎为主要临床特征的传染性疾病,幼犬感染率和死亡率均较高[1]。CPV 主要通过消化道感染健康犬只,病毒进入机体后主要损伤肠道上皮细胞和心肌细胞,而后机体表现相对应的胃肠道症状和心肌炎症状[2]。临床上表现为初期精神状态差,食欲下降,体温升高至40℃以上,呕吐[3]。腹泻是犬细小病毒病的主要症状,粪便多呈巧克力色,为粥样或水样。该病后期发展为剧烈呕吐,腹泻以水样为主,粪便中有血,呈烂番茄色,且常伴有犬细小病毒病特有的浓烈腥臭味,严重的腹泻会引起病犬肛门松弛[4]。
CPD 是犬类危害最严重的烈性传染病之一,对犬养殖业及宠物犬行业威胁极大。自宠物行业飞速发展以来,犬细小病毒病每年都会造成宠物及野生动物大量死亡。犬只感染后治愈难且治疗费用较高,该病病程发展快,若得不到及时救治会造成犬只死亡。在实际生活中利用免疫接种来预防该疾病。常见的CPV 疫苗通常需要2~3 次注射,整个免疫机制的建立大约需要2 个月[5],但2~5 月龄阶段是该病高发阶段,这一阶段的幼犬往往没有建立起免疫机制,导致CPV 仍然威胁犬类健康。
1 材料
1.1 病例来源
荆州市某动物医院自2019 年1 月至2020 年9 月收治患犬细小病毒病例22 例。
1.2 仪器设备
朝云帆干式荧光免疫分析仪、电子秤、听诊器、体温计、输液泵等。
1.3 治疗药物
5%葡萄糖氯化钠注射液、乳酸钠林格注射液、氨基酸(18-AA)、0.9%氯化钠注射液、利巴韦林注射液、辅酶A、三磷酸腺苷二钠注射液(ATP)、盐酸昂丹司琼注射液、酚磺乙胺注射液、硫酸庆大霉素注射液、地塞米松盐酸钠注射液、氟尼辛葡甲胺注射液、注射用头孢哌酮钠舒巴坦粉针、VC注射液、复合维生素B 注射液、黄芪多糖注射液、复方布他磷注射液(科特壮)、犬细小病毒单克隆抗体(威特瑞)、注射用重组犬α干扰素(中科拜客)、注射用重组犬细小抑制蛋白(铁草)、特精制抗犬病五联血清(吉林五星)。
2 方法
2.1 初步诊断
询问犬主患犬的基本情况,包括患犬姓名,年龄,发病表现,发病时间,病史,患犬生活习惯,驱虫史及疫苗史等。
根据犬细小病毒病患犬的典型症状,采用视诊、触诊、听诊、嗅诊进行初步诊断。(1)视诊:观察患犬精神状态,患犬是否精神沉郁,检查毛发及皮肤状态,鼻尖是否干燥,肛门周围是否沾有污物,观察有无呼吸急促、呼吸困难、张口呼吸等表现。检查牙龈、口腔、眼睑及眼结膜颜色,有无苍白、发绀。是否有呕吐、腹泻等症状,呕吐物中可见大量气泡,粪便稀软甚至排泄酱油样番茄样的血便,等。(2)触诊:牵拉患犬皮肤观察回弹速度,判断脱水程度。(3)听诊:听诊患犬心肺部,判断是否有表现心跳加速、心律不齐,是否有心杂音。(4)嗅诊:嗅闻患犬的气味,有无犬细小病毒病特有的腥臭气味。
2.2 实验室确诊
朝云帆犬细小病毒荧光免疫层析检测试剂盒检测:用棉签插入犬肛门中转3 圈,取样棉签在稀释液中充分搅拌,用移液器吸取80μL 样品溶液加入加样孔中,将试纸卡插入干式荧光免疫分析仪中,启动“标准测试”,等待检测结果上传,打印报告完成检测。结果判定:阴性 (0~100IU);携带 (100~3000IU);弱阳(3000~10000IU);阳性(10000~50000IU);强阳(≥50000IU)。
2.3 治疗方法
临床上最常采用综合疗法治疗犬细小病毒病,即在使用CPV 单抗、抑制蛋白、血清、干扰素的同时对症给药、抗菌消炎、补液强心等。在治疗过程中建议患犬住院治疗,加强对病犬的护理、保温,患犬治疗初期需要禁食禁水,出现好转后可给予食物。同时要加强对患犬生活环境的消毒,为患犬康复奠定基础。具体用药方案及用量根据患犬个体情况而定,根据宠物主人要求也会使用单一的对症支持治疗法或对因治疗法。
对症支持治疗法即针对患犬症状进行治疗,主要是抗菌消炎、止血、止吐、止泻。抗菌消炎:庆大霉素注射液、地塞米松盐酸钠注射液、注射用头孢哌酮钠舒巴坦粉针;止血:酚磺乙胺注射液;止吐:盐酸昂丹司琼注射液;止泻:阿托品注射液;解热镇痛:氟尼辛葡甲胺注射液。支持治疗主要是补充机体能量,纠正体内酸碱平衡。根据患犬脱水程度确定补液量,临床采用5%葡萄糖氯化钠注射液及乳酸钠林格注射液等作为主要补液药物,再混入VC、复合维生素B、科特壮、ATP、辅酶A 等药物一起静脉滴注,或皮下注射黄芪多糖。
对因治疗即针对病毒治疗。广谱抗病毒:利巴韦林注射液、注射用重组犬α 干扰素;特异性抗病毒:肌肉或皮下注射犬细小病毒单克隆抗体、注射用重组犬细小抑制蛋白、特精制抗犬病五联血清等生物制剂。
3 结果
3.1 实验室诊断结果
朝云帆犬细小病毒荧光免疫层析检测试剂盒检查结果见附图、表1、表2、表3。在确诊的22 例犬细小病毒病中,检测结果中15 例为“携带”,1 例为“弱阳”,5 例为“阳性”,1 例为“强阳”。
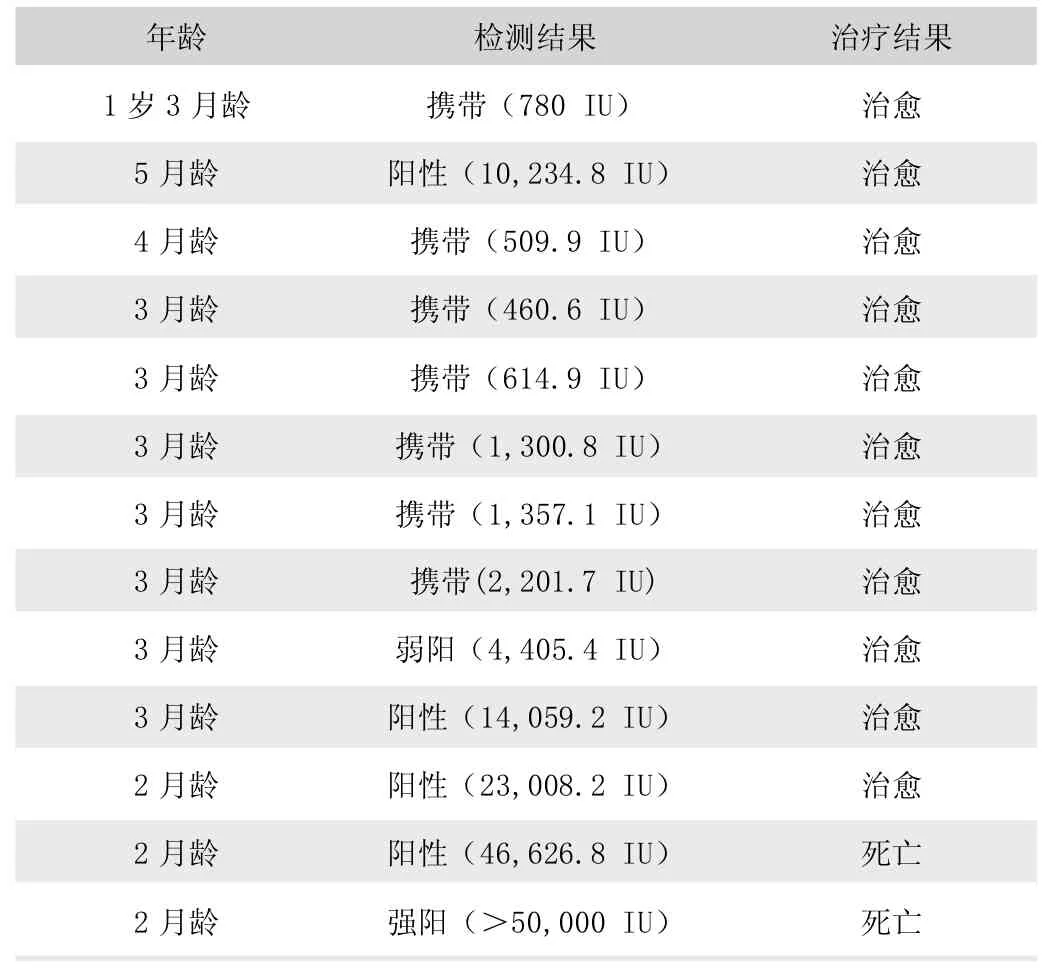
表1 犬细小病毒病综合治疗结果
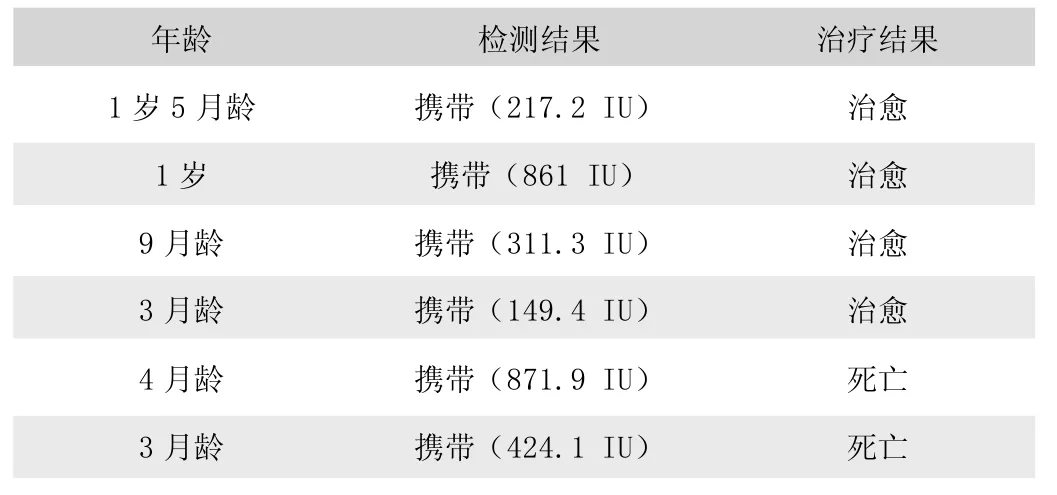
表2 犬细小病毒病对因治疗结果
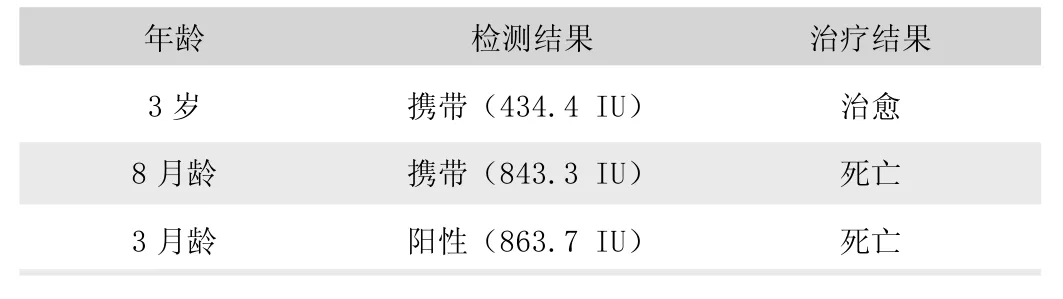
表3 犬细小病毒病对症治疗结果
3.2 治疗结果
荆州市某动物医院自2019 年1 月至2020 年12 月期间共计收治的犬细小病毒病患犬22 例。其中综合治疗13 例,治愈11 例(表1);对因治疗6 例,治愈4 例(表2);对症支持治疗3 例,治愈1 例(表3)。犬细小病毒病总治愈率为72.72%,2~5 月龄患犬治愈率为68.75%,“携带” 病毒患犬治愈率为75% (表4)。
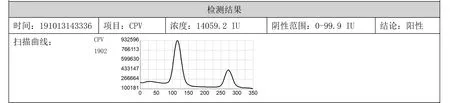
附图 一例朝云帆犬细小病毒荧光免疫层析检测试剂盒检查结果报告单
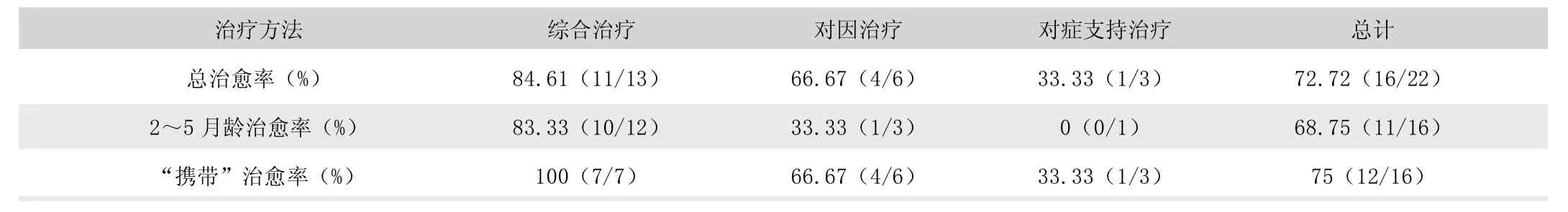
表4 犬细小病毒病整体治疗结果
4 讨论
犬细小病毒病在实际应用中主要采用临床诊断和实验室确诊。临床上通常以精神状态差、食欲废绝、体温升高、呕吐、出血性腹泻及脱水等症状为主要诊断依据。而确诊通常采用CPV 试纸检测,常见的检测试纸通常以胶体金免疫层析技术为主,该方法快速便捷,简单易操作,5min 左右即可显示结果,但该技术仅能检测抗原或抗体的有无,无法判断病毒量,而且易出现假阴性。而本试验中采用的荧光定量免疫层析技术的检测板,操作相对胶体金试纸较复杂,但可检测出CPV 的单位病毒量,为诊断及治疗提供可靠的依据[6]。
犬细小病毒病的治疗原则主要是对症治疗、强心补液、禁食禁水、止血止泻、防止继发感染。临床上在使用干扰素、CPV 单抗等生物制剂的同时也需要对症给药,为患犬补充能量增强机体免疫。但根据宠物主人的观念意识、经济条件、时间安排,有时会采用单纯的对症或对因治疗方法。荆州某动物医院22 例病例的治愈率为72.72%,其中综合治疗的病犬治愈率明显高出其他治疗方式,达到84.61%。仅对病毒量较低且症状轻微的患犬有治疗效果,对症支持治疗在本试验中仅治愈一例病毒含量低且症状较轻的成年犬,临床上建议使用综合疗法。
犬细小病毒病多见于未经免疫的幼犬,严重威胁幼犬生命。荆州市某动物医院自2019 年1 月至2020 年9 月的22 例犬细小病毒病中16 例为2~5 月龄幼犬,治愈率为68.75%。采用综合治疗的治愈率为83.33%,对症支持治疗和对因治疗治愈率低,在本试验中仅一例3 月龄、症状轻微、病毒浓度149.4IU 的患犬采用对因治疗成功治愈。
提高犬细小病毒病治愈率的关键是及早发现、及时确诊、迅速控制病情。在临床治疗中,症状较轻的患犬病毒含量也相对更低,及早发现治疗有助于提高患犬治愈率。具体体现在荆州市某医院的病历中总治愈率为72.72%,而荧光定量CPV 检测的病毒量在“携带” (CPV 浓度在100~3000IU)范围内的治愈率为75%,高于总治愈率。检测结果为“携带” 且采用综合治疗的治愈率高达100%,采用治愈率低的对因治疗和对症治疗时也有成功治愈的病例。综上所述,在犬细小病毒病早期,病毒含量较低时采用综合治疗,治疗效果最佳。
犬细小病毒病治疗难度较大,治疗成本高,荆州地区对宠物的经济投入相比发达城市较低,受消费观念的影响部分宠物主人会选择廉价但效果不佳的治疗方式,导致大多数本可以治愈的患犬死亡。因宠物主人缺乏专业知识,往往在患犬出现症状的3~5d 后才送医治疗,此时患犬身体状况不佳,治疗难度增大。治疗过程中患宠护理对治愈率也有很大影响,部分宠物主人不遵守医嘱,喂食或其他护理不当,导致患病宠物病情加重或传染周边其他犬只的情况也有发生。因此,建议住院治疗并安排专业人员进行护理。
犬细小病毒病早期治愈率较高,采用荧光定量检测板测定病毒浓度,结合临床症状治疗对治疗效果有很大帮助。在治疗过程中建议采用CPV 单抗、高免血清与干扰素等生物制剂对因治疗,同时采用抗菌消炎、对症用药、补液强心等对症支持治疗,有助于提高治愈率。
