中心血管通路技术和应用新进展
2021-04-01
1 北京大学第一医院介入血管外科 (北京 100034)
2 山东省医疗器械产品质量检验中心 (山东 济南 250101)
内容提要:中心血管通路装置是临床重症、肿瘤、长期静脉输液患者的重要工具,临床应用广泛,主要包括中心静脉导管、经外周中心静脉导管和输液港三种类型。与外周血管通路相比,中心血管通路装置留置时间长,可满足患者大量输注高渗液体、肠外营养液和化疗药物等需求。传统的中心血管通路建立技术存在穿刺难、定位差、并发症多等临床问题,心电超声多普勒引导(ECG Doppler Ultrasonic Guiding,EDUG)技术和中心血管通路系统化管理策略从靶血管筛选、平面穿刺复合显像、体内生物电精准导航等方面创建了新的技术体系,提高穿刺、导管定位的成功率,降低导管相关性并发症。其中,EDUG置管技术、无盲区穿刺技术及临床应用是中心血管通路领域的中国解决方案。
中心血管通路,即为临床诊断和治疗需要,通过静脉穿刺置入的导管头端位于中心静脉的通路装置,包括经颈内、锁骨下、股静脉穿刺的中心静脉导管(Central Venous Catheter,CVC)、经上肢贵要静脉、肘正中静脉、头静脉、肱静脉穿刺的经外周置入中心静脉导管(Peripherally Inserted Central Catheters,PICC)、完全植入体内的闭合输液装置输液港(Implantable Venous Access Port,PORT)等[1,2]。中心静脉血管直径大,血液流量大,能够避免外周静脉输注高渗液体或化疗药物引起外渗所造成血管及皮下组织损伤,大大降低了机械性、化学性和血栓性静脉炎的发生,可满足患者大量输注高渗液体、肠外营养液和化疗药物等需求[3]。中心血管通路装置留置时间长,可减少患者反复静脉穿刺的痛苦,适用于各种严重心功能不全、严重创伤、重症抢救、肠外营养、长期输液以及肿瘤化疗的患者[4]。通过该血管通路可以给药、抽血和化验,除了治疗和维护需求,患者可带管在院外生活,舒适度和自由度较高。CVC、PICC和PORT等中心血管通路的对比分析见表1。

表1.CVC、PICC和PORT等中心血管通路的对比分析
1.行业状况
近年来,随着肿瘤、心脑血管疾病发病率越来越高和中心静脉血管通路装置置管技术的普及,血管通路的应用越来越广泛,最直接的表现在于应用科室的普及和用量的迅速增长。
中心静脉血管通路装置置管术首先在麻醉科应用广泛,如今在危重病监护病房、手术室、急诊科、肿瘤科、普外科等科室日益普及。越来越多的医院建立专业化PICC门诊,通过置入PICC以对危重及大手术患者进行全肠外中心静脉营养、输注高渗或刺激性的溶液、输血或血液制品、输入有配伍禁忌的药物(多腔导管)等。钛合金、陶瓷、高分子等不同材质的PORT给临床带来多样化的选择。
目前,全球中心静脉血管通路装置每年置入量超过1000万例,美国总体每年置入400万例,我国年置入量超过200万例。在我国,目前每年CVC使用量100万例以上,PICC约60万例,PORT约5万例。随着人口老龄化、肿瘤、心脑血管患者持续增加,未来中心静脉血管通路装置每年置入量将出现快速增长,预计全球市场会达到2000万例,我国总体市场容量未来3~5年将达到500万例,CVC超过300万例,PICC超过100万例,PORT超过10万例。
我国已经批准上市销售的CVC产品超过40家,国产产品与进口产品价格竞争激烈。在PICC领域,美国BD公司产品2000年引进国内,长期垄断中国市场,直至2011年山东百多安获得CFDA批准的首张国产PICC注册证,才终于打破进口产品的垄断,逐步替代进口,目前位居国产首位,年销售量10多万条,市场份额25%~30%。之后有广东佛山特种,河南迪奥等品牌陆续拿到国产医疗器械注册证。在PORT领域,仍然由进口BD产品占据主要市场,上海荣成医科于2017年获得国产注册证,其销售数据尚未披露。我国目前有脑卒中患者1300万,冠心病患者1100万,恶性肿瘤每年发病400万例[12,13]。这些患者治疗往往需要建立中心血管通路,而我国中心静脉导管的使用率与美国及欧洲相比仍有较大差距,市场还处于发展阶段,有很大的行业发展空间和市场潜力。
2.研究进展
中心静脉血管通路装置在静脉穿刺和留置过程中可能发生误穿神经、动脉和淋巴、渗血、渗液、感染、静脉炎、血栓、导管移位、异位、堵管、断管等相关并发症[14-16]。有些并发症将造成不可挽回的损失,比如神经损伤、血栓、导管脱落进入肺动脉等。因此,如何降低导管相关性并发症发生率,保证患者的输液安全已成为临床迫切需要解决的问题。为此,美国、欧洲、中国等各国的静脉输液护理学会不断在以最新临床研究、科学前沿、技术创新与临床实践的基础上更新输液理念,提出《输液治疗实践标准》以指导临床安全实践[1-4]。临床实践一般从三个方面进行考虑:①患者本身的因素,如患者年龄、疾病类型及合并疾病、治疗方案、输液治疗史、血管特征以及对输液治疗位置的偏好;②医疗因素,医护人员的素质,置管方法和标准,医疗环境和设施等;③血管通路装置本身的性质。随着专业化输液团队的成立,理论及实践水平的提高,医疗环境和设施的加强以及患者教育的强化,中心血管通路新技术成为进一步降低操作难度、提高置管成功率、降低并发症发生率的关键因素。
2.1 中心血管通路系统化管理策略
选择恰当的穿刺部位和血管,确保理想的导管头端位置是关系中心静脉通路装置置入成功及安全使用的关键因素[2]。通过多普勒超声评估穿刺部位及血管以筛选合适的穿刺部位是减少导管相关性并发症的有效手段之一。根据指南推荐,理想的导管头端位置应位于上腔静脉与右心房交界处[1-3]。导管头端位置过浅可能导致回血、堵管、导管移位、血栓和胸腔积液;导管头端位置过深,易增加房颤、心肌穿孔和心包积液等风险[17,18]。目前临床采用X射线定位,需要患者反复暴露于射线之中,效率低下且该方法存在系统误差[19]。数字减影血管造影术(Digital Subtraction Angiography,DSA)通过血管介入的方法进行置管和定位,成本较高,同样存在X射线暴露问题,是孕妇和幼儿的相对禁忌。经食管超声心动图(Transesophageal Echocardiography,TEE)程序复杂耗时长,普及率较低。通过腔内心电P波变化以判断导管头端位置的腔内心电图(Electrocardiography,ECG)定位技术操作便捷,可在床旁操作,准确度高,同时避免了放射线的暴露[20]。保护出口位置,避免细菌污染也是降低感染率的重要手段[21]。
中心血管通路系统化管理策略是基于优化的置管方法和维护的系统化管理来降低并发症风险。主要为以下几个方面:
2.1.1 多普勒超声评估。选择穿刺部位前应对以下方面进行评估:患者年龄、身体状况、临床诊断;穿刺部位血管条件和周围情况;静脉穿刺、置管和疾病既往史;输液治疗的药物性质、持续时间和患者的意愿等[22]。应对手臂(贵要静脉,肱静脉)和颈部(腋静脉,锁骨下静脉,颈内静脉,头臂静脉)进行完整的双侧扫描,以排除主要异常,排除先前存在的静脉血栓。手臂的深静脉应该分别在带止血带和不带止血带的情况下进行评估。避开关节、解剖变异、皮肤感染、肿瘤浸润、放疗损伤及存在其他血管内装置(如,已存在的血液透析导管)等部位。首选上肢静脉通路置管,尽可能避免下肢静脉置管。尽量选择直径大于导管直径3倍的静脉。准确识别中位神经和腋动脉,以避免误穿。CVC置管部位主要包括锁骨下静脉、颈内静脉,首选右侧锁骨下静脉[23]。PICC置管部位主要包括贵要静脉、肱静脉和腋静脉等,首选右侧贵要静脉[2]。PORT置管部位主要包括锁骨下静脉、颈内静脉、贵要静脉等,推荐首选右侧锁骨下静脉[24]。
2.1.2 操作时注意手部卫生、无菌技术和最大化屏障保护。最大化的屏障保护包括无菌手套,面罩,帽子,无菌手术服,用无菌盖布覆盖患者大部分身体,以及探头上方的长无菌罩。在PICC置管前,优选使用2%的洗必泰酒精溶液(70%异丙醇)进行皮肤消毒[1-4]。
2.1.3 血管穿刺。在置管前对患者进行全面评估,包括患者的病情、年龄、诊断、药物的理化性质、治疗持续时间、穿刺部位及血管情况等,根据评估筛选最佳的穿刺部位和血管。推荐采用实时超声引导深静脉穿刺和赛丁格技术进行穿刺[1-3]。
2.1.4 置管时超声引导导管尖端导航。将导管插入套管时,同侧颈内静脉应由超声探头探测,以便于导管从锁骨下静脉进入头臂静脉[25]。置管后,应通过超声扫描双侧颈内静脉,确保导管没有置入到颈内静脉。
2.1.5 腔内心电图来评估导管尖端定位。腔内心电图是一种在置管时便宜、高效、简单、安全的实时评估导管尖端位置的方式。导管尖端的准确定位(接近上腔静脉和右心房交汇处)可以降低导管异常、纤维蛋白鞘和导管相关性血栓的风险,同时减少了重复置管的风险和花费[18,26]。
2.1.6 导管固定和包扎。使用氰基丙烯酸酯凝胶、非缝线装置和透明敷料来固定PICC导管。PICC应该使用非缝线装置进行出口固定,而不是通过标准缝合,以降低感染、移位和局部血栓形成的风险。氰基丙烯酸酯凝胶加透明敷料可保护出口位置,防止移位,避免置管后出血和细菌污染[21]。
2.1.7 腔内心电联合多普勒超声辅助诊断导管置入后并发症
患者在导管留置期间,可用腔内心电图初步排查导管是否移位,彩色多普勒超声可识别隐性血栓,以进行及时有效监测和治疗。
2.2 腔内心电联合多普勒超声置管应用中国方案
EDUG是将无盲区平面进针新型超声换能器以及超声、多普勒、心电等生物特征识别技术以及信息处理单元进行系统集成,将靶血管筛选、穿刺复合显像、导管心电导航等功能有机结合为一体的国内外首台中心血管心电彩色超声多普勒诊疗系统,是中心静脉血管通路的专用数字诊疗设备。
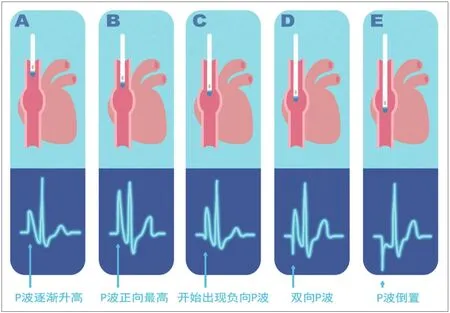
图1.典型的P波形态与导管头端位置对应图[27](注:A:导管头端进入上腔静脉时,P波逐渐增高;B:导管头端到达上腔静脉与右心房交界处时,P波正向最高;C:导管头端进入右心房后,开始出现负向P波;D:导管头端进入右心房中部,出现双向P波;E:导管头端进入右心房下部,P波倒置为负向P波。)
基于超声背散射射频(RF)信号的生物组织特性定征分析方法和深度卷积神经网络图像分割模型改善图像质量,智能识别超声血管几何边界和直径变化。应用多普勒超声进行血管评估,筛选直径较大、流速较快的静脉,替代传统的盲穿技术,实现从体表到靶血管全程超声成像实时监控,提高穿刺成功率;可导电的高强韧度血管通路导管采用头端心电P波形态监测,实现导管的腔内实时导航与到位操作提示,定位误差由2cm降低至0.5cm以下,定位成功率由86.8%提高到99.3%,特异性100%,临床断管并发症发生率从3‰~6.7‰,降低到0.3‰以下[18,26]。体表与腔内ECG同时显示从而进行导管头端位置的判断,一机多用,避免了孕妇、新生儿和儿童以及众多患者放射线的暴露,保证了患者的安全,现已广泛应用于临床,并取得多普勒超声腔内心电一体化引导建立和维护中心血管通路专家共识[27]。
3.研究展望
传统的中心血管通路建立技术存在穿刺难、定位差、并发症多三大临床应用挑战,EDUG置管技术和中心血管通路系统化管理策略从靶血管筛选、全程监控穿刺显像、体内生物电精准导航三方面创建了新的技术体系,提高穿刺和置管成功率,降低导管相关性并发症。未来对于体表心电图无P波、患有心血管疾病(心脏病、心房颤动、室上性心动过速及肺心病)、起搏器植入及心脏手术史等患者的成功置管是中心静脉血管通路装置置管和应用新的发展方向。另外,随着人工智能技术的应用,预计未来在中心血管通路技术领域,会出现操作机器人等新技术和产品,并进入临床应用。
