α-硫辛酸对顺铂诱导小鼠耳毒性的保护作用
2021-04-01赵永强孔凌霄陈剑秋
贺 祯,赵永强,孔凌霄,陈剑秋
顺铂(Cisplatin)的抗癌特性在20 世纪60 年代被发现,现已被广泛用于许多实体肿瘤,然而顺铂在临床化疗中的不良反应如血液系统毒性、肾毒性、神经毒性、耳毒性,往往不可避免[1]。顺铂引起的耳毒性可导致双侧、进行性、剂量依赖性的感觉神经性听力损失,听力损失会严重影响患者的生活质量。尽管尚不清楚顺铂引起耳毒性的基本分子机制,但先前的研究表明,顺铂激活线粒体活性氧生成途径,最终导致细胞死亡[2]。过量活性氧(reactive oxygen species,ROS) 的产生被认为是顺铂诱导的耳毒性的主要原因,也是顺铂对DNA 的直接攻击[3]。
α-硫辛酸(alpha-lipoic acid,ALA),是线粒体脱氢酶反应中不可或缺的辅助因子,可溶于水和脂质,并广泛分布在细胞膜,细胞质和细胞外空间。Biewenga 等报道了ALA 的保护作用,他们发现ALA 可以减轻由于维生素C 和E 缺乏引起的坏血病症状[4]。后续的研究证明,ALA 是人体内一种效应强大的抗氧化剂,并对包括维生素C、E 和还原型谷胱甘肽等抗氧化剂有协同加成能力[5]。
笔者拟通过建立大鼠顺铂听力损害动物模型,研究ALA 对顺铂诱导的听力损失的影响,并推测ALA 激活的抗凋亡途径在体外防止顺铂诱导的耳毒性的潜在机制。
1 材料与方法
1.1 实验动物购自山东大学实验动物中心健康BALB/c 小鼠40 只,重量18~22 g,耳郭反射正常,雌雄兼用,室温下常规饮食安静饲养。所有涉及动物的程序均符合动物实验规定。
1.2 材料和仪器注射用顺铂 (齐鲁制药厂,国药准字H37021356);注射用硫辛酸 (江苏奥赛康药业,国药准字H20061176);TRITC Phalloidin 罗丹明标记鬼笔环肽 (上海翊圣生物科技有限公司,货号:40734ES75) 小鼠8-Hydroxy-2'-deoxyguanosine单克隆抗体 (Anti-8-OHdG)(abcam 公司,货号ab48508);GSH-Px 多克隆抗体(abcam 公司,货号ab51948);小鼠Bax 单克隆抗体(abcam 公司,货号ab77566);小鼠Bal-2 单克隆抗体(abcam 公司,货号ab154140)。听觉诱发电位一耳声发射记录使用美国Smart EP&OAE 智听公司系统。共聚焦显微镜使用德国Zeiss,LSM 700。
1.3 实验动物分组与设计使用前瞻性随机对照实验,随机数字表法将动物小鼠分为以下四组:对照组、顺铂组、硫辛酸+顺铂组、硫辛酸组(每组10只小鼠,20 耳)。顺铂组小鼠给予腹腔注射顺铂4 mg/kg·d,连续5 d;硫辛酸组小鼠给予腹腔注射硫辛酸20 mg/kg·d,连续6 d;顺铂+硫辛酸组小鼠提前1 d预处理,腹腔注射硫辛酸20 mg/kg·d,在第2 天同时腹腔注射顺铂4 mg/kg·d,连续5 d;对照组仅给予腹腔注射等量生理盐水。四组停药后复查听性脑干反应 (auditory brainstem response,ABR),完成ABR 检查后处死小鼠取耳蜗用于形态学观察及后续分子生物学实验。
1.4 听性脑干反应的检查为了评估听觉功能,笔者对小鼠在给药前后进行了ABR 检查。所有测试均在隔音室内进行。在进行ABR 检查之前,参照文献方法[6]通过腹腔注射1%戊巴比妥钠(80 mg/kg)麻醉动物,将皮下针电极插入到颅顶正中皮下(+电极),乳突(-电极)和后腿(接地)中。通过扬声器单声道施短纯声音刺激,频率分别为8、16 和32。从90 dB 声压级开始,以5 dB 的减量重复的刺激。
1.5 组织学切片和形态学分析四组动物停药并完成ABR 检查后,立即断头处死,参照文献方法速取听泡[6,7]。充分暴露耳蜗后,显微镜下刺破圆窗和卵圆窗,蜗尖钻孔并使用含4%多聚甲醛的0.1 mol/L PBS 溶液缓慢灌注小鼠内耳,将耳蜗标本用含0.10%戊二醛+4%多聚甲醛混合液的双固定液固定24 h,立体显微镜下去除骨性蜗管等结构,分离出基底膜。此步完成之后,分别制作扫描电镜标本、免疫荧光标本及石蜡切片。(1)扫描电镜标本置于3%戊二醛中送山东大学电镜中心,由电镜中心进行扫描电镜所需的各项处理,同电镜中心工作人员一起观察标本并照相。(2)免疫荧光标本在4% EDTA 脱钙24 h 后,用虹膜刀小心分离基底膜,PBS 冲洗后标本在室温下与0.1%Triton X-100 孵育15 min,1∶40的TRITC-鬼笔环肽染色2 h,然后用PBS 洗涤3次。使用共聚焦显微镜镜下观察。(3)石蜡切片,耳蜗用梯度乙醇系列脱水,用二甲苯渗透,并在室温下包埋在石蜡中。然后使用切片机将石蜡包埋的内耳连续切成6 μm 厚的切片,以备下一步免疫组化分析用。
1.6 免疫组化分析8-OHdG 表达石蜡切片脱蜡和干燥后,微波修复,滴加1 滴3%H2O2,室温下孵育10 min,用PBS 洗涤5~10 min 后,将标本与小鼠8-羟基脱氧鸟苷(8-Hydroxy-2'-deoxyguanosine,8-OHdG)单克隆抗体室温下放置2 h,用PBS 洗涤两次,每张切片加1 滴聚合物增强剂,室温下孵育20 min。PBS 冲洗后加1 滴酶标聚合物,室温下孵育30 min。PBS 冲洗后将3-3'二氨基联苯胺(DAB)色原滴到切片上,并原位放置5~10 min 以吸收色原。通过将样本在苏木精中保留1~2 min 来提供背景染色。
1.7 蛋白质印迹分析ABR 检查后断头处死,取出耳蜗组织,每2 个耳蜗合为一份标本,放入RIPA裂解液,低温震荡研磨,低温高速离心30 min。取上清液并测定蛋白含量。灌胶后上样,SDS 聚丙烯酞胺凝胶电泳,转膜,封闭,室温孵育1 h 后,加入1∶1000 稀释的GSH-Px、Bax、Bal-2 一抗,4 ℃孵育过夜。TBST 冲洗后加入二抗(1∶1000 稀释),室温孵育1 h,TBST 冲洗,显影,Image J 图像分析软件对条带进行半定量分析。
1.8 统计学分析计量数据以()表示。正组间两两多重比较使用t 检验,同时,对组织病理学数据进行Ridit 分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 ABR 阈值偏移使用小鼠模型检查了ALA对顺铂诱导的耳毒性的保护作用。小鼠于给药处理前后经麻醉后测试ABR 数值,将前后2组数值相减,得出差值,即为ABR 阈值偏移以客观评价小鼠耳蜗的听力受损情况。对于对照组和ALA组,ABR的阈值偏移均<5 dB,这表明正常小鼠的ALA 治疗不会影响听力。顺铂组的ABR 阈值偏移较对照组显著上升,证实了顺铂治疗会导致严重的听力损失。硫辛酸+顺铂组阈值偏移明显小于顺铂组,表明用ALA 进行的处理干预可以明显保护听力。见图1。
图1 见封三。
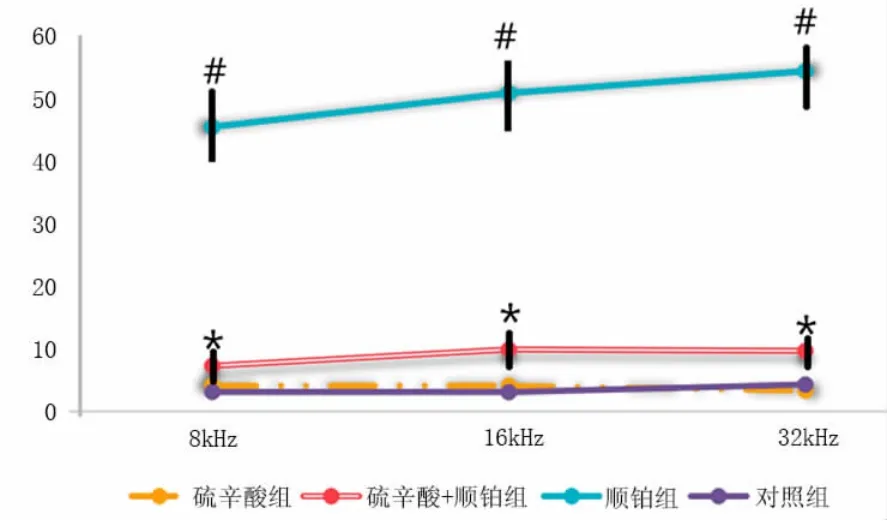
图1 4组小鼠干预前后ABR 阈值偏移
2.2 形态学观察使用共聚焦显微镜观察鬼笔环肽染色后的基底膜以及电镜下观察形态学改变,均发现顺铂组耳蜗外毛细胞数量减少、形态改变,硫辛酸+顺铂组使用ALA 干预后较顺铂组耳蜗外毛细胞数量增加、形态恢复。具体表现为:顺铂组共聚焦显微镜下外毛细胞数量减少、明显变性,硫辛酸+顺铂组外毛细胞数量明显较顺铂组增加,细胞变性减轻;电镜下,顺铂组耳蜗外毛细胞数目减少,形态上静纤毛见明显缺失、倒伏和融合,排列散乱,硫辛酸+顺铂组外毛细胞数量较顺铂组明显恢复,外毛细胞静纤毛仅见个别自然缺失、融合。形态学上发现顺铂对外毛细胞有明显损害,使用ALA 后这种损害得到了明显的保护和减轻。见图2。
2.3 免疫组化观察DNA 损伤为了从免疫组织化学的角度鉴定氧化性DNA 损伤,进行了8-OHdG染色。对照组或硫辛酸组均未观察到8-OHdG 免疫阳性(图3A、B)。在顺铂组的外毛细胞中确定了严重的免疫阳性(图3C)。在硫辛酸+顺铂组中,在外毛细胞中观察到了少量的8-OHdG 表达 (图3D)。硫辛酸+顺铂组较顺铂组之间的8-OHdG 表达显著降低(P<0.05)。
图3 见封三。
2.4 Western blot 检测通过Western blot 检测了GSH-Px 和Bax/Bcl-2 蛋白的表达水平。在用ALA 治疗的2组中,GSH-Px 表达均较对照组明显上调(图4A);顺铂处理比对照组更多地上调了Bax表达,ALA 处理的细胞显著下调了Bax 表达 (图4B);顺铂处理下调了Bcl-2 的表达,ALA 处理的细胞恢复了Bcl-2 的表达(图4B)。

图2 小鼠模型的形态学变化
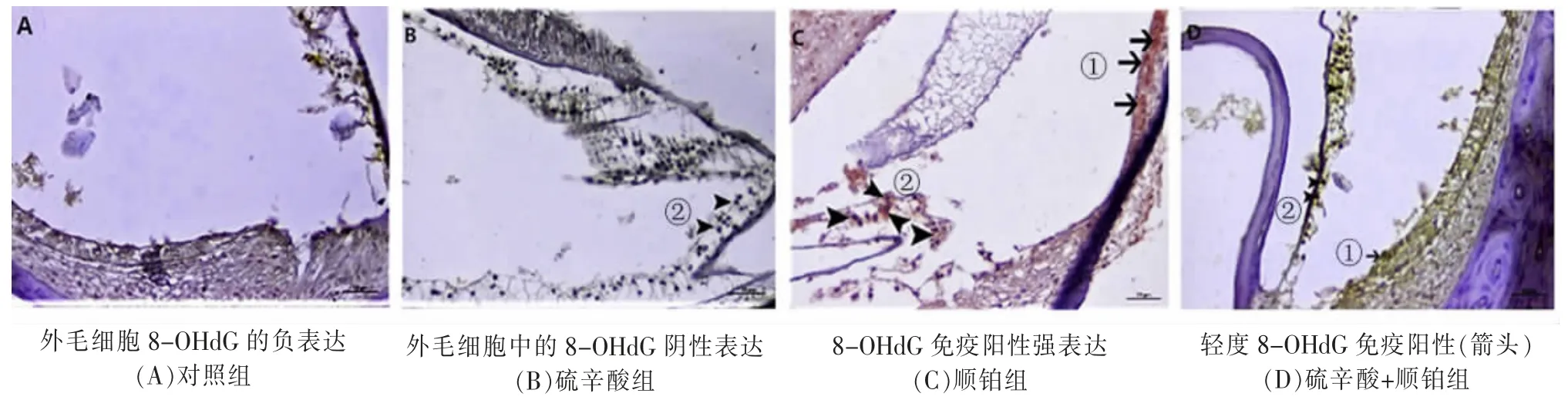
图3 8-OHdG染色从免疫组化观察DNA 损伤
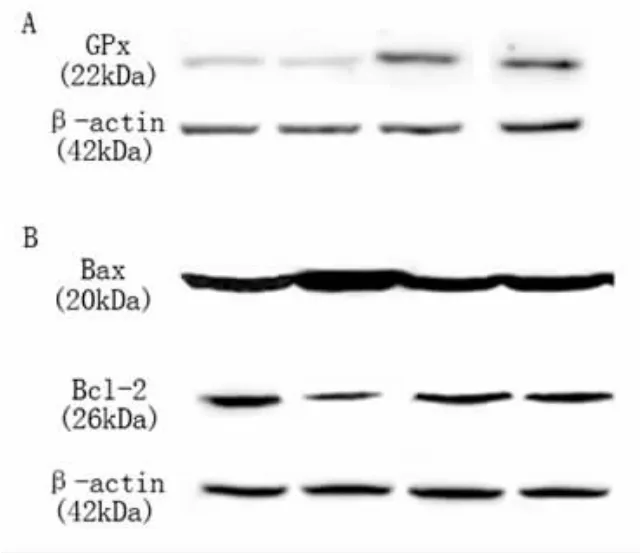
图4 western blot 分析GSH-Px 和Bax/Bcl-2 蛋白表达
3 讨论
顺铂诱导的耳毒性临床表现为双侧对称性、进行性、剂量依赖性的感音神经性听力损失[8]。笔者在该项研究中使用了ABR 测试来显示在耳蜗中产生的功能损伤。该测试在第1 天和第6 天对所有大鼠进行了两次测试。在所有频率下,顺铂组小鼠的ABR 阈值均明显高于其他三组。这表明顺铂具有耳毒性作用,可在所有研究频率下引起听力损失。
由于耳毒性是限制顺铂在临床使用的不良反应之一,因此有研究报道了多种药物的潜在耳保护作用。理想的耳保护剂必须提供可靠的保护,同时又不损害顺铂的抗肿瘤作用。在这种情况下,引起最大关注的试剂是消除ROS 的抗氧化剂。α-硫辛酸(ALA) 是一种衍生自辛酸的有机硫酸盐化合物,被认为是最有效的细胞抗氧化剂之一。ALA 可以还原为二氢硫辛酸,是活性氧(ROS)的强抗氧化剂[9,10]。因其强大的抗氧化性能,笔者调查了α-硫辛酸(ALA)的耳保护作用。通过试验发现ALA 本身对耳蜗细胞不会产生负面作用即无耳毒性。
顺铂诱导的耳毒性作用表现之一为外毛细胞受损。内耳中对顺铂最敏感的结构是毛细胞。耳蜗基部转弯中的外毛细胞是受影响最大的细胞。细胞内ROS 的过度积累已被认为是顺铂诱导的细胞凋亡最强触发因素[11]。在外源性顺铂刺激下,ROS快速释放并在耳蜗毛细胞过度蓄积,氧化应激程度超出耳蜗毛细胞抗氧化能力,进而造成毛细胞DNA 的氧化损伤。DNA 损伤后能够产生大量嘌呤羟基化、嘧啶羟基化的碱基修饰产物,在目前的各种碱基修饰产物,8-羟基脱氧鸟苷 (8-hydroxy-2 deoxyguanosine,8-OHdG) 是一种公认的能够反映DNA 氧化损伤的标志物[12,13]。笔者对8-OHdG 免疫组化的结果表明,在顺铂组小鼠的外毛细胞中有明显的8-OHdG 免疫阳性,而硫辛酸+顺铂组少量表达8-OHdG。
在细胞抗氧化剂系统中,谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px) 催化还原型谷胱甘肽(GSH)与过氧化氢等氧化阴离子发生还原反应,导致细胞内ROS 减少,即GSH 被GSH-Px 氧化为氧化型谷胱甘肽(GSSG),阻断ROS 细胞类脂过氧化[14,15]。有报道显示,ALA 参与了谷胱甘肽的氧化和还原,通过帮助将GSSG 还原为GSH,维持了细胞内GSH 的水平,使其可用作GSH-Px 的底物,将过氧化氢还原为水[16]。在该项研究中,发现ALA治疗干预后的小鼠耳蜗内GSH-Px 表达被ALA 高度上调。而且既往的研究表明,GSH-Px 影响抗凋亡Bcl-2 的表达及其活性,所以在保护小鼠耳蜗细胞免受ROS 诱导的凋亡细胞死亡中起着重要作用。GSH-Px 过表达通过增加Bcl-2 表达并降低Bax 表达来有效抑制凋亡信号转导[17,18]。该研究同样也发现使用ALA 后,较顺铂组小鼠,硫辛酸+顺铂组出现Bcl-2 表达上调、Bax 表达下调。因此,ALA 通过有效上调GSH-Px,继而影响Bcl-2/Bax 凋亡信号通路。Bcl-2/Bax 信号通路中,Bcl-2 抑制细胞凋亡,Bax 促进细胞凋亡。
该研究结果显示,ALA 对顺铂诱导的耳毒性具有较强的缓解作用,从而最终防止了硫辛酸+顺铂组小鼠的重大听力损失。笔者采用8-OHdG 染色从免疫组化的角度揭示氧化性DNA 损伤是顺铂导致耳毒性的机制之一,并且发现ALA 通过支持GSHPx 活性来恢复氧化还原系统对抗氧化应激损伤。
