Gremlin 与肿瘤关系的研究进展△
2021-04-01张鸿雁王建尧王斌
张鸿雁,王建尧,王斌#
1中国医科大学研究生院,沈阳 110122
2深圳市儿童医院普外二科,广东 深圳 518026
Gremlin是一种能够编码184个氨基酸、富含半胱氨酸的新基因,在健康大鼠的成纤维细胞中呈高表达,但在肿瘤基因转化的细胞中,其表达却受到抑制,因此,将其命名为“DRM”,即down-regulated in v-mos-transformed cells。DRM蛋白与大鼠和人类DAN基因产物具有显著的序列同源性,这些序列具有抑制肿瘤生长的活性,并且DRM的表达具有组织特异性,在大鼠的大脑、脾脏、肾脏和睾丸中的表达水平高,在心脏、肝脏和骨骼肌中的表达水平低或不表达。1998年,Hsu等首次从非洲爪蟾的神经嵴中分离出Gremlin基因,发现小鸡、大鼠和人类的Gremlin基因同源,与非洲爪蟾的Gremlin基因共享80%的氨基酸序列。与Cerberus和DAN类似,Gremlin通过拮抗转化生长因子-β(transforming growth factor-beta,TGF-β)亚家族配体的活性从而调节生长发育过程。研究发现,Gremlin基因即IHG-2定位于人类染色体的15q13~q15;高糖环境下,Gremlin于系膜细胞呈高表达;与大鼠DRM基因的表达部位略有不同,在神经元、星形胶质细胞、成纤维细胞以及大脑、卵巢、小肠和结肠等组织中能够检测到人Gremlin基因的存在。Gremlin编码的蛋白有3种形式,分别为 Gremlin1(GREM1)、Gremlin2(GREM2)和Gremlin3。Gremlin主要以分泌型和细胞相关型两种形式存在于内质网、高尔基体和细胞外表面,其C端包含一个高度保守富含半胱氨酸的重复区域,称为半胱氨酸结,被TGF-β超家族、血小板源生长因子、神经生长因子和一些其他分泌蛋白所共享;N端包含多个潜在的糖基化和磷酸化修饰位点。Gremlin是骨形态发生蛋白(bone morphogenetic protein,BMP)的内源性拮抗剂,而BMP是TGF-β超家族中的一类多功能细胞因子,是哺乳动物体内最大的TGF-β亚家族,在不同类型细胞中参与细胞的增殖、分化和迁移等过程。Gremlin可以通过非共价键连接于细胞表面或游离于细胞外间质,与BMP-2、BMP-4和BMP-7特异性结合,形成异源二聚体,从而抑制BMP与其受体结合,阻断下游信号通路,产生拮抗作用,参与肢体生长发育、软骨形成、器官纤维化、血管生成等过程。
1 Gremlin 与恶性肿瘤的发生、发展
1.1 Gremlin与乳腺癌
乳腺癌是女性高发恶性肿瘤之一,尽管手术、化疗和激素治疗是大部分乳腺癌的主要治疗方法,但考虑到术后复发、转移和药物不良反应以及三阴性乳腺癌和其他类型乳腺癌的预后不良等因素,仍有必要寻找乳腺癌的有效治疗靶点。研究发现,人类15号染色体q14区域含有一个可能与转移性乳腺癌相关的抑癌基因,而Gremlin基因定位于人类染色体的15q13~q15,提示Gremlin可能与乳腺癌有关。有研究对Gremlin与乳腺癌的关系进行了研究,结果显示,GREM1和BMP之间潜在的、复杂的相互作用与乳腺癌表型(如ER阴性和HER2阳性)有关,这可能会影响乳腺癌细胞的生长、侵袭和迁移,进而影响预后。Neckmann等通过对小鼠模型及数据库中人乳腺癌组织中GREM1基因与乳腺癌相关基因的表达及预后情况分析发现,GREM1高表达与ER阴性乳腺癌患者的无复发生存率降低有关。Mohamad等研究发现,三阴性乳腺癌中GREM1的过表达与预后不良有关,而其表达水平的降低则与肿瘤的延迟进展有关。研究显示,GREM1高表达与乳腺癌(尤其是ER阴性乳腺癌)患者的预后不良有关,敲除GREM1可抑制乳腺癌细胞的增殖,而GREM1的高表达则会增强乳腺癌细胞的活力,促进其生长与侵袭。
上皮-间充质转化(epithelial-mesenchymal transition,EMT)被认为是乳腺癌发生转移的一个重要因素,基于Gremlin在纤维化疾病发生EMT的过程中发挥着重要作用。Sung等验证了Gremlin作为EMT诱导剂在人乳腺癌细胞中的作用,即通过EMT促进乳腺癌细胞的迁移。在器官纤维化疾病中,多项研究发现,Gremlin通过拮抗BMP从而参与器官纤维化过程;不同于纤维化疾病中Gremlin与BMP之间的相互拮抗作用,在乳腺癌组织中可以同时检测出GREM1和BMP-4高表达,提示二者可能存在协同作用,这可能与BMP对肿瘤的双重作用相关,也可能提示Gremlin通过BMP非依赖性途径参与肿瘤进展,但具体机制仍需进一步研究阐明。另外,目前,GREM1的来源尚未完全明确,在乳腺癌患者的活检组织中仅有6%的乳腺癌组织中GREM1的表达水平升高。Ren等研究发现,GREM1表达于肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF),并且其通过与肿瘤细胞相互作用促进肿瘤细胞的侵袭。此外,Neckmann等的研究认为GREM1可能来自肿瘤细胞本身,也可能来自浸润肿瘤的细胞。
1.2 Gremlin与肺癌
Gremlin在胚胎正常气道和肺循环的发育中起着重要作用,在健康人的肺上皮细胞中可以被检测到,可能起到维持上皮完整性的作用。研究表明,Gremlin参与肺部纤维化疾病的发生与发展,如肺动脉高压、特发性肺纤维化。近年来,Gremlin在肺癌的发生、发展中发挥重要作用。在肺腺癌中,Gremlin的过表达能够促进肿瘤细胞的增殖。Yin等在非小细胞肺癌(non-small cell lung cancer,NSCLC)组织以及晚期NSCLC患者的血浆中检测到了表达上调的Gremlin,并且发现高表达的Gremlin可能能够阻断BMP信号通路;敲除PC-9/GR细胞中的Gremlin可以抑制细胞增殖,促进BMP-7蛋白的表达;另外,Gremlin的表达与NSCLC细胞对吉非替尼的耐药有关,沉默Gremlin基因可以促进吉非替尼介导的细胞凋亡。因此,尽管有少量文献报道Gremlin的高表达与肺癌的发生、发展有关,但Gremlin在不同类型肺癌中的表达情况及相关通路是否存在差异仍需进一步研究。
1.3 Gremlin与食管癌
食管癌是中国居民高发的消化道恶性肿瘤之一,其治疗方法包括手术治疗、放疗、化疗和靶向治疗等。靶向治疗药物具有选择性高、不良反应小等优点,因此,靶向基因治疗对于肿瘤的治疗具有重大意义。Zhang等在研究放疗诱导食管癌细胞发生EMT的过程中发现,随着化疗剂量的增加,食管癌细胞中TGF-β、Chordin和Gremlin的表达上调,BMP-4的表达下调,提示剂量依赖性放疗会诱导食管癌细胞发生EMT,其机制可能与TGF-β信号的激活和BMP通路的阻断有关。研究显示,has-miRNA-203在食管癌中的表达下调,靶基因GREM1在食管癌中的表达上调。Hong等发现Gremlin1在人食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)组织中呈高表达,间充质基质细胞分泌的Gremlin1促进ESCC发生EMT,抑制BMP-4表达,促进TGF-β表达;在CAF中,Gremlin蛋白可能通过肿瘤微环境调节肿瘤细胞的生长和转移。提示Gremlin可能通过BMP信号通路参与食管癌的EMT过程,并有望成为食管癌诊断及治疗的生物标志物。
1.4 Gremlin与胃癌
胃癌是发病率、病死率均较高的消化道恶性肿瘤。有研究发现,Gremlin参与胃癌的进展,并与其预后有关。Ran等发现,GREM2在胃癌中的表达上调;GREM2的沉默抑制了c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路的激活,进而抑制了裸鼠胃癌干细胞(gastric cancer stem cell,GCSC)在体内的成瘤能力和淋巴结转移,以及体外GCSC的增殖、迁移和侵袭,加速GCSC细胞凋亡。
除了GREM2外,在胃癌组织及其邻近正常胃组织中也可检测到部分Gremlin1的表达,且Gremlin1的表达与一些临床病理改变呈负相关。有研究通过免疫组化法检测Gremlin1在胃癌组织中的表达情况,结果显示,与Gremlin1阳性组相比,Gremlin1阴性组的肿瘤浸润深度深,有淋巴结转移,淋巴和静脉侵犯明显增加(P<0.01);Gremlin1阳性组的术后疗效明显优于Gremlin1阴性组(P<0.01),提示Gremlin1阴性与胃癌患者的预后不良有关。另外,Honma等分析了159例胃腺癌患者的临床资料,发现Gremlin1阴性胃腺癌患者的生存率低于Gremlin1阳性胃腺癌患者(P=0.002);单因素和多因素分析结果显示,Gremlin1表达是胃癌患者生存的独立预测因子。
1.5 Gremlin与胰腺癌
胰腺癌是一种高度恶性的消化系统肿瘤,靶点治疗能够提高胰腺癌患者的生存率。多种肿瘤的血管生长因子与肿瘤的转移、侵袭有关。Gremlin是主要促血管生成受体——血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的新型激动剂,结合以上背景,Chen等对GREM1在胰腺神经内分泌瘤(pancreatic neuroendocrine tumor,PNET)中的表达情况进行了检测,结果发现,PNET中GREM1的表达情况与肿瘤相关血管生成有关。Gremlin以单体和共价连接的同型二聚体两种形式存在。单体Gremlin作为VEGFR2的拮抗剂,可以抑制肿瘤生长和血管形成。GREM1在正常胰腺组织中的表达水平较低,主要表达于胰岛细胞。有研究通过体外实验发现,Gremlin1的过表达可以促进胰腺星状细胞的增殖、迁移以及胰腺癌细胞的增殖、侵袭和EMT,并通过Shh信号通路诱导肿瘤的发生与发展。另外,Gremlin1在胰腺癌组织中的过表达与病理分级和淋巴结转移分期有关。
1.6 Gremlin与肝癌
研究发现,Gremlin在肝细胞肝癌(hepatocellular carcinoma,HCC)的进展、肝星状细胞的激活过程中均发挥着重要作用,并参与肝纤维化进程。纤维母细胞分泌的Gremlin可以通过抑制BMP的表达参与HCC的发生、发展。Gremlin在HCC组织中的表达水平较高,与BMP-7的表达水平呈负相关,BMP-7/Smad通路可能参与HCC的发生与进展。经肝动脉化疗栓塞术后表达上调的Gremlin2可能通过抑制BMP信号转导促进肿瘤干细胞富集,从而促进HCC细胞生长。因此,Gremlin可能通过BMP信号通路参与HCC的发生与发展。
1.7 Gremlin与结直肠癌
结直肠癌(colorectal cancer,CRC)是全球范围内常见的恶性肿瘤。近年来,Gremlin在结直肠癌中的作用被发现。Karagiannis等利用数学模型,结合体外细胞迁移实验预测了Gremlin1在肿瘤微环境中的作用,提示Gremlin1能够在体外诱导恶性肿瘤细胞迁移,并可能以BMP-7依赖的方式介导其促癌作用。深入研究发现Gremlin1是由CAF于肿瘤侵袭前缘产生,可能导致BMP信号被抑制和EMT的发生,从而参与肿瘤的形成和局部侵袭。正常结肠黏膜上皮细胞不表达或低表达Gremlin1,而Gremlin1在CRC间质细胞中呈高表达,并且其高表达与低肿瘤分期有关,提示Gremlin1是CRC患者预后良好的标志物。此外,沉默Gremlin1可能通过阻断BMP/Smad通路和VEGF非依赖性途径抑制CRC细胞的增殖、迁移、血管生成和EMT,参与CRC的发生、发展。Gremlin基因是结直肠癌的潜在靶点。
1.8 Gremlin与生殖系统肿瘤
除了乳腺癌、肺癌和消化系统肿瘤外,在胚胎卵巢、卵泡发育、不孕症和妇科肿瘤等方面,亦有关于Gremlin1、Gremlin2表达情况的研究。2006年,Namkoong等发现Gremlin1在宫颈癌中过表达,过表达的Gremlin1通过与YWHAH蛋白相互作用参与宫颈癌的发生。Sato等研究发现,Gremlin1的高表达与肿瘤体积大(肿瘤直径>4 cm)有关;在宫颈癌中,其可能在临床复发和维持肿瘤干细胞(cancer stem cell,CSC)特性方面具有重要作用。有研究通过基因微阵列分析发现,Gremlin2在子宫内膜癌组织中的表达下调,并认为Gremlin2可能通过抑制肿瘤细胞的生长参与子宫内膜癌的发生与发展。此外,虽有学者发现Gremlin1在卵巢癌中呈高表达,但相关的机制研究尚未见报道,仍需要科研工作者进一步探索。
1.9 Gremlin与其他肿瘤
研究发现,Gremlin在恶性间皮瘤中过表达,恶性间皮瘤细胞产生高表达的Gremlin1,通过转录因子Slug的调控及与肌原纤维蛋白2结合作用于肿瘤微环境,调控间皮瘤细胞的存活状态,并且通过诱导上皮细胞-间充质表型转化和促进肿瘤血管形成从而驱动恶性间皮瘤细胞的侵袭和转移。在垂体瘤中,Gremlin是肿瘤血管生成的重要因素。在胶质瘤中,敲除GREM1会降低细胞活力,抑制细胞的迁移、侵袭及EMT过程,阻断TGF-β1介导的Smad通路,促进胶质瘤的发生、发展。在肾透明细胞癌中,GREM1启动子Ⅲ区的甲基化与肿瘤的恶性程度及血管生成活性有关。此外,在分化差、有淋巴结转移、存在周围组织和器官侵犯或TNM分期为Ⅲ~Ⅳ期的胆管癌中,Gremlin1的阳性表达率明显升高,提示Gremlin1的阳性表达与胆管癌患者的预后不良有关。Gremlin参与多种肿瘤的发生、发展,且与疾病预后有关,研究其在不同恶性肿瘤中的表达情况及作用机制将有助于对肿瘤的诊断、治疗和预后预测。(表1)
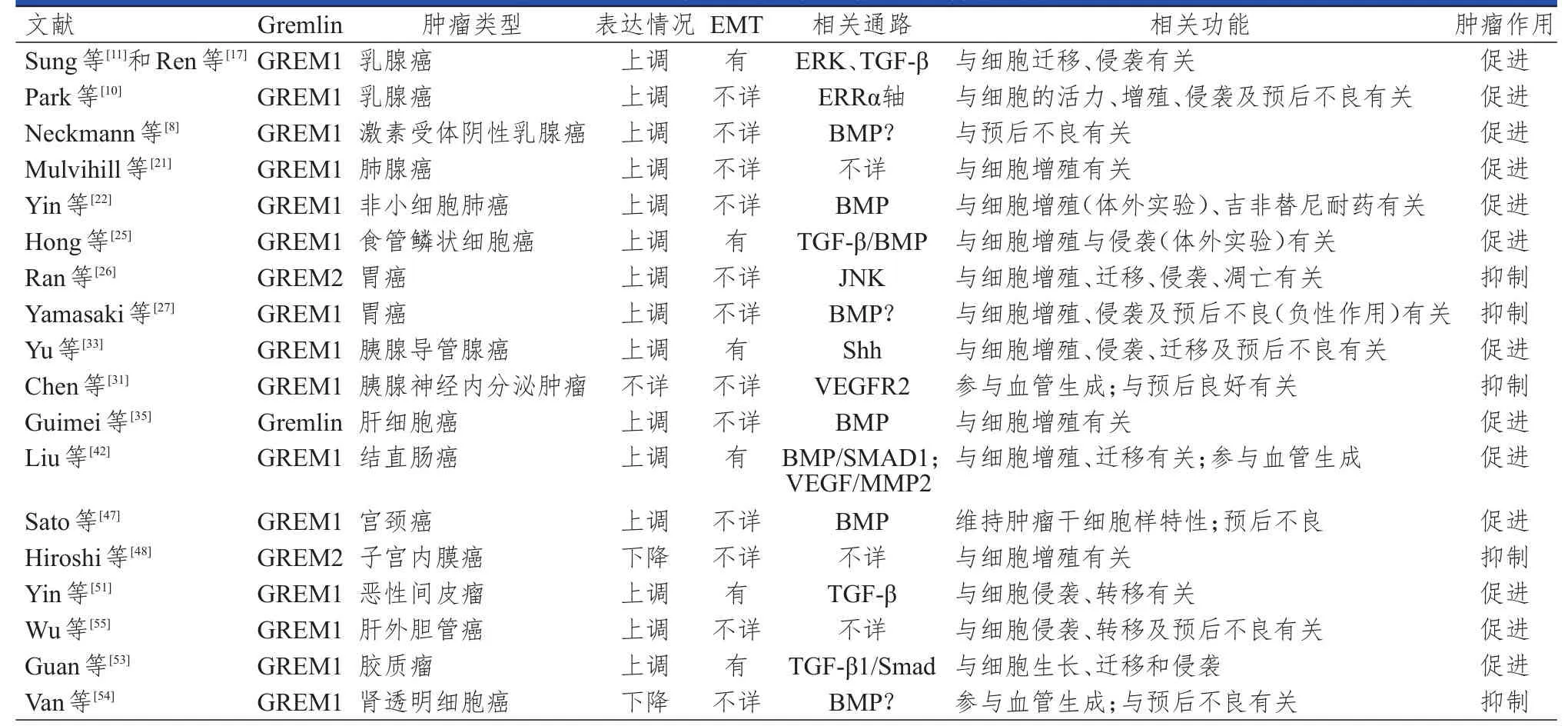
表1 GREM在不同恶性肿瘤中的功能特征
2 小结与展望
Gremlin是一种高度保守的分泌型糖蛋白,可于血清中被检测到,其异常表达与肿瘤的发生、发展及器官纤维化有关,对肿瘤的复发及预后具有一定的评估价值。但Gremlin对肿瘤细胞的作用一直存在争议,大多数人认为Gremlin的表达具有组织特异性:Gremlin基因在肺、乳腺、胃等器官中的过表达可能会促进肿瘤的生长,相反,其在肾等器官中表达的下调可能会抑制肿瘤的生长。Gremlin的预后意义存在差异可能与肿瘤类型、肿瘤分期等因素有关。另外,Gremlin的来源尚不能确定,虽有大量文献显示肿瘤性疾病中的Gremlin由CAF或肿瘤细胞产生,但上皮细胞等其他类型细胞是否能分泌Gremlin仍需要进一步明确。Gremlin甲基化与多种恶性肿瘤的发展有关,可能通过影响细胞周期和BMP通路发挥致癌作用,但Gremlin基因在恶性组织中的作用很复杂,具体作用机制仍需进一步深入研究。
