全自动电位滴定法测定锂电池原料碳酸锂中主成分的含量
2021-03-31欧阳志勇邓飞跃
邓 蓓 欧阳志勇 邓飞跃
(1.江西省锂电产品质量监督检验中心,江西 宜春,336000;2.中南大学化学与化工学院,长沙,410000)
前言
锂离子电池具有比能量大、工作电压高、循环寿命长、安全性能好、自放电小、质量轻和环境友好等优点[1]。近几年来,随着新能源技术的发展,锂电池的日益普及及其在新能源电动汽车、电子数码产品[2-3]等领域的应用,碳酸锂作为锂电池的重要基础原料[4],电池级碳酸锂的需求量日益增加[5-6]。因此,在锂电行业,对碳酸锂含量的测定提出了更高更精的要求。
目前,测定碳酸根的方法一般采用手动滴定双指示剂法[7]和国家标准“GBT 11064.1—2013”分析方法中的酸碱滴定法[8],因人为因素引起的滴定体积读数误差、滴定终点颜色变化不明显且需要返滴定等缺点[9],在日常检测中往往不能满足准确度和精密度的要求[10]。而采用全自动电位滴定法,滴定体积是数显的,且可以精确到0.000 1 mL,大大提高了滴定体积的准确性,很好地解决了体积读数误差和终点指示问题等人为因素的干扰[11]。并且,电位滴定仪测定碳酸锂含量过程中不需要加热煮沸溶液以驱除二氧化碳,冷却再继续滴定[7]的返滴定过程,这样节省了时间和资源,同时全自动电位滴定法测定范围宽,分析精度更高。
1 实验部分
1.1 主要仪器与试剂
除非另有说明,实验用水均为二次水再煮沸10 min 以驱尽游离CO2后冷却。
Metrohm916型电位滴定仪(瑞士万通公司),pH水相电极;MS205DU十万分之一天平(梅特勒-托利多有限公司)。
盐酸标准滴定溶液(cHCl=0.1 mol/L),优级纯无水碳酸钠,优级纯浓盐酸。
HCl标准溶液配制:用10 mL移液管移取8.5 mL浓盐酸(GR,ρ=1.19 g/mL),倒入1 000 mL容量瓶中,加水稀释至刻度,混均。
HCl标准溶液标定:将基准无水碳酸钠在250 ℃下烘干2 h,然后放入干燥器内备用。称取基准无水碳酸钠约0.15 g(精确至0.000 01 g)3份于200 mL烧杯中,加入50 mL水溶解,超声50 s。将电位滴定仪的电极插入此溶液中,按开始键进行标定。
按照电位滴定仪预设的程序用盐酸溶液滴定。滴定结束后读取曲线的等当点Ep2。随同标定做空白实验。
盐酸标准滴定溶液的实际浓度按式(1)计算,结果保留至小数点后4位,此结果为盐酸标准滴定溶液的浓度:
(1)
式中:
cHCl——盐酸标准滴定溶液的实际浓度,mol/L;
mNa2CO3——碳酸钠的质量,g;
MNa2CO3——碳酸钠的摩尔质量,g/mol;
Ep2——滴定碳酸钠消耗的盐酸标准滴定溶液的体积,mL;
Epb——滴定空白溶液消耗的盐酸标准滴定溶液的体积,mL。
1.2 实验方法
将碳酸锂试样在250~260 ℃下烘干2 h,然后放入干燥器内,冷却至室温,备用。
准确称取 0.10 g(精确至0.000 01 g)碳酸锂试样于200 mL 烧杯中,加入50 mL水溶解样品,超声50 s,用全自动电位滴定仪滴定,记录滴定溶液体积Ep2,随同试样做空白实验。
碳酸锂的含量以碳酸锂的质量分数ωLi2CO3计,数值以%表示,按式(2)计算:
(2)
式中:
ωLi2CO3——碳酸锂的含量,%;
cHCl——盐酸标准滴定溶液的实际浓度,mol/L;
mLi2CO3——碳酸锂的质量,g;
MLi2CO3——碳酸锂的摩尔质量,g/mol;
Ep2——滴定碳酸钠消耗的盐酸标准滴定溶液的体积,mL;
Epb——滴定空白溶液消耗的盐酸标准滴定溶液的体积,mL;
2 结果与讨论
全自动电位滴定仪在动态滴定模式下,为了找到仪器的最佳工作状态,分别对仪器的滴定速度和开始平衡体积等进行了实验。同时,结合仪器的灵敏度和稳定性最佳匹配,使滴定时间小于200 s,对滴定液以及称样量进行了实验。
2.1 仪器的测定条件
2.1.1 滴定速度
考察了高、中、低不同滴定速度对测定结果的影响,结果发现,在三种滴定速度下的检测结果相差不大,同时实验观察发现:在滴定仪采用动态滴定模式时,滴定仪会根据接收到的测量值自动调整滴定速度,滴定初始和等当点附近会自动减小滴定剂添加量和滴定速度。
因此为了节约时间和减小空气中二氧化碳带入量给结果带来的影响,宜选用最大加液速度。同样的道理,吸液速度也应选用最大吸液速度。
2.1.2 开始平衡体积
根据理论计算的滴定体积,考察了三个不同开始平衡体积对测定结果的影响(如表1),由表1可知:开始平衡体积在5 mL的时候,测定值较标准值略大,分析原因是较小的平衡体积延长了滴定时间,增加了空气中二氧化碳的带入量,因此使测定值略偏大;当开始平衡体积在15 mL的时候,仪器则检测不到第一个等当点,测定值也发生了较大的偏差。所以,开始平衡体积设定在第二个等当点Ep2的1/3处测定结果较佳,这样不仅节约了滴定时间,而且两个等当点都可以同时呈现。

表1 平衡体积实验Table 1 Tests of equation consistency
2.1.3 滴定仪最佳工作参数
根据检测样品的含量及检测结果的准确性和精密度,同时结合仪器灵敏度和稳定性,确定了仪器较佳的工作参数,如表2所示,按实验方法对样品进行测定,滴定曲线见图1。
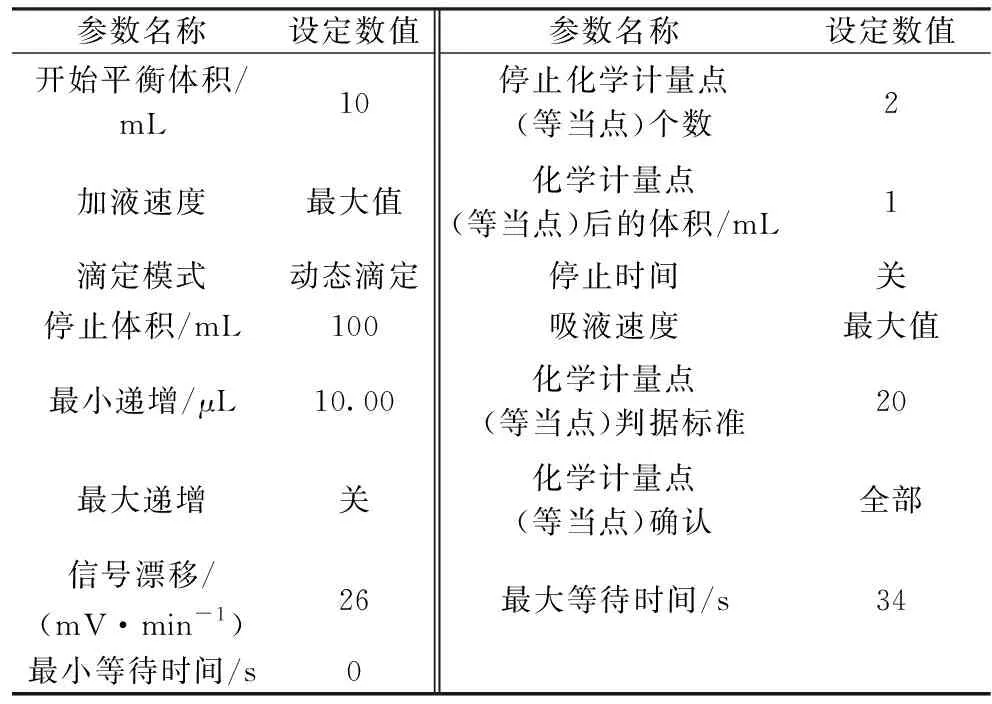
表2 仪器最佳工作参数Table 2 Optimized instrument operating paramenters

Ep1—第一个等当点;Ep2—第二个等当点图1 电位随滴定体积变化曲线Figure 1 Titration curve.
2.2 滴定液浓度和称样量实验
实验初期采用浓度为0.1 mol/L的盐酸滴定,分别称取0.3 g(精确至0.000 01 g)和0.5 g(精确至0.000 01 g)的样品进行滴定。实验过程中发现,由于滴定浓度较低导致滴定体积过大,延长滴定时间,增加空气中二氧化碳的带入量,从而使测定结果不理想。后来,采用浓度为0.3 mol/L的盐酸滴定,滴定液浓度过高,误差增大,从而导致重复性和准确度变差;通过多次实验比较不同浓度的滴定液和样品称样量,结合仪器的工作状态以及从环保的要求出发,最后确定滴定液的浓度为0.1 mol/L,称样量为0.10 g(精确至0.000 01 g)为较佳。
2.3 精密度实验
选取2个不同品位的产品,按照设定的实验方法对样品中的碳酸锂含量分别进行11次平行测定。得到11个测定值,计算其平均值、标准偏差及相对标准偏差,结果见表3,结果证明精密度满足分析要求。

表3 方法精密度实验结果Table 3 Precision tests of the method(n=11) /%
2.4 加标回收实验
由于目前还没有相应的碳酸锂标准样品,所以采取在样品中加入基准无水碳酸钠的方法进行加标回收实验,通过测定其中碳酸根的物质的量来间接进行加标回收实验。对选定1#样品进行加标回收实验,所得碳酸根含量n1需要乘以质量分数0.998 3进行加标回收:1)准确称取0.10 g(精确至0.000 01 g)碳酸锂试样m1;2)计算碳酸锂中的碳酸根的物质的量n1;3)Na2CO3加入量为加入的基准无水碳酸钠的质量m2;4)碳酸根加入量为加入基准无水碳酸钠中所含有的碳酸根的理论物质的量n2;5)测定碳酸根总量为自动滴定仪滴定出的碳酸锂和碳酸钠混合物中碳酸根的总物质的量n;6)计算加标回收率η。按照选定的实验方法进行加标回收实验,结果见表4,计算公式按式(3)~(7)。结果显示加标回收率范围在99.4%~100%,在合理的范围内,结果准确可靠。
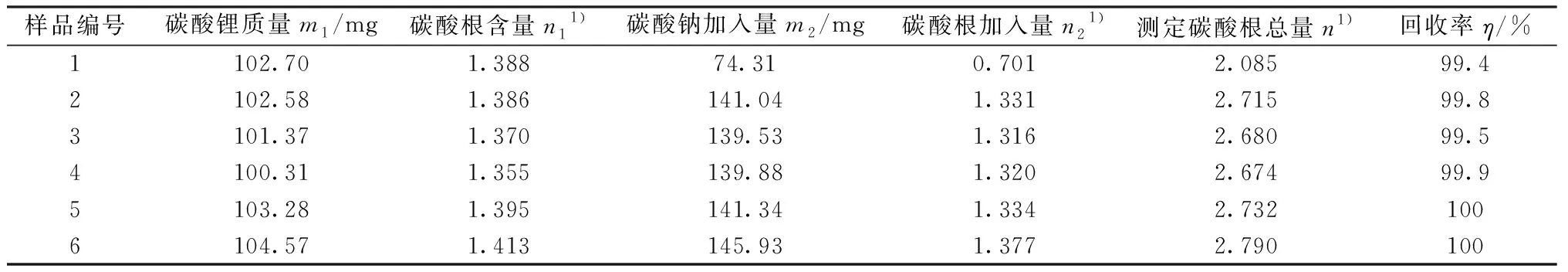
表4 碳酸根的加标回收实验Table 4 Recovery tests for carbonate ions
2.5 方法比对
全自动电位滴定法和双指示剂滴定法的实验结果比对见表5,两种方法的实验结果相差不大,但由于双指示剂滴定法的滴定体积读取精度不高、终点变化不敏锐和需要返滴定等缺点,在实际检测应用中往往满足不了准确度和精密度的需求。而采用全自动电位滴定法能够自动读取滴定体积以及依靠电位变化自动判断终点,消除人为和环境对终点颜色变化的影响,大大提高了读数的准确性,减少读数误差。

表5 测定碳酸锂中的主成分含量Table 5 Determination of the main components in lithium carbonate /%
在实验过程中,从是否需要返滴定和样品需求量等方面对比了自动电位滴定法和双指示剂滴定法,具体对比结果见表6。

表6 两种方法对比Table 6 Comparison of two methods
由表6可知,全自动电位滴定法不仅测定结果可靠、精密度更高,而且对环境更友好、节约资源。因此,不管是从结果准确性还是从效率上来看,全自动电位滴定法都更胜一筹。
3 结论
用全自动电位滴定仪,以盐酸标准溶液为滴定剂,测定锂电池原料碳酸锂中碳酸锂含量,方法较国家标准GBT 11064.1—2013分析方法中酸碱滴定法,电位滴定法方便、快捷,同时该方法测定结果准确、可靠、精密度高,适合大批量样品快速分析。
