枸杞岛海域表层水真菌群落多样性研究
2021-03-31肖劲洲王永杰
王 雪,肖劲洲,王永杰,2*
(1.上海海洋大学 食品学院,上海 201306; 2.农业农村部水产品质量安全贮藏保鲜风险评估实验室(上海),上海 201306)
真菌在生态系统中占据着重要的地位,其通过参与食物链和食物网中营养物质的生产与运输,深刻地影响并塑造着全球的生态系统[1]。有关真菌的研究相对起步较晚,尤其是水生真菌。随着高通量测序技术的发展,很多研究揭示了真菌大量存在于多种水生环境中,包括各种海洋栖息地[2]。Taylor等[3]对英国普利茅斯近海区域六年以来的真菌分布特征进行了研究,Gutiérrez等[4]在智利中部通过设立近岸远岸梯度研究了盐度对真菌造成的影响。Xu等[5]则研究了太平洋底部沉积物的真菌群落组成和多样性。还有一些研究将重点放在海洋浮木上腐生的真菌[6]以及与藻类共生的真菌[7]上。目前,对真菌的群落组成和多样性的相关研究逐步增加,但有关真菌在生态系统中的重要作用和功能的研究依旧很少[8]。已发现的真菌基本都是异养生物,不过这些真菌有很多不同的生活方式,包括腐生、互利共生、寄生[9]。有研究表明,真菌可能通过与其他生物和有机物质的共生-腐生作用,在很大程度上影响水生环境食物网的结构、稳定性和功能性[10]。然而,大多数水生生态系统中,对于真菌与其他物质间的相互作用是如何影响生态系统的重要功能,如海洋生物碳泵的效率和生态系统的健康,仍然知之甚少[11]。枸杞岛位于长江口东南侧外海、浙江省嵊泗县马鞍列岛东部海域[12]。枸杞岛贻贝养殖场属于省级万亩贻贝养殖示范区,大量的贻贝养殖架为周围海洋环境中的藻类生长提供了依附基质,使得枸杞岛周边海域适合藻类生长[13]。目前对于枸杞岛的研究主要集中在对周围海域藻类群落的结构分布[14]、生长特性的相关研究[15]以及贻贝养殖对水体环境造成的影响[16],对于真菌群落分布组成的研究还处于未知状态。本研究应用高通量测序方法对枸杞岛环岛表层海水真菌多样性进行了研究,分析了真菌群落组成和多样性特征,并探讨了真菌潜在功能群分析。相关结果丰富了枸杞岛水域微生物生态学研究,并为海水微生物资源的开发与利用,海洋环境保护提供参考。
1 材料与方法
1.1 材料
1.1.1 采样设计与样品采集 在浙江省舟山市枸杞岛(122°46′1.64″E, 30°43′3.25″N)海域设计8个采样站点,于水温约30 ℃时采集距离表层8 m以内海水水样用于真菌群落组成多样性的后续研究。将采集的表层水体放入500 mL的聚丙烯塑料瓶中,立刻装入盛有冰袋的保温箱中,迅速转移至实验室。上述水样通过0.45 μm聚碳酸酯滤膜(Millipore,美国)过滤,在滤膜上富集微生物,-80 ℃保存滤膜,备用。
1.1.2 试剂与仪器 FastDNA® SPIN Kit for Soil试剂盒(MP Biomedicals,美国);500 mL 无菌采样瓶(辛森化学科技有限公司,上海);保温箱(Esky,澳大利亚),冰袋(生工生物,上海);便携式 pH 计(SX-620,上海三信仪表厂);电导率仪(SX-763,上海三信仪表厂);手持式 GPS(Magellan,美国)及定深采水器;-80 ℃超低温保存箱(DW-86L626,青岛海尔);小型台式离心机(S430,德国Eppendorf);PCR 仪(Mastercyscler®nexus gradient, 德国Eppendorf);微量紫外分光光度计(NanoDrop ND-1000,美国Thermo Fisher Scientific);核酸电泳系统(包括电泳仪及电泳槽(Sub-Cell GT,美国Bio-Rad));DocTMXR+Molecular imager®凝胶成像分析系统(Bio-Rad,美国);涡旋振荡仪(Thermo Mixer®, 德国Eppendorf);电子天平;一次性灭菌注射器;0.45 μm聚碳酸酯滤膜(Millipore,美国);RNA-DNA free EP 管(AXYGEN,美国);无 RNA 及 DNA 酶的移液枪头(生工生物,上海);纸质冻存盒;称量纸。
1.2 方法
1.2.1 水体DNA提取 滤膜上海水总微生物DNA的提取:滤膜经-80 ℃冷冻后,使用无菌手术剪破碎并使用FastDNA®SPIN Kit for Soil提取,按说明书加入相应试剂,最后采用100 μL DES溶液洗脱微生物总DNA并于-20 ℃保存。海水微生物总DNA的浓度及质量分别通过微量紫外分光光度计及琼脂糖凝胶电泳检测。
1.2.2 ITS序列的扩增测序 正向引物ITS1F(5′-CTTGGTCATTAGAGGAGATAA-3′)和反向引物ITS2R(5′-GCTGCGTCTTCGATGC-3′)[17]对真菌ITS1区域进行PCR扩增。PCR扩增结束后,用2%琼脂糖凝胶电泳进行产物验证。将上述 PCR扩增产物进行产物纯化和均一化,利用双末端测序(Paired-End)的方法,构建成小片段测序文库,建好的文库先进行文库质检,质检合格的文库于 Illumina Miseq平台进行测序。高通量测序由上海美吉生物医药科技有限公司完成。
1.2.3 测序数据处理 真菌ITS序列分析在QIIME[18]中进行。去除barcode、引物和低质量序列(<200 bp)后,使用UCHIME算法检测并去除嵌合体序列[19]。操作分类单元(OTU)使用UPARSE[20]在97%的相似性水平下通过聚类生成。通过在UNITE数据库中进行BLAST比较,确定OTU物种信息。
1.2.4 生物信息学分析 使用QIIME软件计算真菌稀释曲线,并分别对每个样本计算Sobs指数、Chao指数、Shannon指数、Simpson指数、Simpsoneven指数、Shannoneven指数等α多样性指数。根据 OTU 划分和分类地位鉴定结果,使用 QIIME 软件获得每个样本在各分类水平的群落组成。R(版本3.6.1)中vegan程辑包用来进行主坐标成分分析(PCoA),以30 ℃下采集的8个环洋山港样品作为对照评价枸杞岛真菌群落的稳定性。利用 FUNGuild v1.0将枸杞岛表层水体真菌划分为不同的营养型和功能群,结果数据保留置信度为“很可能”(Probable)和“极可能”(Highly probable)的OTUs及其类别。所有鉴定为复合营养型的群落均归入“其他真菌”(Other fungi),鉴定为复合多功能的群落分别统一为“其他腐生/病理真菌”(Other saprotrophic/pathogenic fungi)[21]。
1.2.5 系统发育分析 根据OTU序列在NCBI nr 数据库比对结果获得相似度在97%~100%的序列并去除冗余序列,加入同一属其他种的代表序列,且用其他属序列作为外群。利用最大似然法(Maximum Likely-hood,ML)以JC(JUkes-Cantor)模式构建系统发育树(Bootstrap=1 000)。
2 结果与分析
2.1 枸杞岛环岛样品真菌多样性
对枸杞岛8个环岛表层水样品ITS1区域测序,经过优化过滤低质量序列,8个样品共获得242 024条序列。所有样本的稀释曲线(图1)趋于平缓,表明测序深度合理,序列信息可以代表枸杞岛真菌群落信息。Shannon指数和Simpson指数用以衡量真菌多样性,Sobs指数和Chao指数用来评估真菌丰度,Simpsoneven指数、Shannoneven指数用以反映真菌均匀度。从α多样性指数(表1)来看,枸杞岛环岛样品的多样性、丰度、均匀度基本一致。
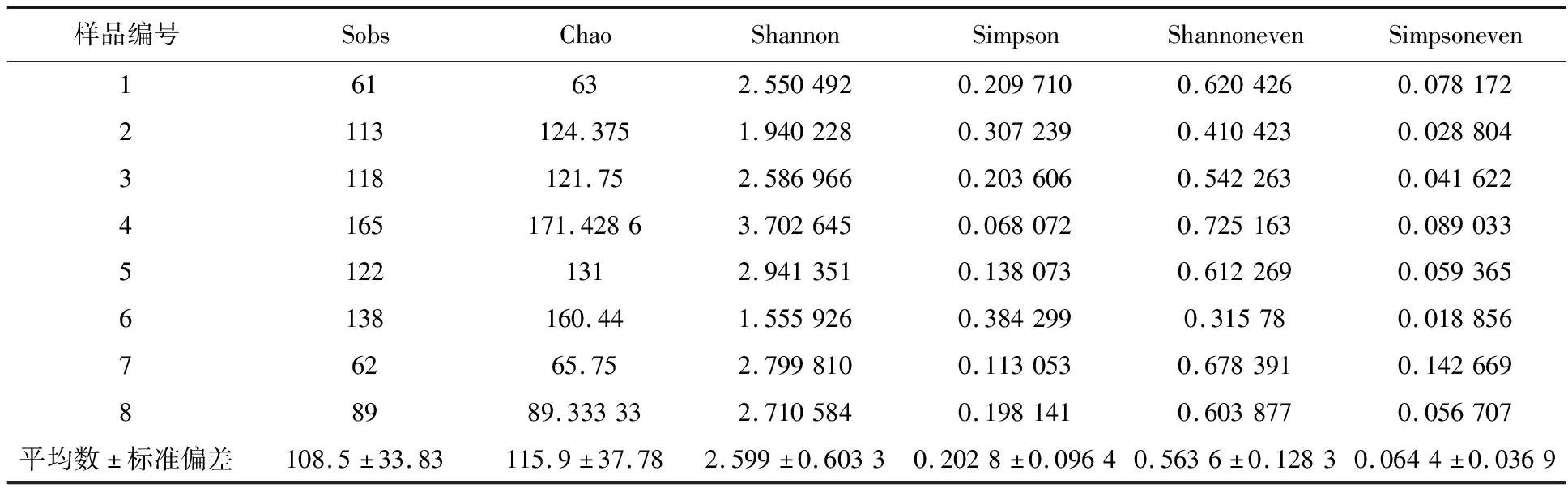
表1 枸杞岛真菌α多样性指数

图1 枸杞岛真菌群落稀释曲线
为了进一步确认枸杞岛周围水域的真菌组成是否稳定,将洋山港在同一温度下采集的样品作为参照与枸杞岛样品进行主坐标成分分析(PCoA)(图2)。样品根据地点的不同完全分开,且同一地点的样品聚集在一起,说明在枸杞岛周边水域的真菌群落组成基本相似,且与洋山港真菌组成差别很大。

图2 枸杞岛真菌群落稀释曲线
2.2 枸杞岛真菌群落组成与优势OTU系统发育分析
枸杞岛8个样品在97%的相似度下聚类,共获得475个OTUs。所有样品的OTUs序列鉴定属于7门、22纲、51目、95科、158属的真菌物种。在门水平下(图3),枸杞岛表层水体真菌中,子囊菌门(Ascomycota)(56.9%的序列)和担子菌门(Basidiomycota)(11.3%的序列)占据主要地位,约0.3%的真菌序列属于接合菌门(Zygomycota)、聚合菌门(Glomeromycota)、Rozellomycota与壶菌门(Chytridiomycota)只占据非常少的序列(低于0.1%)。座囊菌纲(Dothideomycetes)、散囊菌纲(Eurotiomycetes)、粪壳菌纲(Sordariomycetes)、微球黑粉菌纲(Microbotryomycetes)在枸杞岛真菌群落中占据优势地位(图3)。这些优势菌纲的相对丰度分别为27.2%、17.8%、7.2%和4.9%。在属水平下(图3),丰度前10的优势属包括Hortaea、青霉菌属(Penicillium)、曲霉菌属(Aspergillus)、隐球菌属(Cryptococcus)、链格孢属(Alternaria)、红酵母菌属(Rhodotorula)、红冬孢酵母属(Rhodosporidium)与枝顶孢属(Acremonium)。丰度最高的Hortaea属相对丰度达到16.6%,其次的青霉菌属、曲霉菌属和隐球菌属相对丰度分别为11.4%、6.2%和3.7%。
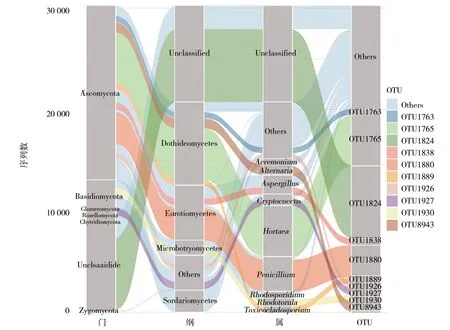
图3 枸杞岛真菌群落在门、优势菌纲、优势菌属、丰度水平前10的OTUs水平下的群落丰度组成
为了进一步了解枸杞岛优势真菌的亲缘关系特点,对占据16.6%序列丰度的OTU1765进行系统发育分析(图4)。根据系统发育树结果,OTU1765基本可以认为属于威尼克外瓶霉。
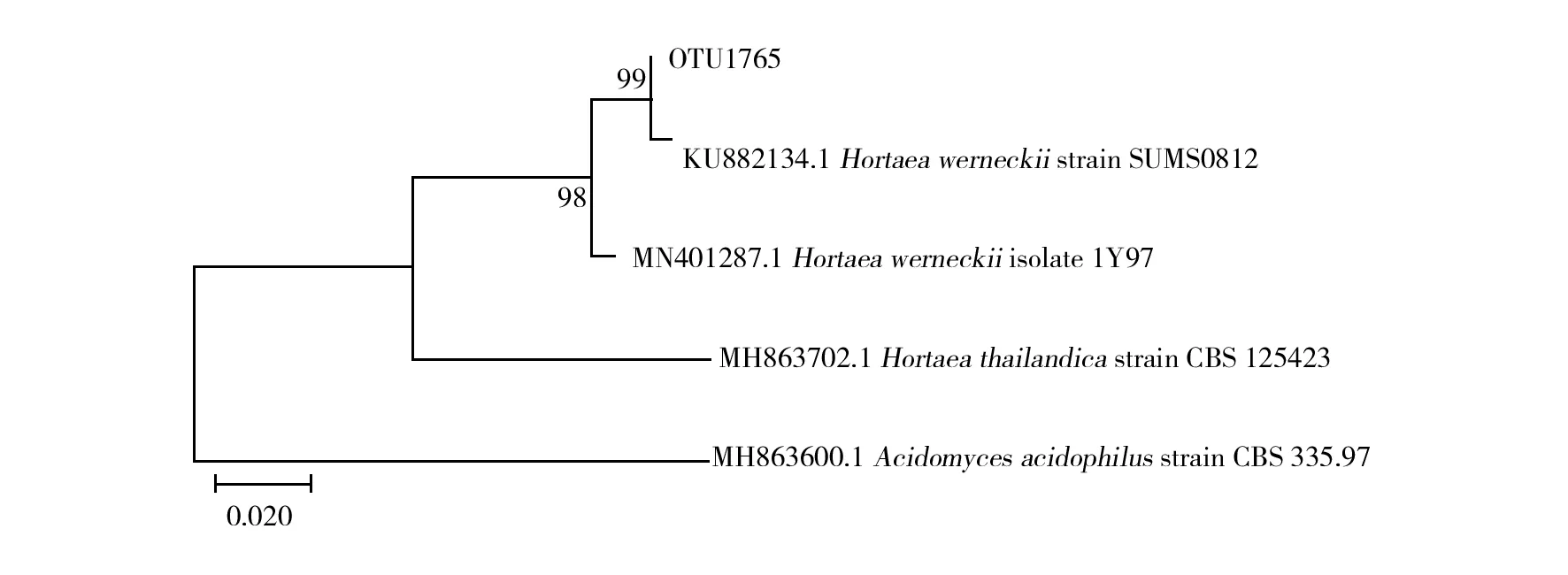
图4 OTU1765基于序列相似度的 ML系统发育树
2.3 枸杞岛真菌群落生态功能群
真菌功能预测将真菌主要划分为14个不同的功能群(图5),属于三种营养类型,病理营养性(Pathotroph)、腐生营养性(Saprotroph)与共生营养性(Symbiotroph)。在枸杞岛样品中,大部分可预测的真菌都属于植物病原菌(Plant Pathogen)和未定义腐生真菌(Undefined Saprotroph Fungi),以及部分属于寄生真菌(Fungal Parasite)和动物病原菌(Animal Pathogen)。

图5 枸杞岛真菌功能预测热图
3 讨 论
枸杞岛环岛表层水8个样品的真菌群落组成和多样性都趋于稳定,且与洋山港样品有明显差异,造成这种差异的主要影响因素可能在于两地水环境的盐度差异(枸杞岛:21‰,洋山港:15‰)。在很多研究中都曾说明盐度是影响真菌组成的重要影响因子之一[22-23]。
8个样本中共聚类出475个OTUs,注释到7门中,其中子囊菌门(Ascomycota)占据最优势地位,担子菌门(Basidiomycota)次之。迄今为止,从海洋环境中鉴定出的绝大多数真菌都属于子囊菌门和担子菌门[24]。无论是在中国近海[25]还是在英国西海峡[3]附近,子囊菌都是近海区域的优势真菌,这也与Jones[26]从海洋生境中分离出的真菌主要隶属于子囊菌纲的研究相一致。担子菌很可能在海洋沉积物深处占据主要地位[27],本研究中担子菌占据第二优势地位的原因很可能是采集的枸杞岛表层水体样品,在样品中只检测到少量的序列属于接合菌门(Zygomycota)这与前人在中国渤海和黄海[28]的研究是一致的。在一些研究中,接合菌门被检测存在于地下水环境中[2]。枸杞岛作为贻贝养殖基地同时也是旅游景点,可能由于生活用水排放到附近海域中,造成了少量接合菌门的存在。在属水平下,一些占据优势地位的真菌属于子囊菌门霉菌(青霉菌属、曲霉菌属)和担子菌门酵母(隐球菌属、红酵母菌属等),这些属的真菌同时也在欧洲附近海域[29]和深海海洋沉积物[27]中被检测到。丰度最高的属Hortaea在海南海口温泉真菌群落中也占据优势地位[30]。
在系统发育分析中,丰度最高的OTU1765属于威尼克外瓶霉真菌。威尼克外瓶霉真菌被认为是一种会导致人患黑癣的病原体。黑癣是一种慢性浅表真菌疾病,一般出现在热带并主要感染年轻人包括儿童,感染途径主要通过病原真菌直接与伤口接触并常常与土壤媒介息息相关[31]。同时,这种真菌所在的属也包含很多植物致病真菌并被广泛认为属于嗜盐菌[32]。此外,很多未鉴定真菌与OTU1765的序列相似度均高于97%。这些未鉴定真菌的来源非常广泛,从环境样品印度洋中部海底沉积物[33]、中国南海附近海域[34]中以及从可可叶[35]和台湾海岸附近的圆叶牡荆[36]等植物上均有检出。说明威尼克外瓶霉真菌可能广泛存在于很多水生环境以及海底沉积物中,同时也可能与很多植物之间存在腐生关系。枸杞岛周围水域为海水环境,适宜威尼克外瓶霉真菌生长,附近的养殖架可能提供了威尼克外瓶霉真菌生长的良好条件。同时,作为旅游景点的枸杞岛居住着很多渔民,生活污水排放可能是这种潜在的人类致病真菌占据主要地位的原因之一。
经过FUNGuild划分的真菌功能特征,大部分真菌被划分为植物病原菌、腐生真菌、真菌寄生虫和动物病原菌。很多真菌被认为是海洋中花粉管、叶子和树木的分解者[37]或感染海洋藻类和动物的病原体[38]。枸杞岛附近海域的贻贝养殖架为藻类生长繁殖提供了良好的条件[13],很多感染藻类和动物的病原真菌可能会因此在附近聚集。
本研究通过扩增高通量测序分析枸杞岛附近海域表层海水的真菌群落组成多样性,发现枸杞岛环岛真菌群落组成及多样性基本保持稳定,与洋山港真菌群落的差异可能主要是由于盐度差异造成的。其中的优势种群是子囊菌门。优势菌纲为座囊菌纲。最大的优势真菌属包括Hortaea、青霉菌属、曲霉菌属。其中丰度最高的OTU1765属于威尼克外瓶霉真菌,其与人类及植物病原真菌息息相关。枸杞岛真菌群落的生态功能组成比较丰富,主要属于植物病原菌(Plant Pathogen)以及未定义腐生真菌(Undefined Saprotroph)。本研究为了解枸杞岛附近海域表层水真菌群落组成与潜在功能提供了参考。
