鸽圆环病毒新疆株全基因组克隆与序列分析
2021-03-31米晓云吴建勇马文戈日孜瓦古努尔东王琦盛肖刚黄炯魏玉荣
米晓云,吴建勇,马文戈,日孜瓦古·努尔东,王琦,盛肖刚,黄炯,魏玉荣*
(1新疆畜牧科学院兽医研究所,新疆 乌鲁木齐,830013)
(2巴音郭楞职业技术学院,新疆 库尔勒,841000)
(3新疆维吾尔自治区动物卫生监督所,新疆 乌鲁木齐,830013)
鸽圆环病毒(Pigeon circovirus,PiCV,又称Colum⁃bid circovirus,CoCV)是已知最小的致病性病毒,呈二十面体对称球形,无囊膜,直径为17~22 nm,基因组由大约1.7~2.3 kb的单链环状DNA组成[1−2]。PiCV于1993年在美国被首次报道,此后许多国家和地区陆续发现该病[3−4]。余旭平等[5]于2009年在浙江地区鸽群中检测并报道了国内首例PiCV。随后,福建、江苏、上海、山东、河北、安徽、广东等地均有PiCV病例报道[6]。PiCV的全基因组于2000年首次被克隆[7]。国内全基因组克隆并序列分析的毒株有ZJ1株、ZJ2株、FJ1株及JS15−1株[5,8−9]。虽然不同毒株之间有着微小的长度变化,但是基因组均含5个开放阅读框(ORF),分别是V1、C1、C2、以及3'基因间区和5'基因间区[10−11]。ORF V1 以 ATG 为起始密码子编码含315~318个氨基酸的复制相关蛋白(Rep)。ORF C1以ATG/ATA为起始密码子编码含270~274个氨基酸的病毒外壳蛋白(Cap)[11]。其他ORF的功能目前未知。
本文根据已发表的PiCV全基因组序列设计引物,对采集于和田地区墨玉县种鸽场已检测呈PiCV阳性的病料进行全基因组序列克隆和测序,并进行序列分析,为疫苗候选开发提供参考资料。
1 材料与方法
1.1 试验材料
新疆和田地区墨玉县规模化种鸽场3—4月龄病鸽样本(心、肝、肺、大肠及喉管),采集后−20℃保存备用。
1.2 试剂
TIANamp Virus DNA/RNA Kit、2xPCR MasterMix购自天根生化科技(北京)有限公司;5 000 bp DNA Marker购自宝生物工程(大连)有限公司;Wizard®SV Gel and PCR Clean−Up System、Wizard® Plus SV Minipreps DNA Purification System购自普洛麦格(北京)生物技术有限公司;pEASY−T1载体、Trans1−T1 Phage Resistant Chemically Competent Cell购自北京全式金生物技术有限公司。
1.3 引物设计与合成
根据GenBank中已发表的PiCV基因组序列(GenBank登录号:KX108805),设计引物,见表1,引物由生工生物工程(上海)股份有限公司合成,用于PiCV完整基因序列扩增。

表1 引物序列
1.4 病毒DNA提取
前期检测并测序鉴定其携带PiCV的病鸽肝脏组织取10 g于研钵中剪碎备用[12]。将剪碎的病料组织置于无菌研钵中,按1:5比例加入无菌PBS(pH 7.4),并加入少许石英砂研磨匀浆,匀浆混合液收集于50 mL离心管中,反复冻融3次,取上清液,12 000 rpm离心5 min,再次取上清液,按TIANamp Virus DNA/RNA Kit试剂盒说明书提取病毒DNA。
1.5 基因组克隆与测序
将提取的DNA样品作为模板扩增PiCV的全基因,PCR扩增产物用1.0%琼脂糖凝胶电泳检测。PCR扩增体系(总体积为25µL):模板2µL,2×PCR MasterMix 12.5µL,PiCV−1−U/D上下引物各0.5µL,RNase Freed ddH2O 9.5µL。PCR扩增程序:94℃预变性5 min;94℃变性45 s,59℃退火40 s,72℃延伸100 s,共30个循环;72℃延伸10 min;4℃保存。将特异性PCR产物胶回收纯化后与pEASY−T1载体连接,转化至Trans1−T1感受态细胞,筛选、初步鉴定阳性克隆送生工生物工程(上海)股份有限公司测序。
1.6 基因组结构分析
测序结果经BLASTn比对分析确认。测序序列用DNAStar软件进行整理、校对并拼接及核苷酸同源性比较。对获得的序列用Vector NTI进行ORF查找及相关特征性序列分析。用MEGA5.0软件采用Neighbor−Joining法,p−distance模式,以鹅圆环病毒株(GenBank登录号:GU320569)GoCV作为外支,用步展值(Bootstrap)重复1 000次对进化树的可靠性进行评估。
2 结果与分析
2.1 全基因组扩增结果
将前期鉴定携带PiCV的鸽肝样本DNA作为模板,进行PiCV的全基因组PCR扩增,电泳结果显示扩增样品约2 031 bp的特异性片段,与预期大小相符(见图1)。目的条带切胶回收,连接pEASY−T1载体用于基因测序。
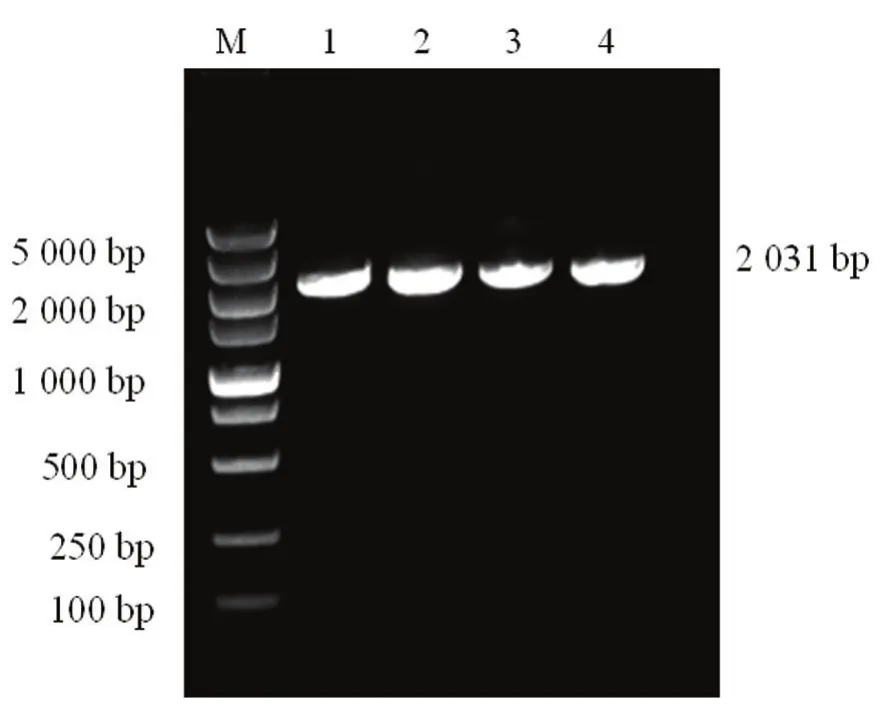
图1 XJ1株基因组扩增结果
2.2 新疆株PiCV基因组结构分析
测序序列拼接得到完整的PiCV基因序列(Gen⁃Bank登录号:MT614188)。完整序列比对分析表明,XJ1株基因组全长为2 031 bp,编码5个ORF,分别为ORF V1(41~994 nt)、ORF C1(1 166~1 981 nt)、ORF C2(410~790 nt)、ORF C3(2~292 nt)和 ORF C4(739~984 nt)(图2)。其中ORF V1编码含317个氨基酸的复制相关蛋白Rep,ORF C1编码含271个氨基酸的衣壳蛋白Cap,其余3个ORF编码功能未知。与文献报道一致,XJ1具有PiCV的共有特征:ORF V1和ORF C1起始之间有一茎环结构,茎环上有9碱基保守序列TAGTATTAC;茎环附近有反向重复序列CACG⁃GAGCCAYATCGC,此序列可能是PiCV复制酶的结合位点[7]。茎环附近还有4个正向重复序列GGAGCC;Rep蛋白中包括3个与滚环复制相关的保守基序(FTLNNP、TPHLQG、YCSK)及其他保守基序(WWDGY、DDFYGWLP、DRYP)[13]。
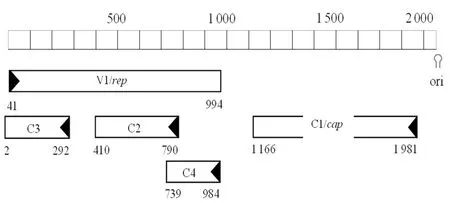
图2 XJ1株环形基因组的线性图谱
2.3 全基因组的同源性分析
用DNAStar软件中的MegAlign对自测的XJ1株与GenBank中,国内外其他24株PiCV毒株的全基因序列进行比对(参考毒株见表2)。结果显示XJ1株与其他24株全基因组核苷酸同源性在87.3%~94.9%之间,与GF17(KX108806)的同源性最高达94.9%;而其他毒株之间核苷酸同源性在85.2%~97.8%之间(表3)。

表2 PiCV毒株概况

表3 PiCV XJ1株与其他毒株基因组核苷酸同源性比较
2.4 全基因组进化树分析
以GoCV作为外支,用MEGA5.0软件Neighbor−Joining法,p−distance模式,Bootstrap检验1 000次重复,对25株PiCV全基因组构建遗传进化树,分析不同来源鸽圆环病毒的亲缘关系(见图3)。结果可见,25株PiCV在遗传进化上依据核衣壳蛋白Cap的起始密码子不同(见表2)而分为明显的2个分支,即分为ATA分支和ATG分支。基于Cap蛋白的遗传进化树显示XJ1与ATG分支中GF82(GF82/Guangdong/2014)、GF17(GF17/Guangdong/2014)及 GH1834(GH1834/GuangDong/2014)亲缘关系最近。
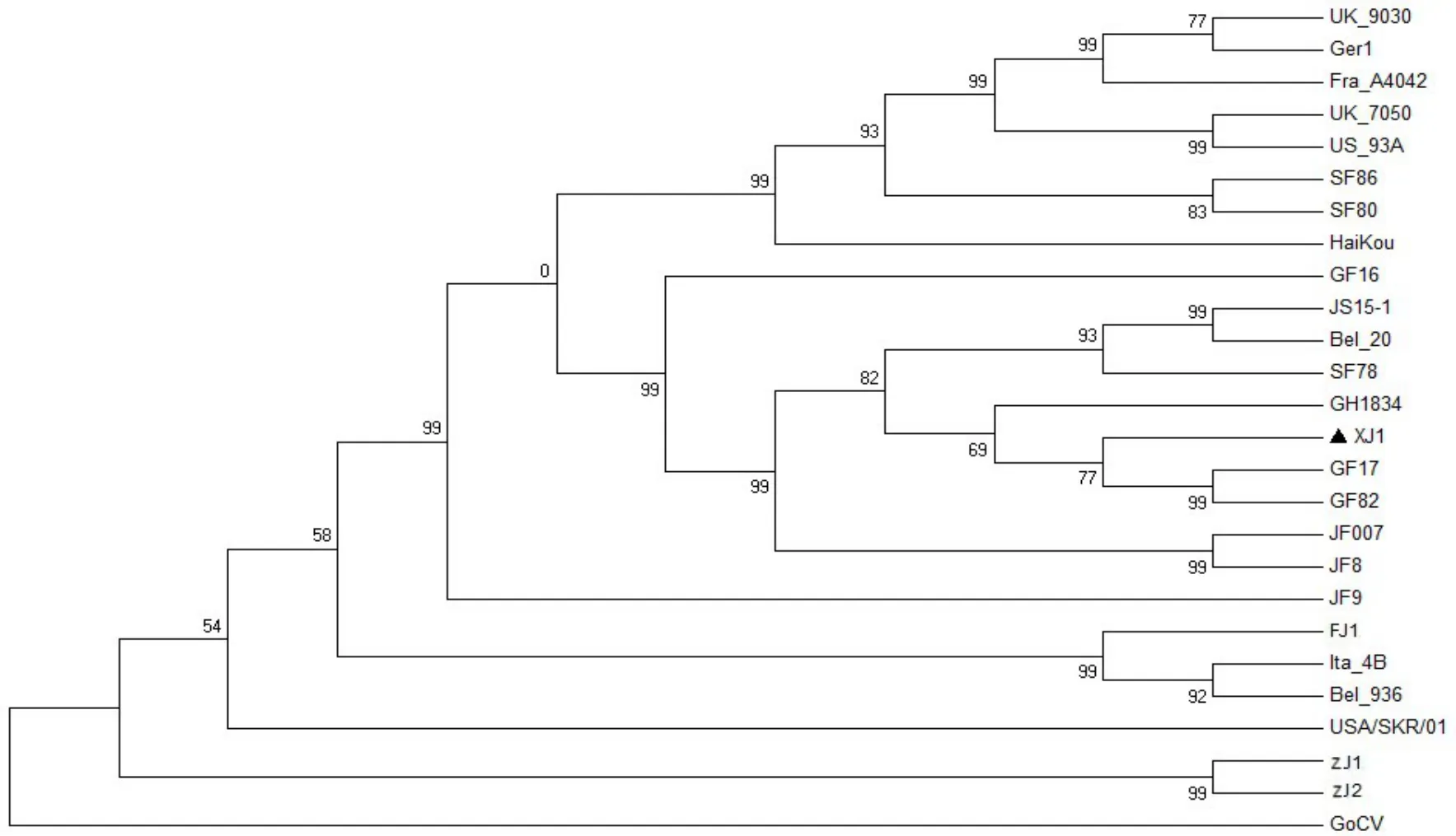
图3 基于Cap蛋白的鸽圆环病毒基因遗传进化分析
3 讨论
PiCV是一种免疫抑制病原,主要感染青年赛鸽及肉鸽,以4月龄以下的鸽子最为易感染,因此又称为“青年鸽病综合征”(young pigeon disease syndrome,YPDS)。PiCV既可通过污染的粪便、饲料及饮水等方式水平传播,又可经鸽胚胎垂直传播[14,15]。2014年,ZHANG Z等[16]对华东地区六个鸽场进行流行病学调查,结果显示PiCV在病鸽群和外观健康鸽群阳性率分别是80.7%(88/109)和63.3%(31/49)。2017年,HUANG Y等[17]对淘汰赛鸽中164羽死亡鸽子进行PiCV检测,结果阳性率为96.95%(159/164)。本实验室调查发现新疆和田地区墨玉县种鸽场鸽群存在一定比例PiCV感染,阳性率为47.29%(96/203)[12]。
PiCV感染会造成鸽免疫系统损伤,继而增加感染其他病原体的潜在风险。MANKERTZ A等[7]根据PiCV基因组序列特征,首次将PiCV归入圆环病毒科的圆环病毒属。鸽圆环病毒基因序列特性的深入研究,有助于病毒致病机理探索、诊断方法建立及防控产品的开发[18,19]。
本研究测序株XJ1基因组全长为2 031 bp,全基因组序列核苷酸相似性比较结果显示XJ1与GF17(GF17/Guangdong/2014)和 GH1834(GH1834/Guang⁃dong/2014)的同源性最高(均为94.9%),与Ita 4B株同源性最低,仅为87.3%。XJ1全基因组编码ORF V1、ORF C1、ORF C2、ORF C3和ORF C4等5个编码框,在编码框外还存在与其复制、增殖相关的5'端基因间隔区和3'端基因间隔区。5'端基因间隔区位于ORF C1和ORF V1之间,有一茎环结构,茎环上有9碱基保守序列TAGTATTAC;茎环附近有反向重复序列(CACGGAGCCATATCGC和GCGATATGGCTCC⁃GTG及2个GGAGCC和GGCTCC);XJ1株5'端基因间隔区长度为90 nt,与其他参考毒株略有差异。3'端基因间隔区位于ORF C1和ORF V1之间(995~1 165 nt),长度为 171 nt。与文献报道一致,XJ1 株Rep蛋白中也包括3个与滚环复制相关的保守基序(FTLNNP、TPHLQG、YCSK)及其他保守基序(WWDGY、DDFYGWLP、DRYP)[13]。
ORF C1编码的Cap蛋白有ATG和ATA两类起始密码子(表2)。万春和等[8]认为起始密码子的不同与3'端基因隔区长度相关,当3'端基因间隔区长度为171 nt时,Cap蛋白的起始密码子为“ATG”,而长度是170 nt时,Cap蛋白的起始密码子为“ATA”。然而,TODD D等[11]在鸽圆环病毒序列组成研究中列表比较分析了12个序列的Cap蛋白起始密码子,研究结果正好与万春和等人相反,即当3'端基因间隔区长度为171 nt时,起始密码子为“ATA”,而长度是170 nt时,起始密码子为“ATG”。但是,仔细对比万春和及TODD等学者文章中列举的毒株序列位点,结合本研究中下载自GenBank中序列及XJ1基因序列分析,结果显示这两种起始密码子在Cap蛋白中呈随机分布,与3'端基因隔区长度相关性不大。XJ1株与国内外发表的24株鸽圆环病毒序列全基因作基于Cap蛋白的遗传进化分析,PiCV在遗传进化中具有明显的ATA分支和ATG分支,与Cap蛋白起始密码子相一致(表2)。国内毒株虽处于不同亚群但均处于ATG分支,且大部分毒株(14/17)3'端基因间隔区长度为171 nt,仅浙江株(ZJ1和ZJ2)及JS15−1株(3/17)的3'端基因间隔区长度为170 nt。XJ1株与ATG分支中的广东毒株 GF82(GF82/Guangdong/2014)、GF17(GF17/Guangdong/2014)及 GH1834(GH1834/Guang⁃dong/2014)可能来源相同。
基于流行病学结果,PiCV感染及继发感染已经给国内养鸽业造成严重损失。但迄今为止,PiCV还无法体外细胞培养,极大限制了PiCV各方面的深入研究。本研究对新疆PiCV基因序列特性的深入研究,有助于通过基因工程手段开发疫苗产品用于该病的防控。
4 结论
XJ1株基因组全长为2 031 bp,有5个阅读框;基因间隔区长度分别为90 nt和171 nt。XJ1全基因组序列与国内GF17和GH1834的同源性最高(均为94.9%)。基于Cap基因遗传进化树显示,XJ1株与Cap蛋白起始密码子“ATG”分支中GF82、GF17及GH1834亲缘关系最近。这是新疆首次测定PiCV全基因组序列,有助于PiCV疫苗开发。
