HSD17B12基因对湖羊垂体细胞促性腺激素合成的影响
2021-03-30赵欣月张艳丽
杨 花,赵欣月,万 珍,王 锋,张艳丽
(南京农业大学动物科技学院 羊业科学研究所,南京 210095)
17β-羟类固醇脱氢酶12(HSD17B12)是一种典型的雌激素性17β-HSD[1]。哺乳动物的HSD17B12最早被认为是一种酮酰CoA还原酶,参与脂肪酸链的延长[2-3]。研究发现,HSD17B12的表达会受固醇调节元件结合蛋白(SREBP)的影响,与参与胆固醇和脂肪酸等生物合成的基因相似[4],其会进一步影响类固醇的产生。此外,该酶在类固醇激素生成通路中富集,可将雌酮(E1)转化为雌二醇(E2),并且一定程度上催化雄烯二酮转化为睾酮[5],与动物的生殖密切相关[6-7]。Kemiläinen等[8]发现,HSD17B12能通过调节前列腺素的分泌影响卵巢的功能,进而影响雌性生殖。此外,HSD17B12敲低会诱导乳腺癌细胞系的生长抑制[9]。HSD17B12过表达可能对卵巢健康有不利影响,提升卵巢癌细胞活性[10]。有研究表明,HSD17B12在卵巢浆液性腺癌中呈高表达,且在临床不同时期表达不同[11]。Ijiri等[12]发现,经鲑鱼垂体提取物诱导后的卵巢颗粒层中,HSD17B12类似物的含量显著上升,推测该现象与HSD17B12和垂体对鲑鱼生殖系统的影响有关。HSD17B12也被发现与鱼类卵母细胞成熟过程紧密相关[13]。此外,HSD17B12参与了花生四烯酸的合成,对于胚胎发生过程中正常的神经元发育至关重要[14]。基因多态性分析也表明,HSD17B12可能与猪产仔数存在一定联系[15]。综上表明,HSD17B12在动物生殖中具有重要作用。
垂体作为动物体主要生理过程的中枢调节器,可通过调节细胞群的分泌来响应机体内激素的变化和下丘脑的状态[16-17]。其分泌的激素主要为促性腺激素(卵泡刺激素(FSH)和黄体生成素(LH))等,对性腺的发育和生殖活动有直接影响[18-20];此外,生长激素(GH)也作为垂体分泌的对动物生长调控具有重要作用的多功能激素,在垂体发育、垂体腺瘤、激素缺乏症等临床疾病中有大量研究[21-23]。前期研究发现,HSD17B12在湖羊垂体、下丘脑中呈高表达,性成熟前后湖羊垂体组织lncRNA和mRNA高通量测序结果表明,HSD17B12可显著富集在类固醇激素合成相关通路中,并且是一种差异表达lncRNA的靶基因,干扰该lncRNA的水平可显著降低HSD17B12的表达,且降低垂体细胞中的激素分泌水平[24],推断该基因功能与湖羊的生殖和发育相关,但未有进一步研究。
湖羊作为国家级的绵羊资源保护品种,集生长快、产羔多、羔皮美观等多个优点于一体[25-26],探究其垂体机能与生殖机制对提高其繁殖力有重要意义。因此,本研究将对HSD17B12基因的CDS区进行序列扩增,分析其预测蛋白序列的正确性和物种同源性。并在组织和细胞水平上鉴定HSD17B12在垂体组织中的表达定位,结合RNA干扰和细胞转染技术,干扰HSD17B12的表达,进一步分析细胞增殖、凋亡变化,探索其对垂体激素分泌功能的影响,这将为湖羊垂体中HSD17B12的调控机制研究提供一定的理论依据。
1 材料与方法
1.1 试验材料
本研究试验样品来自江苏省泰州市海伦羊业有限公司,选择体况健康、体重为40 kg左右的9月龄湖羊公羊3只,取其脑垂体组织进行-80 ℃冻存及4%多聚甲醛固定。选择健康的3月龄湖羊公羊,取垂体组织进行垂体细胞分离培养。
1.2 HSD17B12基因CDS区扩增
利用Trizol法提取垂体组织RNA,使用TaKaRa反转录试剂盒进行cDNA合成。根据NCBI中已知的绵羊HSD17B12基因预测序列,针对其CDS区用Primer 5.0软件设计特异性引物,见表1,由南京擎科生物技术有限公司合成。以湖羊垂体组织cDNA 为模板,普通PCR扩增HSD17B12基因CDS区,扩增体系:2 × Phanta Max Master Mix 10 μL,10 μmol·L-1HSD17B12-CDS-F 0.8 μL,10 μmol·L-1HSD17B12-CDS-R 0.8 μL,cDNA 1 μL, Nuclease Free Water 7.4 μL。反应条件:95 ℃ 预变性3 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸30 s,进行35个循环;72 ℃延伸5 min。将PCR产物进行凝胶电泳分析,获得正确产物大小的片段。并将PCR产物交由南京擎科生物技术有限公司进行测序。最后,利用DNAMAN 9.0对HSD17B12的CDS序列进行翻译和同源性分析。
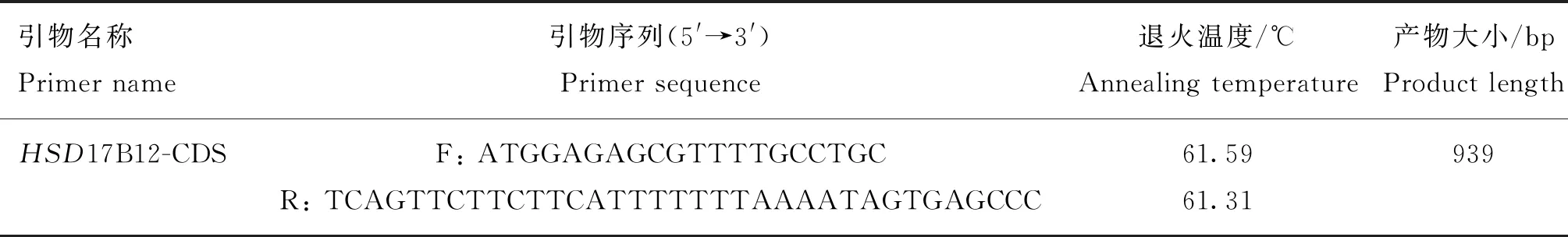
表1 HSD17B12基因克隆引物
1.3 免疫组织化学分析HSD17B12在垂体组织中的定位
将固定好的垂体组织小块进行石蜡包埋并进行组织切片,厚度为5 μm。按照切片脱蜡、抗原修复、通透、5% BSA封闭等步骤依次进行。在湿盒中4 ℃ 过夜孵育HSD17B12一抗(CUSABIO, CSB-PA687494LA01HU)[10],之后依次进行二抗孵育和DAB显色,再用苏木素染料染核,脱水透明,最后封片,在显微镜下观察并拍照。
1.4 湖羊垂体细胞培养及HSD17B12基因转染
本试验对所采集的3月龄湖羊垂体组织进行垂体细胞分离,分离步骤参照文献[27]。之后在添加有10%胎牛血清以及1%双抗的DMEM/F12培养液中进行培养,培养条件为37 ℃,5% CO2。根据HSD17B12基因序列,在上海吉玛公司进行siRNA 的设计与合成,见表2。在转染前1 d,将细胞传代至6孔板中,待细胞密度达到70%~80%,参照Lipofectamine®3000说明书进行转染。转染24 h后,收集细胞上清,提取细胞总RNA,进行下一步试验。

表2 HSD17B12基因干扰序列
1.5 干扰HSD17B12基因后对垂体细胞增殖、周期及凋亡的检测
1.5.1 EdU染色检测细胞增殖 将细胞接种于铺有细胞爬片的24孔板,待细胞密度为70%~80%进行转染,24 h后去除培养液,并加入完全培养基稀释的EdU工作液(40 nmol·L-1)孵育6 h。孵育完成后,去除培养基,DPBS洗2次,4%多聚甲醛固定,室温孵育20 min,去除固定液。每孔加入500 μL 2 mg·mL-1甘氨酸溶液,室温孵育5 min后,使用含有3% BSA的PBS洗涤细胞2次,加入500 μL 0.5% Triton X-100到每个孔中,室温孵育20 min。然后按照试剂盒说明书进行EdU检测及DNA复染,最后在显微镜下观察并拍照分析。
1.5.2 PI单染法检测细胞周期 细胞转染24 h后,弃上清,DPBS洗3次,0.25%胰酶消化细胞,1 500 r·min-1离心5 min后,弃上清,再洗2次,用75%酒精重悬细胞,-20 ℃固定3 h后用PBS洗去固定液;加入100 μL RNase A, 37 ℃水浴30 min;再加入400 μL PI染色液混匀,4 ℃避光30 min。用流式细胞仪记录激发波长488 nm处的红色荧光,最后进行数据分析。
1.5.3 Annexin-V FITC/PI双染法检测细胞凋亡 细胞转染24 h后,弃培养液,DPBS洗3次,用0.25%胰酶(不含EDTA)消化收集细胞,再用PBS洗涤细胞2次并1 500 r·min-1离心5 min;在收集到的细胞中加入500 μL Binding Buffer悬浮细胞;再加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀;接着室温避光反应5~15 min; 用流式细胞仪检测细胞凋亡情况。
1.6 干扰HSD17B12基因后垂体细胞RNA提取与荧光定量PCR
细胞转染24 h后,去上清液,DPBS洗3次,使用Trizol裂解细胞,充分吹打后收集至1.5 mL离心管,按照说明书进行RNA提取和cDNA合成。结合NCBI数据库,利用Primer 5.0软件进行HSD17B12、FSHβ、LHβ、GH、PCNA基因的引物设计,并由南京擎科生物技术有限公司合成。引物信息见表3。荧光定量PCR(qPCR)体系: SYBR Green Master 10 μL,基因上、下游引物(10 μmol·L-1) 各0.6 μL,cDNA 1 μg,Nuclease Free Water补充至20 μL。将混合好的体系在荧光定量PCR仪进行反应,反应程序:50 ℃2 min; 95 ℃ 预变性10 min;依次95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s,共40个循环;最后72 ℃延伸10 min。 反应结束后,通过2-ΔΔCt法,以ACTB基因为内参基因对目的基因表达量进行相对定量分析。

表3 基因PCR引物序列
1.7 数据处理及分析
本研究所涉及试验均重复至少3次,试验数据以“平均值±标准误(mean±SEM)”表示。用SPSS(24)软件对数据进行差异显著性分析,*与**分别代表差异显著(P<0.05)与极显著(P<0.01)。
2 结 果
2.1 HSD17B12基因CDS区合成及蛋白同源性分析
本研究利用PCR扩增了HSD17B12基因的CDS区序列,PCR产物如图1所示,进行测序后发现,其大小为939 bp,与NCBI数据库中预测的HSD17B12基因CDS区一致,未发生突变。利用DNAMAN进行CDS区序列翻译和氨基酸序列同源性比对后发现,HSD17B12的CDS区序列可以编码312个氨基酸(图2),与山羊、牛、人、小鼠蛋白序列比对发现,其蛋白同源性较高,其中跟山羊同源性可高达99%,其次与牛同源性达91%,与人和小鼠同源性分别为84%和80%(图3),证明HSD17B12在物种间保守性较高。
A.HSD17B12基因CDS区扩增的PCR产物凝胶电泳分析;B.HSD17B12基因CDS区扩增示意图 A. Gel electrophoresis analysis of PCR product amplified from CDS region of HSD17B12 gene; B. Schematic diagram of CDS region amplification of HSD17B12 gene图1 HSD17B12基因CDS区扩增Fig.1 CDS region amplification of HSD17B12 gene

ATG和TGA分别表示起始密码子和终止密码子 ATG and TGA represent start codon and stop codon, respectively图2 HSD17B12基因CDS区核酸序列及氨基酸预测序列Fig.2 CDS region nucleotide and predicted amino acid sequences of HSD17B12 gene
2.2 HSD17B12在垂体组织中的表达定位
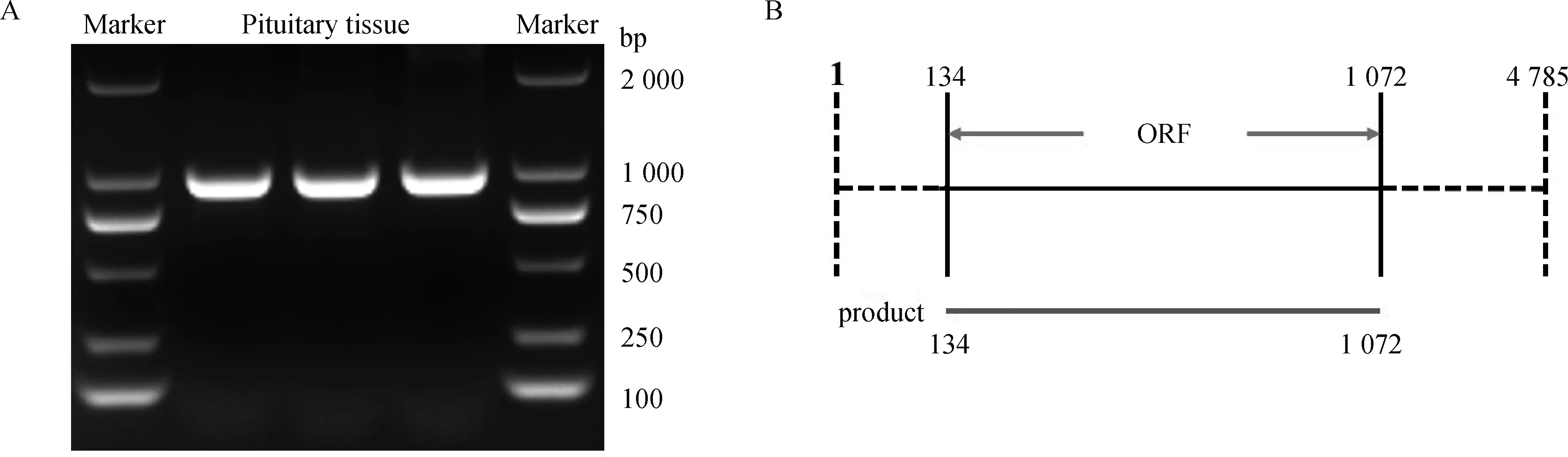
垂体组织中主要包括嗜酸性、嗜碱性和嫌色性3类腺细胞,参与生长激素、促性腺激素、甲状腺激素等的分泌。免疫组化结果显示,HSD17B12在湖羊垂体组织的大部分区域均显著表达(图4)。
2.3 干扰HSD17B12基因对垂体激素分泌及合成相关基因的影响
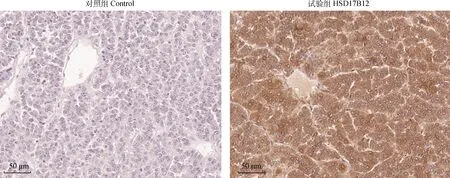
为研究HSD17B12在垂体的作用,本研究设计合成了HSD17B12的siRNA,并进行干扰试验。如图5所示,3种siRNA均可显著降低HSD17B12基因的表达,但是siRNA-2效果最显著(P<0.01)。接下来,以siRNA-2进行后续试验,如图6所示,干扰HSD17B12基因后,垂体激素分泌相关基因FSHβ、LHβ和GH表达显著降低(P<0.05)。因此,在绵羊垂体细胞水平干扰HSD17B12基因,可有效降低垂体细胞促性腺激素和生长激素的分泌。
对照组为阴性染色,试验组为HSD17B12阳性染色 The control group is the negative staining group, and the experimental group is the HSD17B12 positive staining group图4 免疫组化分析HSD17B12在湖羊垂体组织中的定位(400×)Fig.4 The localization of HSD17B12 in Hu sheep pituitary tissue by immunohistochemical analysis (400×)
NC. 阴性对照组;siRNA. siRNA干扰组。qPCR结果以“平均数±标准误”表示且以NC为对照。*.P<0.05,**.P<0.01,下同 NC. Negative control group; siRNA. RNA interfering group. qPCR results are expressed relative to the NC group as “mean±SEM”. *.P<0.05, **.P<0.01, the same as below图5 HSD17B12基因的3个siRNAs干扰效率检测Fig.5 Detection of 3 siRNAs interference efficiency of HSD17B12 gene
2.4 干扰HSD17B12基因对垂体细胞增殖、周期、凋亡的影响
为进一步探究HSD17B12对垂体激素分泌功能的影响机制,对干扰后细胞的增殖、周期和凋亡情况进行检测。如图7所示,干扰HSD17B12基因后,垂体细胞增殖效率显著降低(P<0.05),干扰组细胞EdU荧光少于对照组(P<0.05);此外,细胞流式表明,干扰组中处于S期的细胞比率显著高于对照组,G1期则相反(P<0.05),而G2期细胞比率无显著差异。细胞凋亡结果显示,干扰组中早期凋亡细胞和晚期凋亡细胞比率均较对照组多,细胞总凋亡率显著增加(P<0.05)。因此,在绵羊垂体细胞干扰HSD17B12基因后,可引起细胞增殖下降、细胞周期发生改变,细胞凋亡发生,这些可能是引起细胞激素分泌异常的重要因素。
3 讨 论
湖羊是我国著名的多羔绵羊品种,而垂体作为下丘脑-垂体-睾丸/卵巢性腺轴中的中枢器官,它与下丘脑和各种下游内分泌器官一起严格控制着新陈代谢、生长、生殖以及水分平衡等各种生命过程[28]。目前,关于湖羊垂体中关键基因的研究主要集中在BMP基因家族及SMAD通路[29-32]。前期研究表明,HSD17B12基因作为lncRNA的靶基因,可调节垂体促性腺激素的分泌。因此,本试验以HSD17B12基因为研究对象,扩增其CDS区序列,在组织及细胞水平探索其潜在的功能,为湖羊垂体功能机制研究提供基础。
HSD17B12作为一种多功能酶,可参与脂肪酸链的延长代谢[2, 33],影响多不饱和脂肪酸的合成。因此,HSD17B12作为脂肪合成相关靶基因可参与山羊乳腺脂质和肉鸡脂肪组织中相关基因表达的调控[34-35]。研究表明,HSD17B12在小鼠体内参与了花生四烯酸(AA)的合成,对胚胎的神经元发育造成影响[14]。有研究发现,HSD17B12除了影响AA的产生,还与COX-2共表达,参与到前列腺素的形成过程中[8, 36],进而影响卵子发生和排卵调节等卵巢功能,最终影响到雌性生殖生理。此外,HSD17B12将E1转化为E2的转化率明显大于其将4-雄烯二酮转化为睾酮的转化率[1]。这种类固醇激素转化特异性与酶底物结合域的空间结构有关。尽管本试验发现,HSD17B12在不同物种中蛋白同源性较高,但仍有研究表明,其在不同物种中的作用方式不同[1, 5]。此外,E1转化为E2需要HSD17B12、HSD17B1和HSD17B7共同催化。HSD17B12通过对E2形成细胞特异性调节,招募细胞特异性激活/抑制因子,形成特异性复合物,从而激活或抑制雌激素敏感基因的表达[1],进而影响哺乳动物生殖活动。
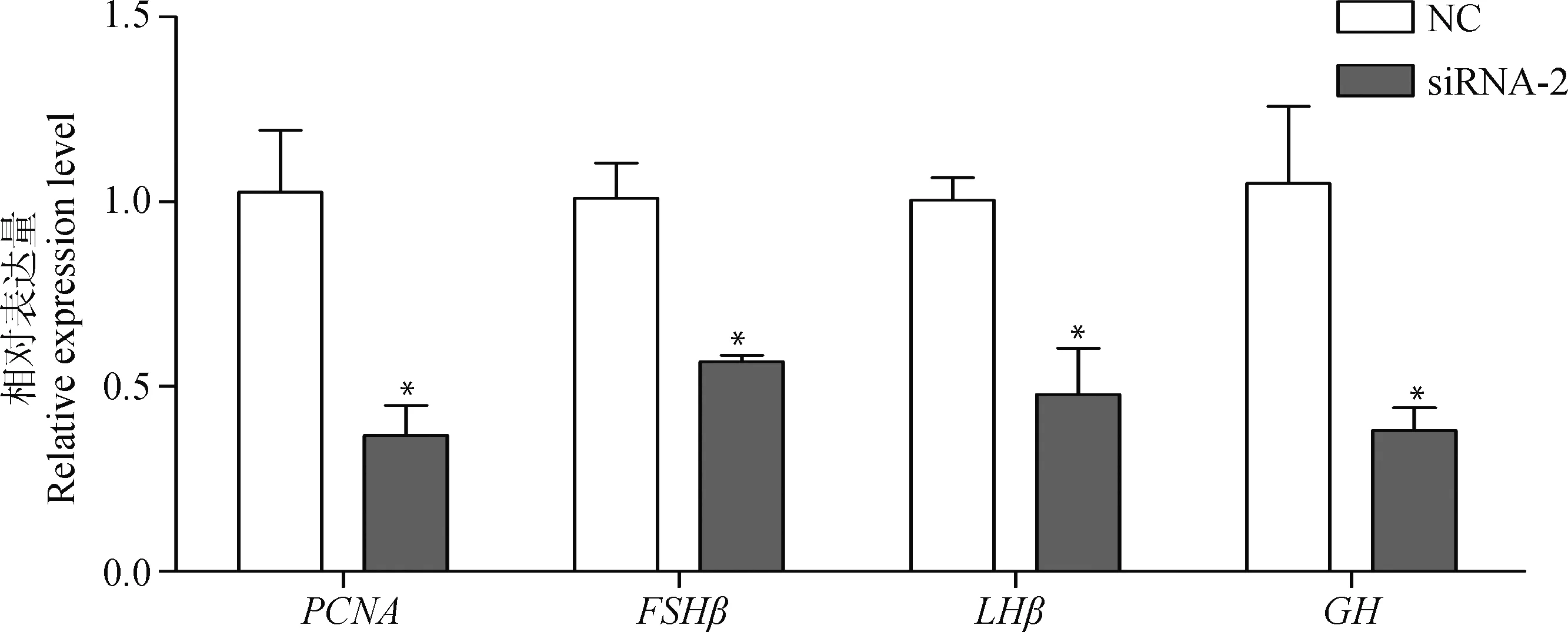
NC. 阴性对照组;siRNA. siRNA干扰组。qPCR结果以“平均数±标准误”表示且以NC为对照 NC. Negative control group; siRNA. RNA interfering group. qPCR results are expressed relative to the NC group as “mean±SEM”图6 干扰HSD17B12基因后增殖标记基因PCNA和激素相关基因表达的变化Fig.6 Changes of the expression levels of proliferation marker gene PCNA and hormone-related genes after interfering HSD17B12 gene interference
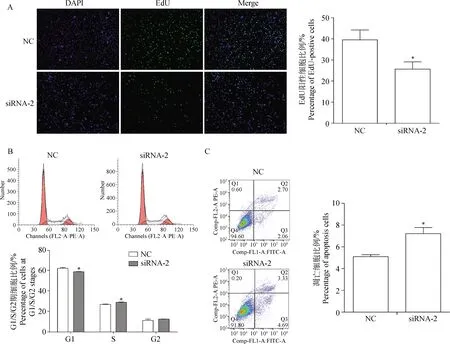
A. EdU检测干扰HSD17B12后细胞增殖变化;B. 细胞流式分析干扰HSD17B12后垂体细胞周期变化;C. 细胞流式分析干扰HSD17B12对垂体细胞凋亡的影响。数据结果以“平均数±标准误”表示且以NC为对照 A. Cell proliferation change is detected after interfering HSD17B12 gene by EdU analysis; B. Cells cycle detection is analyzed after interfering HSD17B12 gene by flow cytometer; C. Pituitary cell apoptosis is detected after interfering HSD17B12 gene by flow cytometer. The results are expressed relative to the NC group as “mean±SEM”图7 干扰HSD17B12基因对绵羊垂体细胞增殖、周期、凋亡的影响Fig.7 The effect of HSD17B12 gene interference on sheep pituitary cell proliferation, cycle and apoptosis
垂体可根据组织结构分为神经垂体和腺垂体,而腺垂体大部分位于垂体前叶[18],在内分泌过程中起到至关重要的作用。腺垂体远侧部会分泌促性腺激素(FSH和LH等)来影响类固醇激素的产生,从而影响整个生殖系统的发育。有研究表明,FSH和LH的比例一定程度上会影响生殖器官的发育,例如高FSH/LH会造成卵巢发育不良[37]。在下丘脑-垂体-性腺轴中,垂体感受到下丘脑分泌的促性腺激素释放激素(GnRH)后,相应增加或减少FSH和LH的分泌,从而影响性激素如雌二醇、孕激素含量的变化。而最终分泌的性激素又可以通过负反馈调节靶向作用于垂体,进一步影响垂体促性腺激素的分泌。研究表明,HSD17B12与类固醇激素的产生存在联系,推测其在垂体的表达可能与垂体激素合成相关基因以及它们对性腺激素等类固醇激素的作用有关。前期研究发现,在动物发育不同阶段,不同剂量的雌激素可以以不同的方式调节下丘脑垂体的基因表达[38]。而一定量的雌激素可以诱导垂体催乳素的分泌[39]。本研究中蛋白定位结果说明,HSD17B12在湖羊垂体组织大部分细胞中均表达,且之前研究也表明,其在下丘脑、垂体中表达量最高,这些结果暗示,HSD17B12基因在垂体中具有重要作用。体外干扰试验也说明,下调HSD17B12基因的表达造成垂体细胞中FSHβ、LHβ和GH的表达水平显著降低。同时,细胞增殖也下降,周期发生改变,凋亡率增加,这些因素有可能是造成激素相关基因表达水平显著下降的原因。有研究发现,在肿瘤细胞中沉默HSD17B12基因的表达,导致细胞生长受到抑制,凋亡增加[7],在乳腺癌细胞中敲低HSD17B12基因的表达会降低细胞增殖效率[9]。这些与本研究结果相一致。但是在牛乳腺上皮细胞的研究中,HSD17B12基因的过表达会抑制细胞的增殖,促进细胞凋亡[40]。这些结果表明,在不同的物种或细胞中,HSD17B12的作用效果不尽相同,但都是通过与花生四烯酸相互调节而发挥功能。因此,本研究可在后续试验中,探索花生四烯酸在HSD17B12调节垂体激素分泌过程中的作用机制。
总体来说,本试验以湖羊垂体组织和细胞为研究对象,确定了HSD17B12基因的CDS区序列为939 bp,并对其在湖羊垂体中的表达进行定位分析,此外,在细胞水平上证明其可通过介导细胞增殖、周期和凋亡的改变而影响垂体细胞激素相关基因的表达,但其作用机制仍需要进一步探讨。本研究对HSD17B12基因在湖羊垂体中的功能进行了初步验证,为其作用机制研究的深入探索奠定了基础。
4 结 论
综上表明,HSD17B12序列在物种间呈现较高的保守性,且在雄性湖羊垂体组织的大部分区域均有表达。在垂体细胞干扰HSD17B12的表达会显著降低促性腺激素相关基因和生长激素基因的表达,同时可以显著降低细胞增殖效率,改变细胞周期,提高细胞凋亡率。因此,体外干扰HSD17B12的表达会通过影响细胞的凋亡与增殖而影响细胞激素的分泌,为探究垂体促性腺激素合成分泌的机理提供理论基础。
