猪ADAR2基因全长cDNA克隆、序列特征及表达模式分析
2021-03-30张跃博王立刚侯欣华张龙超王立贤
张跃博,王立刚,侯欣华,刘 欣,颜 华,张龙超*,王立贤*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193; 2.湖南农业大学动物科学技术学院,长沙 410128)
RNA编辑广泛发生于细菌、真菌、病毒、动植物等,具有改变氨基酸序列、影响可变剪接、导致内含子滞留、影响RNA稳定性等功能[1],为解释诸多复杂生命过程提供了一个新的研究方向。在哺乳动物中,A-to-I型RNA编辑最为普遍,所占比例可达90%以上[2-3]。研究显示,大部分A-to-I编辑事件位于重复元件,仅有少数发生于编码区[4-6],预示A-to-I编辑的功能可能以调控基因表达为主。已报道A-to-I编辑在癌症、自身免疫性疾病、多种神经性疾病中发挥重要作用[7-10]。目前,决定RNA中腺苷发生脱氨反应的机制尚不清楚,但已知双链RNA结构(double-stranded RNA,dsRNA)和作用于RNA的腺苷脱氨酶(adenosine deaminases acting on RNA,ADARs)是A-to-I编辑发生的必要条件。次黄苷(inosine,I)在翻译过程中会被识别为鸟苷(guanosine,G),因此A-to-I编辑也称A-to-G编辑。
ADAR2是ADAR酶家族的一员,主要存在于细胞核,具有催化A-to-I编辑的活性,但对特异性编辑位点的亲和力高于随机性编辑位点[11],其编辑作用具有选择性。敲除ADAR2的小鼠产后出现癫痫,并会于20~25日龄时死亡,但若同时将GluR2 Q/R位点上A替换为G,小鼠的寿命表现正常[12-14],表明ADAR2介导的A-to-I编辑具有影响机体生命活动的潜力。高通量测序分析发现,ADAR2 在人体动脉中高表达,同时有研究表明,编码区的RNA编辑水平在人体动脉中最高[15],预示着ADAR2可能与血管疾病密切相关。此外,ADAR2 过表达的小鼠会因食欲亢进而引发肥胖[16]。猪的解剖特征、生理生化特点等与人类极为相似,可作为研究人类疾病的动物模型,其相关研究势必促进人们对自身疾病致病机理的认识。尽管如此,对猪ADAR2的研究仍然比较缺乏,其序列特征、表达模式尚未有相关报道。
本研究利用RACE技术克隆猪ADAR2 cDNA全长序列,并对序列特征进行分析,同时应用实时荧光定量PCR(real-time quantitative PCR,qPCR)技术检测大白猪不同组织中ADAR2的表达模式,为进一步研究猪ADAR2的功能及其调控A-to-I编辑的机制奠定基础。
1 材料与方法
1.1 试验材料
本研究使用的4头大白仔猪来自中国农业科学院北京畜牧兽医研究所昌平试验基地猪场。35日龄屠宰,采集心、肝、脾、肺、肾、脑、肌肉、小肠和背部脂肪组织,并经液氮速冻后于-80 ℃冰箱保存备用。
1.2 RNA提取与cDNA合成
使用RNA提取试剂盒(天根,北京)提取大白猪9种组织的总RNA,并利用超微量分光光度计(NanoDrop2000)和1%琼脂糖凝胶电泳对RNA纯度、浓度和完整性进行检测。取1 μg质量合格的RNA,参照PrimeScriptTMRT反转录试剂盒(TaKaRa,日本)说明书合成cDNA,用于克隆全长cDNA序列的中间片段和检测ADAR2在各组织中的表达情况。使用大白猪脾脏组织RNA,根据SMARTer RACE 5′/3′试剂盒(Clontech,日本)说明书分别合成5′- 和3′-RACE的cDNA模板,用于克隆5′和3′末端序列。
1.3 猪ADAR2基因全长cDNA序列克隆
以GenBank中的猪ADAR2 mRNA预测序列(登录号:XM_021071524.1)为模板,利用NCBI中的Primer-BLAST工具设计用于克隆1 164 bp中间片段的引物(表1)。PCR反应体系为25 μL,包括12.5 μL 2× Taq PCR Master Mix,1 μL cDNA模板,上、下游引物(10 μmol·L-1)各1 μL,以及9.5 μL ddH2O。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 10 min。 利用1.5%琼脂糖凝胶电泳对反应产物进行检测,然后送北京诺赛基因组研究中心有限公司测序。以克隆获得的中间序列为模板,应用Primer-BLAST工具设计5′- 和3′-RACE所需的特异性引物(表1)。参照SMARTer RACE试剂盒说明,分别以合成的5′- 和3′-RACE的cDNA为模板,采用巢式PCR扩增5′和3′末端序列。将获得的PCR产物切胶回收,克隆到linearized pRACE载体,挑选阳性克隆送北京诺赛基因组研究中心有限公司测序。
1.4 猪ADAR2生物信息学分析
利用DNAMAN软件拼接组装获得cDNA序列,并分析物种间ADAR2 的CDS区核苷酸序列和氨基酸序列的一致性。使用ProtParam(https://web.expasy.org/protparam/)软件分析猪ADAR2蛋白质的理化性质。利用ProtScale (https://web.expasy.org/protscale/)分析蛋白亲-疏水性。分别使用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)和SWISS-MODEL(https://www.swissmodel.expasy.org/)预测猪ADAR2蛋白质二级结构和三级结构。ADAR2系统进化树使用MEGA-X绘制。采用NCBI中的Batch CD-Search(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi) 预测ADAR2蛋白的结构域。
1.5 荧光定量PCR检测
以大白猪心、肝、肺、肾、脾、脑、小肠、背最长肌和背部脂肪的cDNA为模板,GAPDH作内参基因,采用qPCR方法检测ADAR2的组织表达情况。反应体系:2× SYBRRPremix ExTaqII 10 μL,cDNA 2 μL,10 μmol·L-1上、下游引物各0.4 μL,50× ROX Reference Dye II 0.4 μL和ddH2O 6.8 μL。 反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;反应结束后分析熔解曲线。所需引物均利用Primer-BLAST设计(表1)。以脂肪组织为对照,用2-△△Ct法计算ADAR2在各组织中的表达量,并利用SAS 9.2的GLM过程进行单因素方差分析。

表1 猪ADAR2基因cDNA克隆及qPCR引物
1.6 ADAR2在不同猪种中的表达谱分析
在PIGPAN(http://animal.nwsuaf.edu.cn/code/index.php/panPig)的GBrowse中检索获得ADAR2在梅山、金华、八眉、荣昌、皮特兰、长白、大白、汉普夏、巴克夏和藏猪不同组织中RNA-seq的表达数据,利用TBtools[17]绘制热图。每个品种1个 个体,7~9种组织,包括背最长肌、腰大肌、皮下脂肪、心、肝、脾、肺、肾和卵巢。
2 结 果
2.1 猪ADAR2 cDNA全长序列克隆
克隆获得的cDNA序列片段经DNAMAN拼接后,得到猪ADAR2 cDNA全长序列,其长度为6 305 bp, 其中5′ UTR、3′ UTR和CDS分别为548、3 616和2 115 bp,还有一个ploy(A)尾巴;编码704个氨基酸,起始密码子为ATG,终止密码子为TGA。序列已提交到GenBank,登录号为MW273927。利用Ensembl中的BLAST/BLAT在线工具对克隆获得的cDNA全长序列进行分析发现,猪ADAR2基因共包含12个外显子(图1),各外显子长度在75~3 796 bp之间,仅有1个内含子的剪接位点序列不符合GT-AG法则,为GC-AG(表2)。
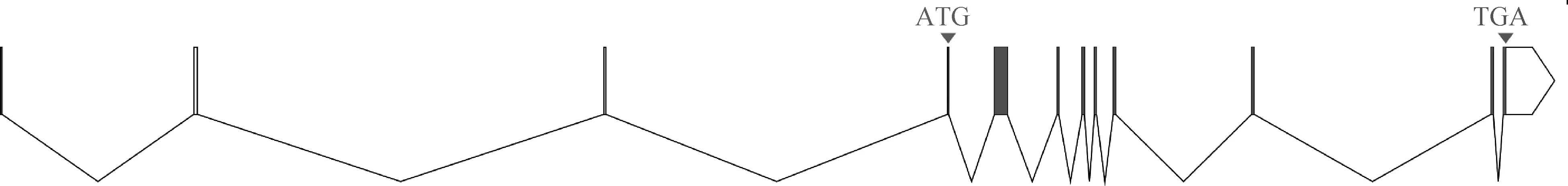
图1 猪ADAR2基因结构Fig.1 Gene structure of porcine ADAR2 gene

表2 猪ADAR2基因的剪接位点
2.2 ADAR2基因的序列一致性分析
核甘酸序列一致性分析表明,猪与偶蹄目家畜山羊(89.9%)、绵羊(89.7%)和牛(88.8%)的一致性最高,其次是人等灵长目动物(约84%),与斑马鱼(69.0%)的一致性最低(表3)。猪ADAR2基因预测的氨基酸序列与其他物种相应序列的一致性分析发现,猪与绵羊的一致性最高,高达93.3%;其次是牛,为92.0%;与斑马鱼的一致性最低,仅为69.0%(表3)。
2.3 猪ADAR2蛋白结构分析与系统进化树构建
预测的猪ADAR2蛋白共包含10 747个原子,分子量是76.35 ku,理论等电点9.03,不稳定系数高达48.58。蛋白质疏水性分析显示,猪ADAR2蛋白在第358位氨基酸得分最高(2.0),表明此位点疏水性最强;在第476位氨基酸得分最低(-3.0),表明此位点的亲水性最高。该蛋白的疏水性平均得分为-0.34,因此推测其属于亲水性蛋白(图2A)。二级结构预测显示,ADAR2共含有α-螺旋(28.0%)、β-折叠(13.9%)和无规则卷曲(58.1%)3种 二级结构(图2B)。利用SWISS-MODEL在线软件获得的猪ADAR2三级结构构象由第307~703位氨基酸构成(图2C)。
基于ADAR2的氨基酸序列,应用MEGA-X软件构建系统进化树,以便系统性认识该蛋白在种间的差异。如图3所示,在进化上猪ADAR2与偶蹄目家畜牛、绵羊和山羊的关系最近,与氨基酸的序列一致性分析结果基本吻合。保守结构域预测发现,所有物种的ADAR2都含有2个dsRNA结合基序和1个脱氨酶结构域。猪ADAR2的dsRNA结合基序分别位于第82~146和第239~300位氨基酸,脱氨酶结构域位于第325~701位氨基酸。
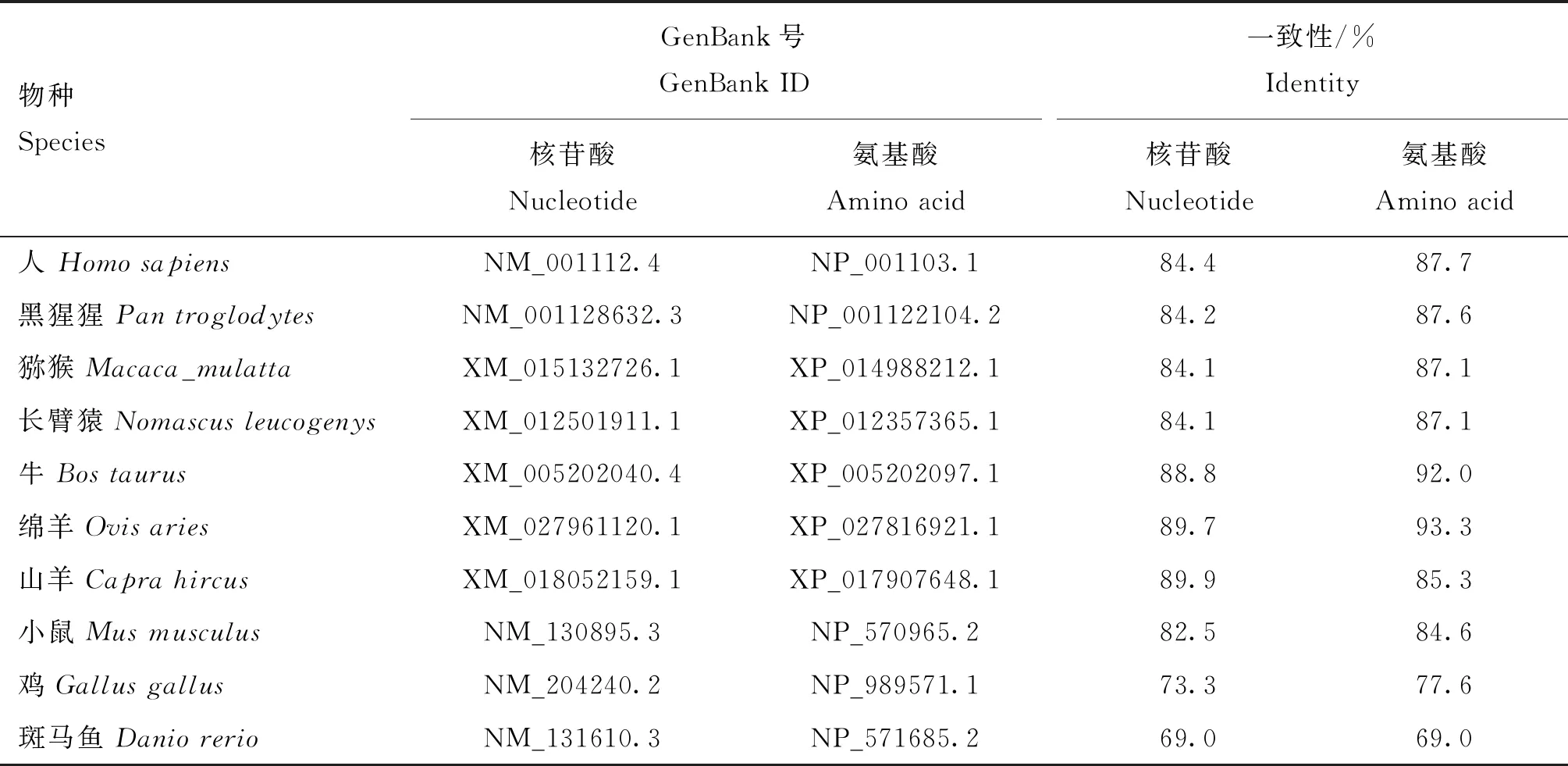
表3 猪ADAR2基因CDS区核酸序列和氨基酸序列与其他物种间的一致性
2.4 猪ADAR2基因的组织表达分析
应用qPCR检测大白猪9种组织中ADAR2的mRNA表达量,结果显示,ADAR2在被检测的所有组织中均表达;在肺中表达量最高,且显著高于其他组织;在心、肌肉和小肠中的表达量都比较低(图4A)。利用RNA-seq数据绘制的ADAR2在不同猪种的组织表达谱表明,猪ADAR2具有高度的表达保守性,其在不同品种间的表达规律基本一致,均在肺中高表达(图4B)。
3 讨 论
随着高通量测序成本的不断下降以及相关分析软件的快速开发,已知的RNA编辑位点数目大幅增加,现已鉴定出450多万个人类的A-to-G编辑位点[18]。ADAR酶催化A-to-G编辑发生,该酶家族主要包括ADAR1、ADAR2和ADAR3。目前,仅发现ADAR1和ADAR2具有脱氨酶催化活性,但有报道称,ADAR3可以通过竞争性结合dsRNA从而抑制ADAR1和ADAR2的催化功能[19]。经查询发现,NCBI数据库中仅有猪ADAR2的不完整预测序列,在一定程度上阻碍了其功能的进一步解析。
通过RACE技术,本研究克隆获得了猪ADAR2 基因的全长cDNA,其长度为6 305 bp,可编码704个氨基酸,与人(701个)、鼠(701个)、鸡(701个)和斑马鱼(707个)的ADAR2氨基酸序列长度比较一致[20]。本研究克隆获得的序列比NCBI中预测的mRNA序列(XM_021071524.1,5 803 bp) 在长度上增加了502 bp,但编码的氨基酸却减少了9个。BLAT分析显示,猪ADAR2基因含有12个外显子,多于NCBI中的预测结果(9个), 并且仅有1对剪接供体和受体不符合GT-AG法则。据统计,哺乳动物中GT-AG剪切位点对占99.24%,GC-AG占0.7%,AT-AC占0.05%[21],说明非GT-AG 的剪切位点虽少但也是存在的。对于ADAR2 CDS区核苷酸序列而言,猪与同为偶蹄目家畜的牛、羊间的一致性最高(>88%),与人和鼠间的一致性也超过80%。ADAR2具有一个核定位信号,其主要位于细胞核中[22-23],与其催化脱氨功能相符,但在未成熟的神经元中却位于细胞质[24]。本研究未在猪ADAR2中预测到任何有利于其穿透细胞膜的跨膜结构和信号肽,但发现与信号肽跨膜功能有关的α-螺旋含量较高[25]。疏水性分析发现,该蛋白亲水性较强,可能有利于其通过亲水性核质交换通道——核孔,由细胞质转运到细胞核,从而对新生成的RNA进行编辑。多个物种间保守结构域的预测显示,ADAR2蛋白在结构上高度保守,均具有2个 dsRNA结合基序和1个脱氨酶活性结构域,其中猪与哺乳动物人、黑猩猩、猕猴、长臂猿、牛、羊和小鼠的序列间具有高度一致性(>84%),表明ADAR2 在哺乳动物中高度保守,推测猪ADAR2也具有RNA编辑的功能。ADAR2蛋白的系统进化树分析发现,猪能够与其他物种聚到一起,为ADAR2的物种间保守性提供支持。
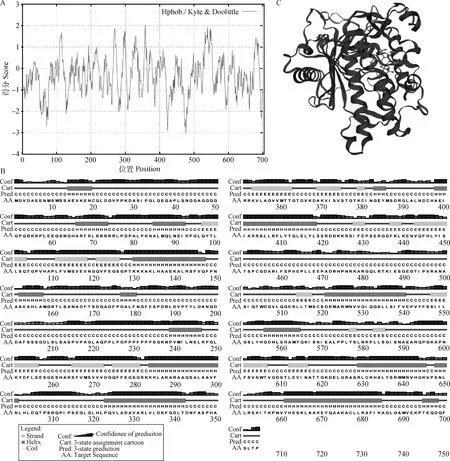
A. 亲疏水性分析;B. 二级结构预测;C. 三级结构预测 A. Hydrophilic-hydrophobic property prediction; B. Secondary structure prediction; C. Tertiary structure prediction图2 猪ADAR2蛋白疏水性与结构分析Fig.2 Hydrophobicity and structure analysis of the porcine ADAR2 protein

自展值和分支长度分别列于节点右侧和分支上侧 The bootstrap values and branch lengths are showed on the right of each node and above each branch, respectively图3 ADAR2系统进化树Fig.3 Phylogenetic tree of ADAR2
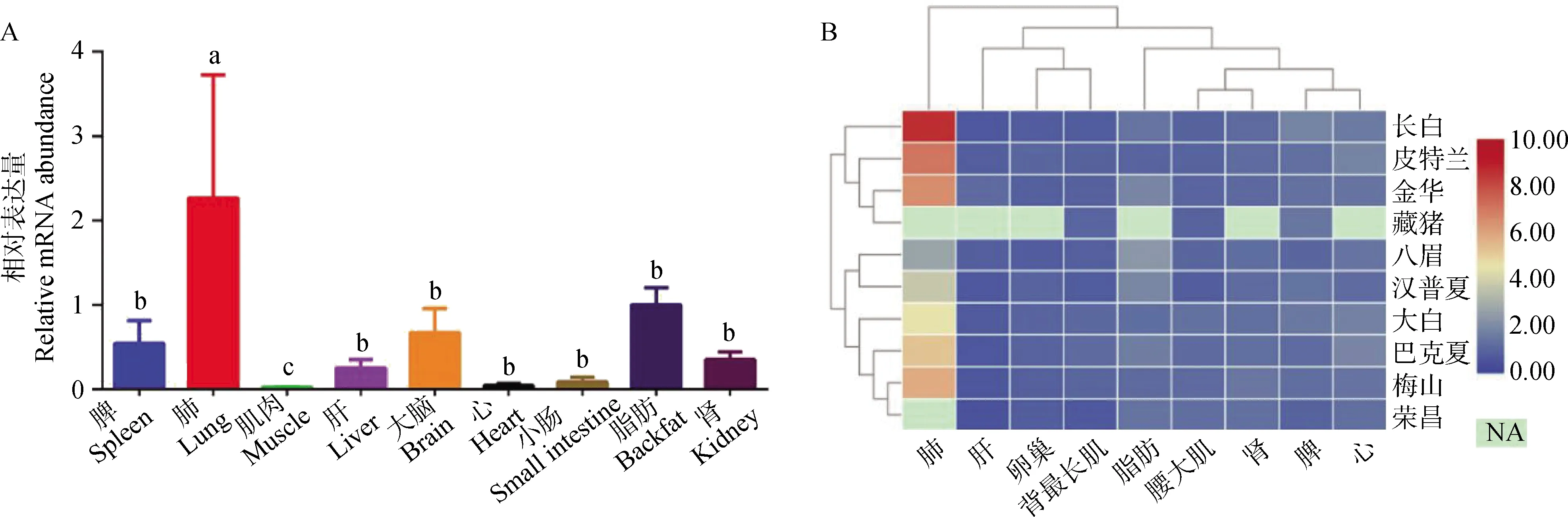
A. ADAR2在大白猪9种组织中的表达分析:字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05);B. ADAR2在不同猪种不同组织的RNA-seq表达差异 A. Expression analysis of ADAR2 in 9 tissues of Large White pigs: the different letters indicate statistically significant difference (P<0.05), the same letter indicates no statistically significant difference (P>0.05); B. The RNA-seq expression difference of ADAR2 in different tissues of different pig breeds图4 猪ADAR2的组织表达分析Fig.4 Tissue expression analysis of porcine ADAR2
ADAR2基因表达于生物体的多种组织,已报道其在大脑中的表达量较高[26]。本研究同样发现,ADAR2 mRNA在检测的9种大白猪组织中均表达,但不同的是其在肺组织中的表达量最高,在鸡中也发现了同样的现象[27],并且该表达模式在猪种间高度保守。ADARs介导的RNA编辑可以将内源性双链RNA标记成“自我”的分子,当外源微生物入侵时,免疫系统能够准确地识别“自我”和“非我”,对入侵病原体的外源RNA启动免疫[28-30]。肺是机体气体交换的重要场所,易受病原微生物感染。同时,前期的研究发现,ADAR1在肺中也高表达[31]。因此,ADAR2在肺中高表达可能是肺部抗感染的需要。
ADAR2既能与自身形成同源二聚体,又可与另一具有催化活性的酶ADAR1形成异质二聚体,其二聚体化可能是催化活性所必需的[32]。对ADARs 底物偏好性研究发现,不同蛋白的RNA底物具有明显差异[33],其中ADAR2主要负责非重复编码区位点的编辑[15]。ADAR2催化的A-to-G编辑通常具有位点特异性,如GluR2 Q/R位点上的A-to-G编辑[34-35],且可以通过自编辑对自身活性进行负调控[36]。ADAR2基因敲除小鼠的生存时间长于ADAR1敲除小鼠,通常在出生数周内死于癫痫[13]。但如果同时将GluR2 Q/R位点上的A变换为G,敲除鼠可继续存活[13],表明该位点的编辑对于个体的生存是必须的。Terajima等[37]报道,在敲除ADAR2的小鼠中,由于RNA编辑的缺失导致生成的内源性miRNA let-7 g减少,从而间接引起靶基因Cry2表达量的上调,表型上出现运动节律缩短,说明ADAR2可以通过调节miRNA的表达影响正常的生理活动。随后的研究发现,ADAR2在光照引起的生物钟相移中发挥重要作用[38]。在正常人的脑胶质细胞中ADAR2极弱表达,但在高恶性胶质瘤中则明显表达[39]。同时,也有研究报道,ADAR2在恶性胶质瘤中的表达量并无明显变化,但酶活性出现下降[40],可能是由于ADAR1与ADAR3表达量提高,与ADAR2竞争性结合编辑底物造成的[41]。ADAR2的失调在癌症的发生发展中具有重要意义,已发现多个ADAR2介导的RNA编辑的缺失与癌症的发展密切相关。因此,还需深入挖掘ADAR2的功能,进一步解析其对人类疾病和畜禽经济性状的作用。
4 结 论
本研究成功克隆了猪ADAR2基因的全长cDNA 序列,其长度为6 305 bp,包含548 bp的5′ UTR,2 115 bp的 CDS,3 616 bp的3′ UTR和一个poly(A)尾巴,共编码704个氨基酸。ADAR2在猪体内广泛表达,且在肺中高表达。本研究结果对进一步探索ADAR2的功能具有重要的理论意义和学术价值。
