杂交组合断奶仔猪腹泻与FUT1基因遗传变异的关联分析
2021-03-30胡瑞举杨明华刘韶娜赵彦光赵素梅
方 晨,郭 飞,胡瑞举,杨明华,张 斌,刘韶娜,黄 英,赵彦光*,赵素梅*
(1. 云南农业大学 云南省动物营养与饲料重点实验室,昆明 650201; 2.云南省畜牧兽医科学院,昆明650224)
断奶仔猪腹泻是由多种因素引起的急性、致死性传染病。肠毒素大肠杆菌(EnterotoxigenicEscherichiacoli,ETEC)F18通过黏附于仔猪小肠黏膜上皮细胞的受体蛋白释放肠毒素,引起仔猪断奶前后腹泻和水肿[1-2]。α(1,2)岩藻糖转移酶基因1(α-1,2-fucosyltransferase gene,FUT1)是调节大肠杆菌F18黏附受体表达的一个候选基因[3],位于猪6号染色体的6q11 区段,与仔猪的腹泻和水肿有关[4-6]。相关研究表明,FUT1基因与猪的腹泻、产仔性能、发育性状等相关[7-14]。
杂交技术作为猪育种的重要手段之一,不仅集合多个猪品种的优势,还可以产生杂种优势,提高品种的生产性能和经济价值。二元杂交指利用两个品种或品系的公母猪进行杂交,简单易行,又称为简单杂交[15]。外来猪种具有瘦肉率高、生长快、屠宰率高等特点,地方猪种在长期驯养中已适应当地气候环境,具有繁殖力高、抗病力及抗逆性强、耐粗饲、遗传力稳定、杂交优势明显等优势特征[16]。迪庆藏猪、滇南小耳猪是云南省优良的地方品种,迪庆藏猪多位于高原严寒地区,滇南小耳猪多生长在热带和亚热带高温潮湿地区,均具有抗逆性强、肉品质好等优点[17-18]。二元猪有明显的杂交优势,生长速度快,育肥效果好[19]。杜滇猪、杜藏猪是以国外引进猪种杜洛克猪为父本,分别以地方猪种滇南小耳猪、迪庆藏猪为母本进行杂交组合获得的二元杂交猪。以地方猪为核心的配套系生产模式既能改善地方猪生产性能偏低的问题,又能有效地保护珍稀地方猪种遗传资源,保留地方猪优良特性,是兼顾市场与遗传资源保护的重要举措[20]。
标记辅助选择法(marker-assisted selection,MAS)为猪抗病性状的选育提供了一种新的方法,利用影响抗病性能的主效基因进行分子标记辅助育种是提高抗病力性状遗传进展的有效途径[21]。本试验以杜滇、杜藏和杜洛克断奶仔猪为研究对象,通过研究FUT1基因多态性与断奶仔猪腹泻的关系,探究与抗病育种相关的候选基因和遗传标记,为选育优良的抗病猪种提供一定的理论依据,减少抗生素在临床上的使用并有效控制病发率,提高仔猪成活率,增加养殖业经济效益。
1 材料与方法
1.1 试验动物
试验在云南省畜牧兽医科学院养猪与动物营养研究所猪场进行,选择35日龄8 kg左右体重的断奶仔猪365头,其中杜藏猪(杜洛克猪♂×迪庆藏猪♀)113头、杜滇猪(杜洛克猪♂×滇南小耳猪♀)165头、杜洛克猪(杜洛克猪♂×杜洛克猪♀)87头。
1.2 试验日粮及饲养管理
试验日粮配方参照中国猪饲养标准,日常饲养管理及试验步骤均按照动物伦理委员会制定的《实验动物伦理与使用指南》执行。
1.3 样品采集
试验猪出生后1 d内采集耳组织,并放入装有酒精的2 mL离心管中,-80 ℃冰箱保存。
1.4 腹泻统计
试验期为14 d,每天观察断奶仔猪腹泻情况,记录腹泻头数,统计轻、中、重度腹泻率、总腹泻率和腹泻指数。
根据粪便评分标准记录腹泻情况:正常情况,粪便干燥记0分;轻度腹泻,软粪且呈形记1分;中度腹泻,粪便液样呈灰色或黄色记2分;重度腹泻,粪便水样呈喷射状记3分。
腹泻率的计算:腹泻率=试验期腹泻仔猪头次/(试验仔猪头数×试验天数)×100%;腹泻指数=稀便率×平均稀便级(稀便率为每只断奶仔猪所排的稀便数与总便数之比。稀便级表示每只断奶仔猪稀便的程度)。
1.5 基因组DNA提取
参照试剂盒(北京天根生化科技有限公司)说明书进行DNA的提取。采用1%琼脂糖凝胶电泳检测DNA质量,核酸浓度检测仪测定基因组DNA浓度,并稀释到50 ng·μL-1,-20 ℃保存备用。
1.6 引物设计及合成
根据猪FUT1基因的全序列(GenBank登录号:NC_010448.4),用Primer3在线软件(http://primer3.ut.ee/)设计引物(表1),设计的引物由Invitrogen公司合成。
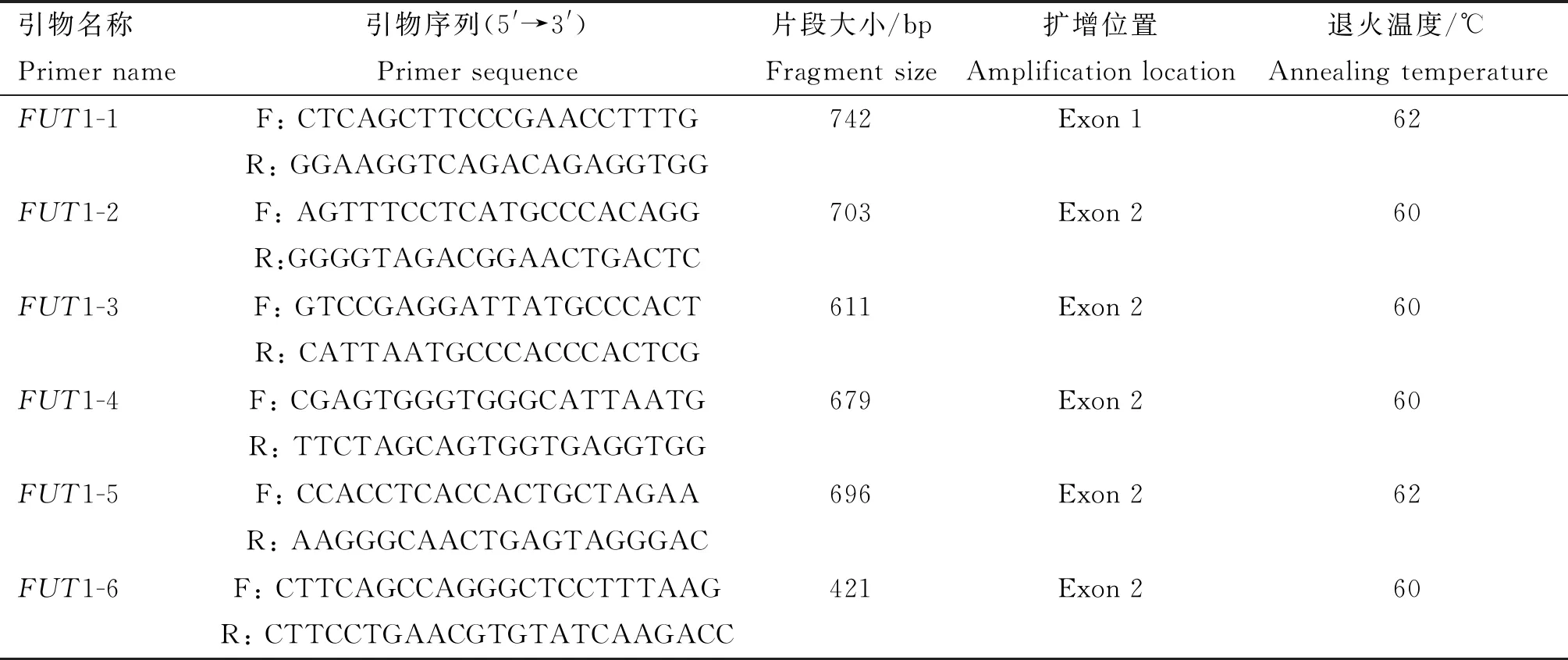
表1 FUT1基因分段扩增引物
1.7 PCR扩增及测序
PCR扩增反应体系20 μL:Template(10×)2 μL, 上、下引物(10 μmol·L-1)各1 μL,2×Taq PCR Master Mix(10 mmol·L-1)12.5 μL(擎科生物有限公司),ddH2O 3.5 μL。PCR产物由通用生物公司测序,FUT1基因PCR反应条件:94 ℃预变性5 min;94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸1 min,40个循环;72 ℃延伸7 min。
1.8 统计分析
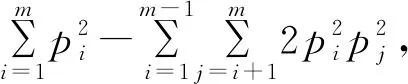
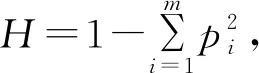
2 结 果
2. 1 PCR扩增产物检测
PCR产物用1.5%琼脂糖凝胶电泳检测。FUT1基因扩增产物条带单一、清晰明亮,与预期片段大小相符,符合DNA 测序的要求(图1)。
2.2 FUT1多态位点检测及基因型判定
将6段测序序列拼接,得到FUT1基因全长3 045 bp。 将测序结果与猪FUT1基因全序列比对,共发现4个SNPs位点,3个突变位点发生错义突变。其中,第一外显子18 bp处碱基T→C(T18C),存在CT和TT 2种基因型;第二外显子中,229 bp碱基C→T(C229T),亮氨酸转变为苯丙氨酸,有CC、CT和TT 3种基因型;2 418 bp碱基C→A(C2418A),亮氨酸转变为甲硫氨酸,为CC、CA 2种基因型;306 bp碱基A→G(A306G),苏氨酸转变为丙氨酸,有AA、AG和GG 3种基因型。
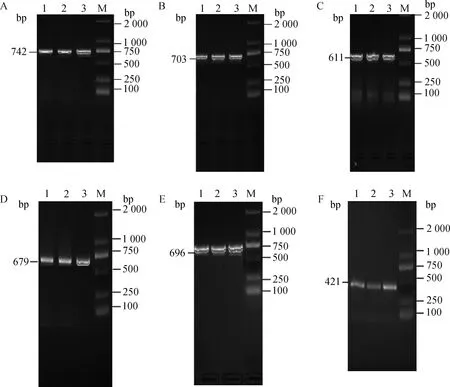
M. DNA相对分子质量标准;A、B、C、D、E、F. FUT1-1、2、3、4、5、6 PCR扩增产物 M.D2000 Marker; A, B, C, D, E, F. PCR amplification products of FUT1-1, 2, 3, 4, 5 and 6, respectively图1 FUT1基因PCR扩增产物结果Fig.1 Results of PCR amplification products of FUT1 gene
2.3 FUT1基因型频率和等位基因频率分析
多态性和杂合度方面,4个突变位点均为中度。χ2适合性检验结果表明,除T18C位点、杜藏猪的C2418A位点外,其他突变位点均处于Hardy-Weinberg平衡状态(P>0.05)。T18C位点处,杜藏猪、杜滇猪CT基因型频率最高,杜洛克猪TT型最高;C229T位点上,杜藏猪和杜滇猪均以TT为主要基因型,杜洛克猪以CT为主要基因型;杜藏猪C2418A位点的AC和CC基因型频率相同,杜滇猪和杜洛克猪CC基因型为优势基因型;A306G位点与C229T位点基因型频率和等位基因频率数值一致,可能存在遗传关联反应(表2)。
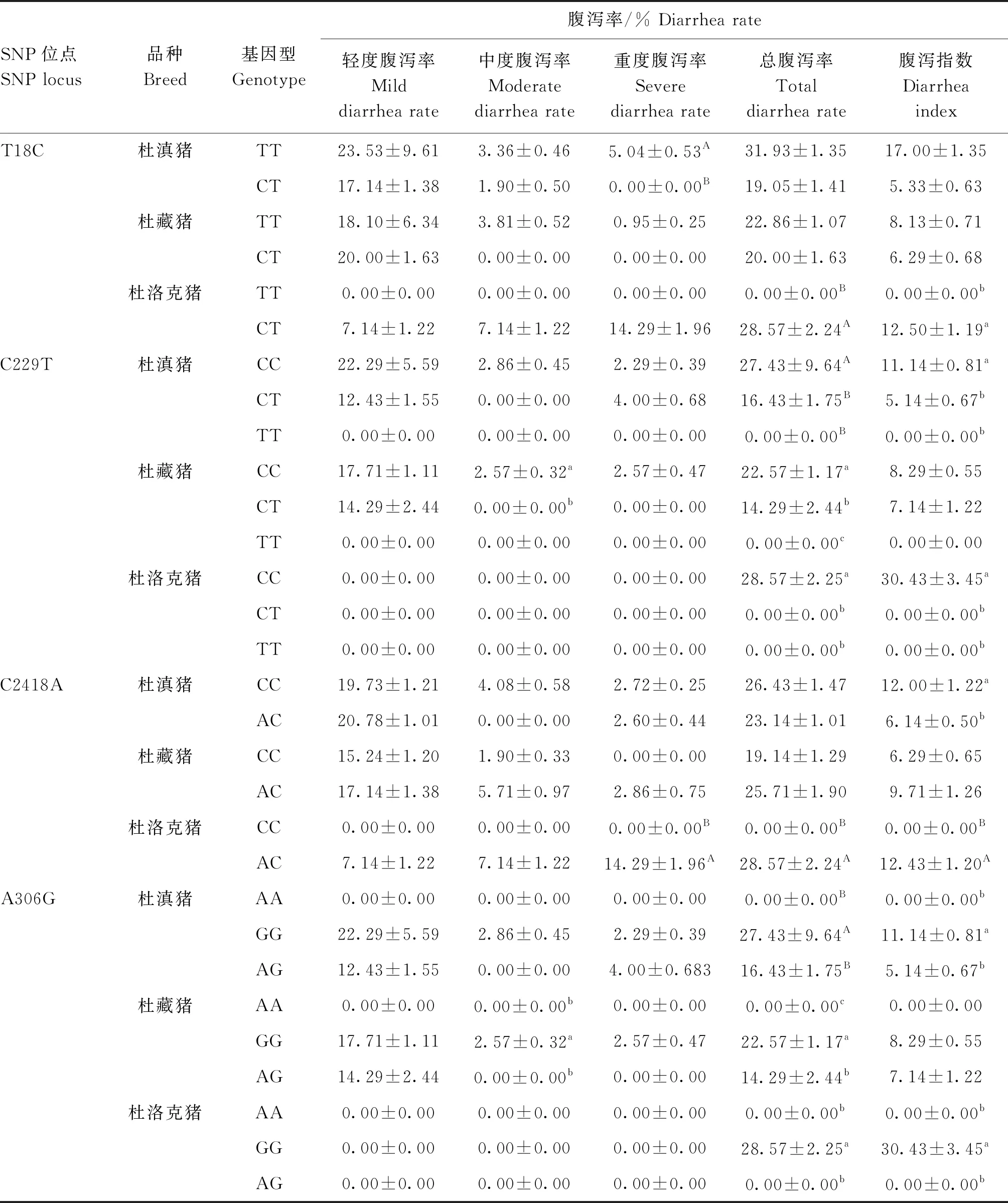
2.4 FUT1突变位点基因型与腹泻率关联性分析
T18C位点中,杜滇猪、杜藏猪TT基因型的各项腹泻指标(除杜藏猪的轻度腹泻率外)均高于CT型,但杜洛克猪CT型的各项腹泻指标均高于TT型,其中的总腹泻率差异极显著(P<0.01);C229T位点处,除了杜滇猪的重度腹泻率,其他猪CC型的腹泻指标均高于CT、TT型,其中的总腹泻率呈显著差异(P<0.05);在C2418A位点,除杜滇猪外,其余两种猪AC型的腹泻指标均高于CC型,杜洛克猪部分指标为差异极显著(P<0.01);A306G位点与C229T位点的腹泻指标结果相同,可能存在关联反应(表3)。
3 讨 论
遗传和环境两大因素会共同导致动物疾病的发生[22]。个体对环境中致病因子易感性(或抗性)的遗传基础为基因组结构差异或者其表达水平的差异[23]。罗艳茹[24]发现,长白、大白和松辽黑猪在FUT1基因第307位均存在多态,检测到GG、AG和AA 3种基因型,G为优势等位基因,且3种基因型之间存在差异。朱弘焱等[25]研究发现,荷包猪、长白猪、大白猪、大长杂交猪的FUT1 基因型分布趋势为AA 表2 杜藏猪、杜滇猪和杜洛克猪FUT1基因SNP位点的基因型分布和等位基因频率 表3 FUT1基因多态性位点各基因型的腹泻率结果 断奶仔猪易患腹泻和水肿病,是引起断奶仔猪死亡的重要病因[26]。猪肠毒素型大肠杆菌引起的仔猪腹泻和水肿病是由于大肠杆菌F18的两个亚基黏附在其小肠黏膜上皮细胞上并产生肠毒素而引起的[27-30]。吴圣龙等[31-32]证实,FUT1基因的M307位点多态性与断奶仔猪腹泻和水肿病存在直接的相关性,且抗病性AA基因型不仅对断奶仔猪腹泻具有抗性,且具有较高的一般抗病性。FUT1基因第307 bp的碱基G突变为A,发生错义突变,导致其编码产物第103位氨基酸由丙氨酸变为苏氨酸,使该酶活性发生改变,抑制ETEC F18黏附仔猪小肠,因此FUT1基因AA基因型的猪能抵抗ETEC F18感染,AG和GG基因型的猪则易感。周利华等[33]通过对10个国内外猪种FUT1基因新cSNPs的鉴别以及仔猪抗大肠杆菌F18侵染研究,发现 M229C/T和M714T/C两个位点,M714位点为同义突变,M229位点引起亮氨酸转变为苯丙氨酸,FUT1基因M229位点可能是决定中国地方猪水肿与腹泻病的变异位点,这与本研究结果一致。除了C229T突变位点外,本试验还发现了T18C、C2418A、A306G 3个新突变位点,可能是影响猪抗腹泻病的关键位点。C2418A、A306G也引起氨基酸变化,可能会造成FUT1酶活性改变,进而控制猪肠毒素大肠杆菌F18对仔猪小肠的黏附。T18C、C229T、C2418A、A306G位点作为标识断奶仔猪腹泻的分子标记需进一步深入研究。 FUT1基因对断奶猪腹泻的影响程度因品种或品系的不同而有所差异[34-40]。杜滇猪、杜藏猪作为杂交猪,其T18C位点的中、重度腹泻率均值,C229T和A306G位点的腹泻指数均值以及C2418A位点的重度腹泻率均值均低于外来猪种杜洛克猪,呈现一定的杂种优势和较好的抗病力。通过研究3种断奶仔猪FUT1基因多态性与腹泻的关系发现,其FUT1基因SNP位点的不同基因型对腹泻的影响存在差异。T18C位点TT基因型的杜滇和杜藏杂交猪、C229T位点的CC基因型、C2418A位点的CA基因型和A306G的GG基因型的3种猪腹泻程度相对较严重,对 ETEC F18敏感,呈显性遗传,其他基因型表现为抗性,呈隐性遗传。后期可在育种时关注抗性基因型个体的引入,期望提高该品系仔猪抗腹泻病的性能。 品种和FUT1基因多态性对断奶仔猪腹泻的影响有一定的差异性和相关性。地方杂交组合杜滇猪、杜藏猪和杜洛克猪FUT1基因存在4个突变位点,均处于中度多态和杂合度,遗传变异较为丰富。突变位点中3个为错义突变,可能是决定猪群抗腹泻病的关键位点,后续可继续深入研究其相关编码蛋白结构功能,为分子抗病育种提供更坚实的理论基础。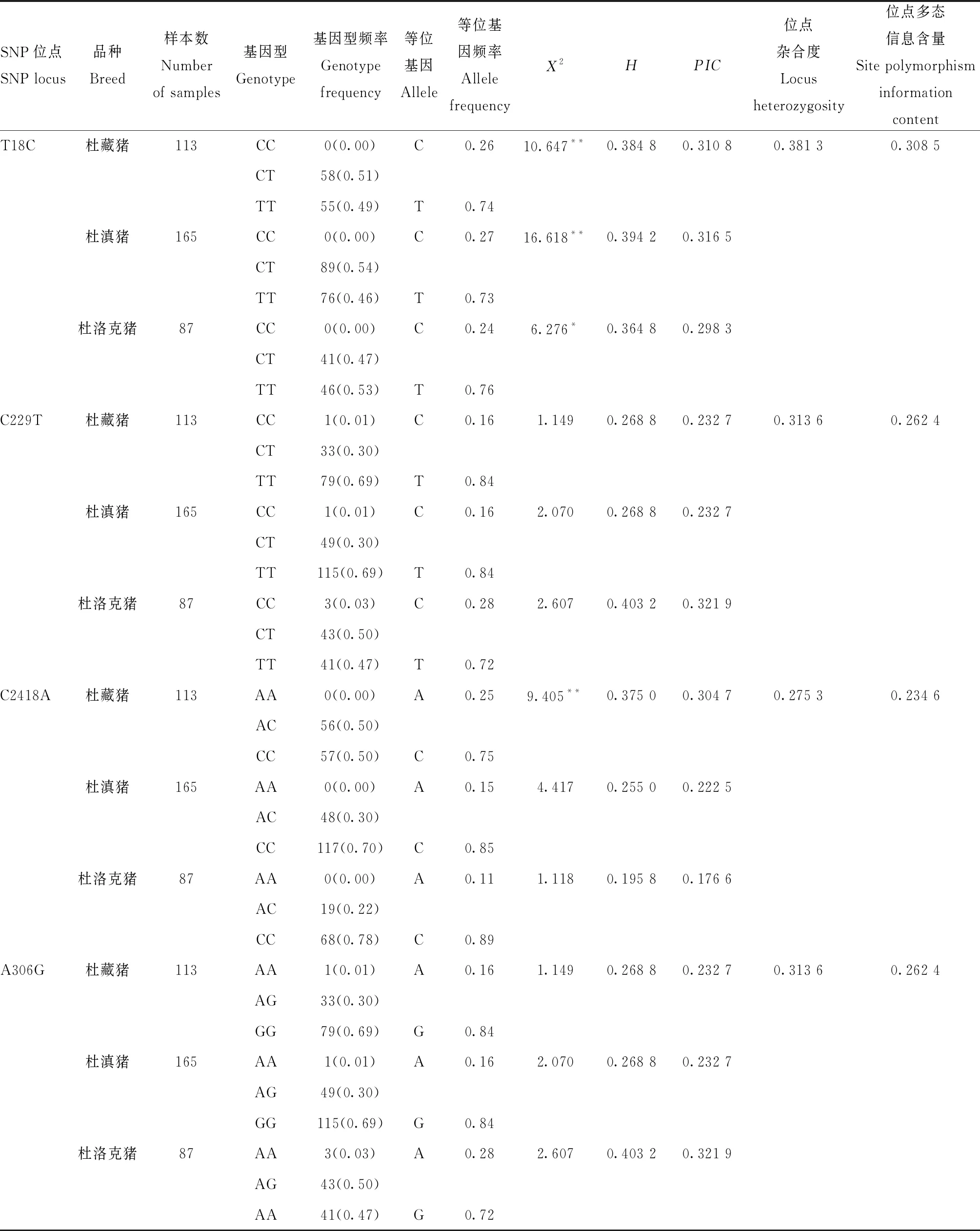
4 结 论
