响应面法优化椴树蜂蜜蛋白提取工艺
2021-03-30谢博傅红杨方
谢博,傅红,杨方
(1.海军勤务学院,天津 300450;2.福建出入境检验检疫局检验检疫技术中心,福建 福州 350001;3.福州大学生物科学与工程学院,福建 福州 350108;4.福州大学福建省海洋酶工程重点实验室,福建 福州 350108)
蜂蜜(honey)是蜜蜂将自己的唾液与采集的花蜜或昆虫排泄物中获取的蜜露混合,在巢脾内酿造而成的天然甜味物质,具有抗诱变、抗炎、美容养颜等多种营养和生物活性[1-3]。其成分丰富,除了含有大量的糖和芳香物质、有机酸等200多种生物活性物质之外,还含有蛋白质、氨基酸、酶等蛋白类物质[4-6]。蜂蜜蛋白类物质来源于蜜源植物或者蜜蜂本身,包括蜜蜂唾液腺和咽的分泌物、花蜜以及花粉,含量大约为0.1%~0.5%[2,7]。一般来说,蜂蜜中的氮含量很低,平均含量只有0.04%,其中40%~65%来源于蛋白质,剩余的氮含量主要来源于游离氨基酸,以脯氨酸、谷氨酸、丙氨酸等7种氨基酸最常见[8-9]。研究表明,蜂蜜蛋白具有抗菌、抗氧化、生长抑制、提高免疫力等多种生物活性,且由于不同来源的蜂蜜所含蛋白不同,其已成为鉴定蜜源的重要依据之一[1,10-11]。因此,对于蜂蜜蛋白的研究越来越成为学者热衷的研究方向之一。
目前提取蜂蜜蛋白质的方法主要是有机溶剂沉淀法以及盐沉淀法[10,12-13]。周莉质等选取了三氯乙酸-丙酮法、钨酸钠沉淀法、硫酸铵沉淀法、尿素-硫脲法4种方法,探讨适合双向电泳的最优方法,尿素-硫脲法所得电泳图谱更为清楚[14]。MOHAMMED等采用80%硫酸铵沉淀蜂蜜蛋白,进而研究蜂蜜与蜜源的关系[15]。Rückriemen等采用三氯乙酸沉淀法提取麦卢卡蜂蜜蛋白,研究麦卢卡蜂蜜和非麦卢卡蜂蜜的荧光性质[12]。KATRINA等采用琼脂糖固定化的手段分离蜂蜜中的糖蛋白,所得蛋白进行抗菌活性研究[10]。综合来看,学者们仅是采用相应的蜂蜜蛋白提取方法进行蜂蜜蛋白提取,而对蜂蜜蛋白提取工艺的优化研究较少,且蜂蜜蛋白是研究蜂蜜特性的基本物质之一,其得率直接影响后续试验。因此,为对蜂蜜蛋白研究提供基础,本研究应用响应面法对蜂蜜蛋白提取条件进行优化。
首先对比三氯乙酸沉淀法、乙醇沉淀法、硫酸铵沉淀法沉淀椴树蜂蜜蛋白的蛋白含量,然后选择较优方法进行单因素试验,并采用响应面法对该方法沉淀椴树蜂蜜蛋白进行工艺优化,得出椴树蜂蜜蛋白提取最佳条件,为椴树蜂蜜蛋白的深入研究提供理论基础和试验依据。
1 材料与方法
1.1 材料与仪器
三氯乙酸(trichloroacetic acid,TCA)、丙酮、乙醇、磷酸、氢氧化钠、硫酸铵(均为分析纯):国药集团化学试剂有限公司;考马斯亮蓝G-250、牛血清蛋白:上海麦克林生物公司;其余试剂均为国产分析纯,所有溶液均以Milli-Q超纯水系统制备的超纯水为溶剂;蜂蜜为椴树蜜:北京中蜜科技发展有限公司。
1.2 仪器与设备
CR21N台式冷冻离心机:日立公司;88880018漩涡混合器:Thermo Scientific公司;UV-2700紫外-可见分光度计:岛津仪器有限公司;Kjeltec 8400全自动定氮仪:FOSS公司;FreeZoneTriadTM2.5L冷冻干燥机:美国LABCONCO公司。
1.3 方法
1.3.1 蜂蜜蛋白质提取
1.3.1.1 三氯乙酸沉淀法
称取蜂蜜10.0 g溶于20%TCA水溶液中,将样品在-20℃下保存30 min以使蜂蜜蛋白沉淀,沉淀后的溶液于5 000 r/min,4℃离心10 min,去除上清液,沉淀用10 mL超纯水洗涤,再次离心。重复洗涤步骤,将最终的沉淀物溶解在2 mL超纯水中,冷冻并随后冻干[12]。
1.3.1.2 硫酸铵沉淀
将10.0 g蜂蜜溶解在10 mL缓冲液(20 mmol/L Tris-HCl,100 mmol/L NaCl pH 7.5)中,并在 5 000 r/min,4℃下离心10 min以除去花粉粒。上清液用浓度为80%的硫酸铵在4℃下沉淀1 h,并以5 000 r/min,4℃离心10 min,收集蛋白质沉淀物并溶解在超纯水中,透析24 h后冻干备用[15]。
1.3.1.3 乙醇沉淀法
取10.0 g蜂蜜溶解在10 mL超纯水中,混匀并在4℃预冷;4℃条件下,向混匀的蜂蜜溶液中加入-20℃冷乙醇20mL,在冰浴上持续温和地搅拌10min~15min,5 000 r/min,4℃离心10 min,弃去上清液并吸净残留液,所得沉淀即为蜂蜜蛋白质,沉淀复溶于超纯水中,冻干备用[16]。
1.3.2 蛋白质含量测定
总蛋白含量参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》采用凯氏定氮法。采用考马斯亮蓝法(Bradford)测定提取物中蛋白质含量[17]。蜂蜜蛋白含量按式(1)计算。
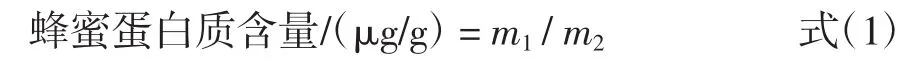
式中:m1为提取物中蛋白质总质量,μg;m2为蜂蜜质量,g。
1.3.3 蜂蜜蛋白提取单因素试验
以提取方法所得蜂蜜蛋白质含量为评价指标,比较不同因素对蜂蜜蛋白提取效果的影响。按料液比1∶2(g/mL),提取时间20 min,考察不同TCA浓度(10%、20%、30%、40%、50%)对蛋白提取的影响;料液比1∶2(g/mL),TCA浓度20%,考察不同提取时间(10、20、30、40、50 min)对蛋白提取的影响;提取时间30 min,TCA浓度20%,考察不同料液比[1 ∶1、1 ∶2、1 ∶3、1 ∶4、1∶5(g/mL)]对蛋白含量的影响。每组试验重复3次。
1.3.4 响应面优化试验
以单因素试验得到的初步试验结果为基础,利用软件Design Expert 8.05 Box-Behnken的中心组合原理,选取对蜂蜜蛋白提取影响较大的3个因素料液比(A)、TCA浓度(B)和提取时间(C)进行三因素三水平试验,由此得出蜂蜜蛋白提取的最佳工艺条件。具体试验因素和编码水平见表1。
1.4 数据处理
采用 OriginPro9.0、Design-Expert 8.0.6 Trial进行数据处理与分析。
2 结果与分析
2.1 不同蜂蜜蛋白提取方法的选择
利用考马斯亮蓝法测定蛋白质含量的标准曲线方程为 Y=0.0107X+0.0643(R2=0.987),其中 X(μg/mL)为牛血清蛋白的浓度,Y(Abs)为吸光度。蜂蜜中总蛋白含量经凯氏定氮法测定为(0.16±0.03)g/100 g。
图1显示了TCA沉淀、乙醇沉淀、硫酸铵沉淀3种提取方法对蜂蜜蛋白提取的不同效果。
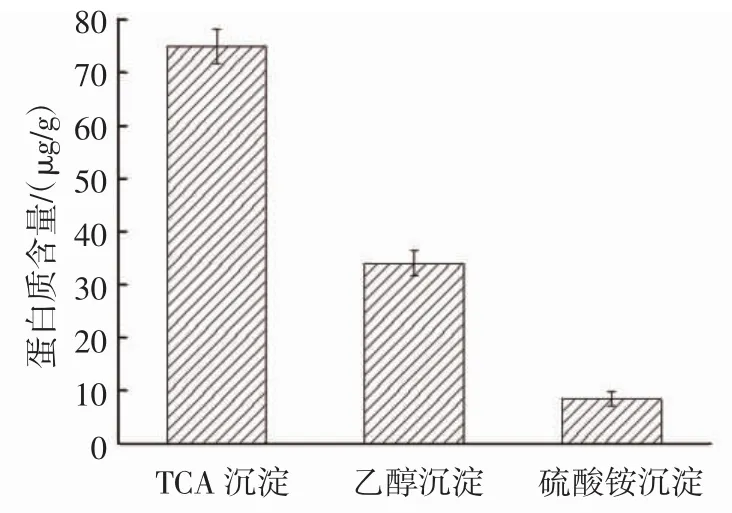
图1 不同提取方法提取蜂蜜蛋白质Fig.1 Extraction of honey protein by different extraction methods
3种提取方法中TCA沉淀法所得蛋白质含量较高,为 75.12 μg/g,且耗时短,乙醇沉淀次之,为 34.01 μg/g,硫酸铵沉淀所得蛋白质最少,为8.42 μg/g。蜂蜜蛋白部分为糖蛋白,糖蛋白中糖键具有高度亲水性,因此在水溶液中更易溶解,但硫酸胺难以使一些含糖丰富的糖蛋白沉淀[18]。而糖蛋白在三氯乙酸中溶解性更好,因此选取TCA沉淀法作为响应面优化的目标方法。
2.2 单因素试验结果
提取时间对蜂蜜蛋白提取的影响见图2。

图2 提取时间对蜂蜜蛋白提取的影响Fig.2 Effect of extraction time on honey protein extraction
蜂蜜蛋白的含量会随着提取时间的延长呈现出先增加后减少的趋势(图2)。20 min所得蛋白质含量最多,这可能是因为由于提取时间越长,有利于蜂蜜中的蛋白质溶解在溶剂中,但随着提取时间延长,TCA溶液在-20℃会变为固体,影响蛋白质的沉淀行为且蛋白质沉淀也相对完全或发生变性降解等其它变化,导致提取的蛋白质含量变少[19]。结果表明,提取时间20min时,蜂蜜蛋白含量最大为96.55 μg/g,因此选取20 min作为响应面法优化蜂蜜蛋白提取时间的中心点。
TCA浓度对蜂蜜蛋白提取的影响见图3。

图3 TCA浓度对蜂蜜蛋白提取的影响Fig.3 Effect of TCA concentration on honey protein extraction
在5%~10%的浓度范围内,所提蜂蜜蛋白质含量与三氯乙酸浓度呈正相关,三氯乙酸浓度达到10%时,所提蛋白质含量最多,随后蛋白质含量逐渐降低(图3)。三氯乙酸通过改变pH值而使蜂蜜蛋白变性,聚集沉淀,10%的三氯乙酸恰好可以使蜂蜜蛋白完全沉淀,浓度过大,会沉淀不同分子量的蛋白质,使得沉淀蛋白变少[16]。因此将10%的TCA浓度作为响应面法优化TCA浓度的中心点。
料液比对蜂蜜蛋白提取的影响见图4。

图4 料液比对蜂蜜蛋白提取的影响Fig.4 Effect of feed-liquid ratio on extraction of honey protein
随着溶剂增多,所提蛋白质含量逐渐增加,在料液比达到1∶2(g/mL)时,所提蛋白质含量最多,随后所提蛋白质含量逐渐降低(图4)。这可能是因为溶剂增多会使蛋白质充分溶解沉淀,但溶剂过大,提取溶剂量的增加会使蜂蜜蛋白浓度降低,聚集沉淀困难[20]。结果表明,料液比对于蜂蜜蛋白沉淀影响较大,且1∶2(g/mL)时所提蛋白最多,损耗蜂蜜较少,因此,选取1∶2(g/mL)作为响应面法优化料液比的中心点。
2.3 响应面试验结果
综合单因素试验结果,以蛋白质含量Y为响应值,料液比(A)、TCA 浓度(B)、提取时间(C)这 3个因素进行响应面试验,所得结果见表2。

表2 蜂蜜蛋白提取响应面试验结果Table 2 Response surface test results of honey protein extraction
由表2可以看出,蜂蜜蛋白的含量范围在56.31 μg/g~101.88 μg/g,料液比 1 ∶2(g/mL),TCA 浓度10%,提取20 min所得蜂蜜蛋白最多。利用Design-Expert 8.0.5b数据处理软件对表2所列蜂蜜蛋白提取响应面试验结果进行二次响应面回归分析,所得拟合方程为:Y=98.73-4.10A-4.16B+3.26C-6.83AB-0.20AC-0.045BC-18.42A2-8.10B2-4.51C2。
方差分析及可信度分析见表3。

表3 回归模型方差及可信度分析Table 3 Analysis of variance and reliability of regression model
从表3中可分析建立的蜂蜜蛋白提取回归模型的可信度。从该回归方程的失拟项(P=0.687 4>0.05),P 值(P<0.000 1)、F 值(47.54)、拟合系数(98.39%)、变异系数(2.86)、信噪比(22.570)可以看出,该方程的拟合度较好,模型显著且该模型响应信号强,因此由响应面建立的回归方程模型可以用来优化蜂蜜蛋白的提取[21]。所得模型的显著性检验结果经方差分析显示,A(料液比)、B(TCA浓度)、C(提取时间)和 AB、A2、B2、C2对蜂蜜蛋白的提取均有极显著的影响(P<0.01)。A(料液比)、B(TCA浓度)、C(提取时间)的F值分别为23.31、23.97、14.69,由此得出3个因素对蜂蜜蛋白提取的影响主次顺序:B(TCA 浓度)>A(料液比)>C(提取时间)。
2.4 响应面交互作用试验结果
料液比和提取时间对蜂蜜蛋白提取的交互作用,见图5,料液比和提取时间对蜂蜜蛋白提取的交互作用见图6,三氯乙酸浓度和提取时间对蜂蜜蛋白提取的交互作用见图7。
从响应面的三维效应图和等高线图中可以看出料液比、TCA浓度以及提取时间的交互作用对蜂蜜蛋白提取的影响。三维效应图中影响因素所对应的曲线坡度越大,等高线越密集,且呈现椭圆状,则表明该因素值的改变对蜂蜜蛋白含量的影响越大[22]。从图5、图6、图7的三维效应图和等高线图中可以看出,曲面存在最高点,即等高线的圆心处,为条件最大值;A(料液比)与B(TCA浓度)交互对蜂蜜蛋白提取影响作用明显,C(提取时间)和B(TCA浓度)交互作用所成等高线图呈近圆形,对蜂蜜蛋白提取影响不显著。

图5 料液比和三氯乙酸浓度对蜂蜜蛋白提取的交互作用Fig.5 Interaction of solid-liquid ratio and TCA concentration on honey protein extraction
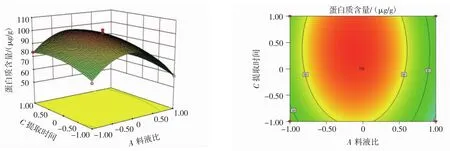
图6 料液比和提取时间对蜂蜜蛋白提取的交互作用Fig.6 Interaction of solid-liquid ratio and extraction time on honey protein extraction

图7 三氯乙酸浓度和提取时间对蜂蜜蛋白提取的交互作用Fig.7 Interaction of trichloroacetic acid concentration and extraction time on honey protein extraction
图5等高线图显示出TCA浓度的变化趋势高于料液比,且三维效应图中也显示出TCA浓度所对应的曲线坡度较料液比陡,说明TCA浓度对蜂蜜蛋白含量的影响比料液比大。图6显示,料液比所对应的曲线与提取时间相比,坡度更陡,所以料液比对蜂蜜蛋白含量的影响大于提取时间,其等高线图也近似圆形,说明料液比和提取时间交互作用对蜂蜜蛋白提取影响不明显。图7等高线为近圆形,表明三氯乙酸浓度和提取时间交互作用不明显,这与表3回归方差分析结果一致。
通过响应面优化得出蜂蜜蛋白的最优提取条件为:TCA 浓度 17.7%,料液比 1∶1.83(g/mL),提取时间37.2 min,蜂蜜蛋白含量最大,理论值为99.94 μg/g。
2.5 验证试验
在上述回归模型所得优化条件下[TCA浓度17.7%,料液比 1 ∶1.83(g/mL),提取时间 37.2 min)],进行蜂蜜蛋白提取的验证试验,进行3次平行试验,见表4。

表4 蜂蜜蛋白提取试验验证结果Table 4 Verification results of honey protein extraction test
由表4可知,蜂蜜蛋白提取量平均值为100.50μg/g,RSD为0.82%,误差较小,说明预测值和真实值拟合性较好,建立的回归方程有良好的预测性。
3 结论
蜂蜜具有抗衰老、美容养颜等功能而广受消费者的喜爱,但目前市场上蜂蜜品质参差不齐,蜂蜜蛋白类物质是近几年发展起来的鉴别蜂蜜真伪的有效目标物,且蜂蜜中含有的酶和蜂王浆主要蛋白(major roy aljelly proteins,MRJPs)更是蜂蜜发挥活性的重要物质[23]。然而,蜂蜜糖含量高,其与蛋白质形成的复合物直接影响蜂蜜蛋白的提取,蛋白质的含量直接关系着后续蜂蜜蛋白质研究[24],因此本文对椴树蜂蜜蛋白提取方法进行了优化。
对比三氯乙酸沉淀、硫酸铵沉淀、乙醇沉淀3种蜂蜜蛋白提取方法可得,三氯乙酸沉淀法所得蜂蜜蛋白含量最高,为75.12 μg/g。单因素试验结果表明,随着料液比的增大、提取时间的增大、TCA浓度的增大,蛋白含量均表现为先增大后减小,料液比1∶2(g/mL)、提取时间20 min、TCA浓度10%时,蛋白的含量最大。通过分析响应面试验结果,A、B、C这3个因素对蜂蜜蛋白提取均有一定的影响,其中B(TCA浓度)影响最大,A(料液比)和C(提取时间)次之,观察所得三维效应图和等高线图发现,料液比和TCA浓度(AB)的交互作用对蜂蜜蛋白的提取有显著的影响。响应面回归模型得出的蜂蜜蛋白提取的最优条件为TCA浓度17.7%,料液比 1 ∶1.83(g/mL),提取时间 37.2 min 时,在此条件下,蜂蜜蛋白含量可达99.94 μg/g。通过3次平行试验验证优化结果,得出了蛋白含量为100.50 μg/g,略高于预测结果,经验证该方法稳定可行,为椴树蜂蜜蛋白的研究提供了科学依据。
