黑曲霉B1401固态发酵茶叶加工废料产单宁酶的研究
2021-03-30肖甜甜胡娜冯子娟吴鑫颖邱树毅
肖甜甜,胡娜,冯子娟,吴鑫颖*,邱树毅
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
单宁酰基水解酶(EC 3.1.1.20),也称单宁酶、鞣酸酶,催化可水解单宁,如单宁的酯键分解,产生没食子酸、葡萄糖、六羟基联苯二甲酸及醇类等物质[1-2]。单宁酶是被美国食品药品监督管理局(Food and Drug Administration,FDA)确认并公布的一种安全的食品添加剂[3],日本等多个国家均已批准将其应用于食品工业,我国卫生部发布的2008年第26号公告中也将单宁酶加入食品添加剂目录[4]。在食品工业中,单宁酶是一种重要的酶,在饮料工业尤其是茶饮料工业中,具有不可替代的作用[5-6]。单宁酶通过水解茶多酚与没食子酸间的酯键,降低茶汤浑浊度、提高茶叶有效成分的溶出、改善茶饮料感官品质。此外,在酿酒行业中,由于多酚物质的存在,会导致产品变质,单宁酶可以降解酚类,使啤酒澄清、改善葡萄酒风味、提高麦芽多酚稳定性、降低果酒和果汁质变的可能性等[4,7]。单宁酶广泛存在于霉菌、酵母、细菌中,通过微生物发酵是获取单宁酶的主要手段,曲霉属真菌(Aspergillus)是当前单宁酶产生菌中被广泛研究并得以生产应用的一类微生物,具有优异的单宁酶合成能力。单宁酶是一种诱导型细胞外酶(诱导酶),利用不同的曲霉菌株,以棕榈仁饼[8]、甘蔗渣和稻草杆[9]、腰果渣[10]等含单宁类物质的产品加工废料为底物,通过固态发酵可提高单宁酶的产量,降低酶的生产成本[1]。因此,作为富含单宁的农产品加工废料是低成本生产单宁酶底物的良好来源。茶叶加工废料中含丰富的单宁,仅茶叶梗中就含18%~36%[11]。同时,茶叶加工废料价格低廉,除单宁外,纤维素和半纤维素等碳水化合物含量丰富,是微生物发酵生产单宁酶的潜在营养物质。与其它研究相比,利用茶叶加工废料的成本较低,单宁酶产率较高[12-13]。开发高酶活、高稳定性、低成本的单宁酶生产工艺,对单宁酶的工业生产和食品工业的发展具有重要意义[14-16]。
贵州作为我国产茶大省,也是世界知名的茶叶原生地和优生区。在制茶过程中的废料大部分都被丢弃,据不完全统计,生产每吨绿茶的废料约30 kg,红茶的废料50 kg,乌龙茶的废料高达400 kg,仅贵州省每年茶叶加工废料达数万吨[17-18]。为避免茶资源的浪费,开发一种茶叶加工废料的综合利用方式具有重要意义。本研究为了开发贵州茶叶生产过程中废料的综合利用价值,采用课题组实验室中前期诱变的菌株黑曲霉B1401[19]固态发酵生产单宁酶,并优化发酵工艺,可获得用于食品工业的低成本的单宁酶产品,开发新型单宁酶的生产原料,奠定食品工业化应用基础。
1 材料与方法
1.1 材料与试剂
黑曲霉 B1401(Aspergillus niger B1401):贵州大学贵州省发酵工程与生物制药重点实验室保藏;茶叶加工废料:贵州省遵义市湄潭县永兴茶厂;尿素、硝酸钠、可溶性淀粉、磷酸氢二钾(均为分析纯):天津市科密欧化学试剂有限公司;培养基:0.3% NaNO3、0.1% K2HPO4·3H2O、0.05% MgSO4·7H2O、0.05% KCl、0.001% FeSO4、1%单宁酸、2%蔗糖、4%琼脂,pH 5.0。产酶发酵培养基:5g茶叶加工废弃物,8mL蒸馏水,于121℃灭菌20 min。
1.2 仪器与设备
分光光度计(721S):上海精密科学仪器有限公司;霉菌培养箱(MJ-160B-II):上海跃进医疗器械厂;高速多功能粉碎机(HC-280T2):永康市绿可食品机械有限公司;立式压力蒸汽灭菌锅(BXM-30R):上海博讯实业有限公司医疗设备厂;pH计(PHS-3C):上海虹谊仪器仪表有限公司;显微镜(ECLIPSE-E200):Nikon公司;高速冷冻离心机(MutlifugeX1R):德国 Themo Scietific Heraeus;恒温培养振荡器(ZWY-111B):上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 黑曲霉B1401孢子菌悬液的制备
参照胡娜等[20]的孢子悬浮液的制备方法,制成孢子菌悬液,经血球计数板镜检,使菌种数达到1.0×108CFU/mL的水平。
1.3.2 固态发酵产酶
1.3.2.1 固态发酵培养
发酵培养基配好后于121℃灭菌20 min,冷却后在无菌条件下接种1 mL黑曲霉B1401孢子悬液,混匀置于30℃培养箱中静置培养96 h。
1.3.2.2 粗酶液的制备
在发酵成熟培养物中加入pH 5.0的柠檬酸缓冲溶液50 mL,搅拌均匀,140 r/min浸提1 h,浸提后的培养基用快速定性滤纸过滤,获得粗酶液。
1.3.3 酶活力测定
酶活力的定义:在40℃,pH 5.0条件下,每分钟内水解底物没食子酸丙酯产生1 μmol没食子酸所需的酶量定义为一个酶活力单位。
酶活力的测定方法:按照保玉心等[21]和胡娜等[20]的方法并做相关改进,根据以下公式进行计算。
酶活力X=(A测定值-A对照)×K×c×200×0.001/(5×5)
式中:X为酶活力,U/g;K为没食子酸标准曲线回归方程的斜率;c为稀释的倍数。200为0.25 mL酶液转换成50 mL总酶液的倍数;0.001为μmol/L变换μmol/mL的倍数;5为单宁酶催化底物反应的时间,min;5为固体发酵培养基的质量,g。
1.3.4 单因素试验
在原料颗粒40目,无机盐离子0.05% K2HPO4、0.1% NaCl、0.1% MgSO4,表面活性剂0.5% Tween-80条件下的培养基中各因素固定值分别为:碳源为0.6%可溶性淀粉、氮源比(尿素 ∶硝酸钠)为 0.7 ∶0.3(g/g)、装载量5 g、发酵温度30℃、发酵时间96 h、液固比为1.8∶1(mL/g)、接种量20%。保持其它6个因素不变,每次改变1个因素,测定酶活,以研究各因素变量与酶活力的关系。
1.3.5 Plackett-Burman试验(PB试验)
Plackett-Burman试验是筛选试验设计,主要针对因子数较多,且未确定众因子相对于响应变量的显著影响,采用的试验设计方法[22]。通过单因素优化结果,对氮源比(A)、可溶性淀粉含量(B)、发酵时间(C)、发酵温度(D)、接种量(E)、液固比(F)、装载量(G)7个因素进行考察,筛选影响单宁酶酶活力的显著性因素。每个影响因素取高低2个水平,以高水平(1)和低水平(-1)表示,以单宁酶酶活力作为评价指标。选用试验次数N=11的Plackett-Burman试验设计,预留4个虚拟项(H、J、K、L)做误差分析,试验重复 3次取平均值,试验因素与水平见表1。

表1 PB试验因素水平Table 1 The level of experiment factors of PB test
1.3.6 Box-Behnken响应面优化试验(BB试验)
根据PB试验结果,筛选出氮源比、可溶性淀粉含量、发酵时间这3个影响单宁酶酶活力的显著性因素。以这3个因素为自变量,单宁酶酶活力为响应值进行Box-Behnken响应面试验。试验因素与水平见表2。

表2 BB试验因素水平Tabel 2 The level of experimental factors of BB test
1.3.7 验证试验
对响应面法得到的最优组合条件进行验证,设置5组平行验证试验,验证模型的有效性。
1.3.8 数据处理
所有试验数据均重复3次,Origin 8.6软件作图,多重比较 (Duncan氏新复极差检测)相关统计利用SPSS17.0和Design-expert(version 8.0.6.1)分析软件进行数据分析处理。
2 结果与分析
2.1 单因素试验结果
氮源比例对黑曲霉B1401产单宁酶的影响见图1。
由图1可知,当尿素与硝酸钠的比例逐渐增大时,单宁酶酶活力先增加后减少,当比例为0.7∶0.3(g/g)时,单宁酶酶活力达最大值26.82 U/g。所以选择尿素与硝酸钠的比例为0.7∶0.3(g/g)作为培养基的氮源。
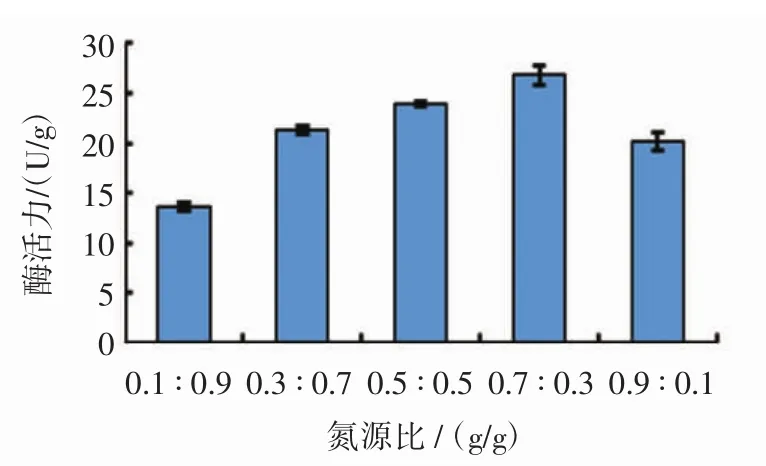
图1 不同氮源比例对黑曲霉B1401产单宁酶的影响Fig.1 Effect of different nitrogen source proportion on tannase produced by Asp.niger B1401
可溶性淀粉含量对黑曲霉B1401产单宁酶的影响见图2。

图2 不同可溶性淀粉含量对黑曲霉B1401产单宁酶的影响Fig.2 Effect of different soluble starch concents on tannase produced by Asp.niger B1401
由图2可知,菌株在低含量的可溶性淀粉条件下酶活力很弱,随着可溶性淀粉含量的增加,菌株产酶呈现增长趋势。当可溶性淀粉含量达0.5%时,菌株B1401产酶活力为17.43 U/g。继续增加可溶性淀粉含量,酶活力反而降低,这可能是因为碳源的含量过高,容易出现抑制效应,阻碍单宁酶的合成。适宜的碳源含量有利于微生物的生长和产酶。所以最终选择0.5%的可溶性淀粉作为培养基的碳源。
装载量对黑曲霉B1401产单宁酶的影响见图3。
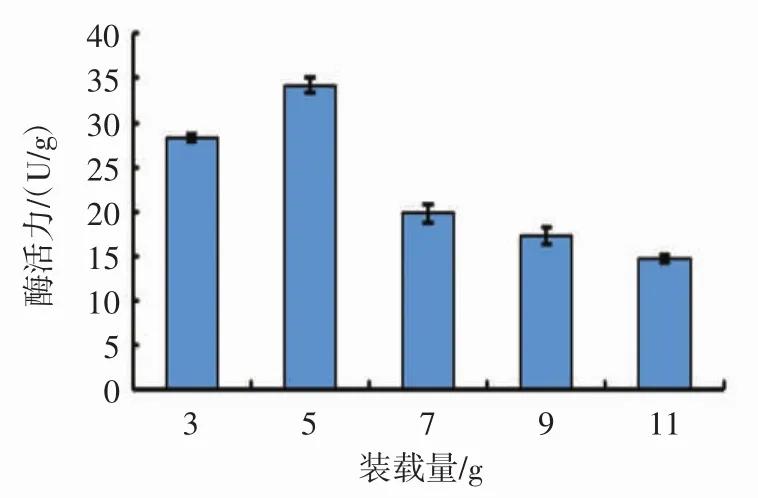
图3 装载量对黑曲霉B1401产单宁酶的影响Fig.3 Effect of different medium contents on tannase produced by Asp.niger B1401
由图3可知,随着装载量的增加,单宁酶酶活力逐渐下降。三角瓶中的装载量与装载厚度会直接影响培养基中氧气的供应及内部温度。适量的供氧能促进本试验菌株对单宁酶的合成,同时少的装载量能加快培养基内部热量的散发,防止温度太高而致使菌体生长缓慢而影响产酶。但装载量过小,降低了设备利用率,不利于控制温度和湿度。在生产过程中可以通过加强通风和补水来提高酶活的产量。所以最终选培养基装载量为5 g进行后续试验。
发酵时间对黑曲霉B1401产单宁酶的影响见图4。

图4 发酵时间对黑曲霉B1401产单宁酶的影响Fig.4 Effect of different fermentation time on tannase produced by Asp.niger B1401
由图4可知,随着发酵时间的延长,单宁酶活力先升高后下降。当发酵时间达到96 h时,单宁酶的活力达到最大值33.64 U/g。这是由于在发酵早期时,孢子开始萌发,菌丝体逐渐形成,此时微生物生长速度缓慢,因而产酶量较低。随着发酵时间的延长,酶活力逐渐上升。但继续培养,发酵液中碳氮源及其它微生物生长所需的营养物质慢慢被消耗,菌体会开始出现衰老,在后期菌株甚至出现自溶现象,进而影响产酶。所以选择发酵时间为96 h。
发酵温度对黑曲霉B1401产单宁酶的影响见图5。

图5 发酵温度对黑曲霉B1401产单宁酶的影响Fig.5 Effect of different fermentation temperature on tannase produced by Asp.niger B1401
由图5可知,发酵温度为30℃时,单宁酶的活力达到最大值31.59 U/g。发酵温度过低或过高时,直接影响黑曲霉中的许多生化反应和代谢活动,也可能会引起许多环境因子的改变,从而使黑曲霉生长缓慢,单宁酶酶活降低。所以选择发酵温度为30℃进行下一步试验。
接种量对黑曲霉B1401产单宁酶的影响见图6。
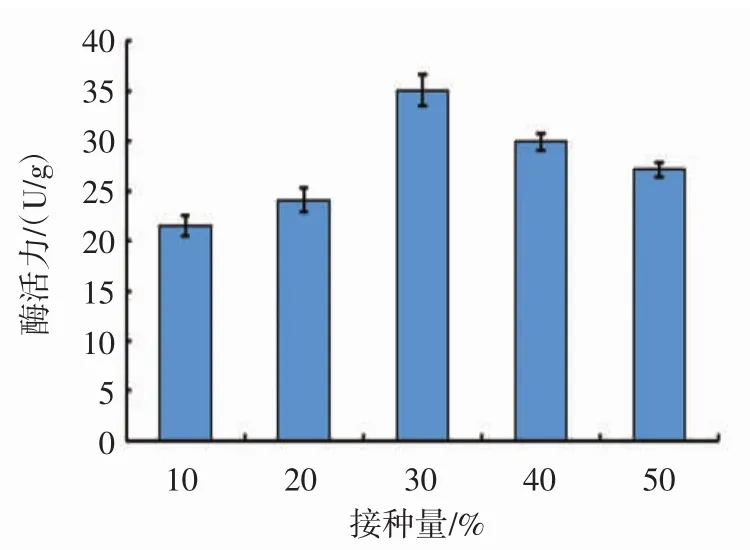
图6 接种量对黑曲霉B1401产单宁酶的影响Fig.6 Effect of different inoculum size on tannase produced by Asp.niger B1401
由图6可知,随着接种量的增加,单宁酶活力先增加后减少。当接种量为30%时,单宁酶的活力达到最大值35.1 U/g。这可能是接种量增加,使目标菌成为基质中的优势菌群,快速适应环境,从而减少杂菌生长的机会,缩短延迟期。但当接种量过大时,营养、溶氧等不能满足菌体生长需要,酶活力下降。因此,最终选择接种量30%。
液固比对黑曲霉B1401产单宁酶的影响见图7。
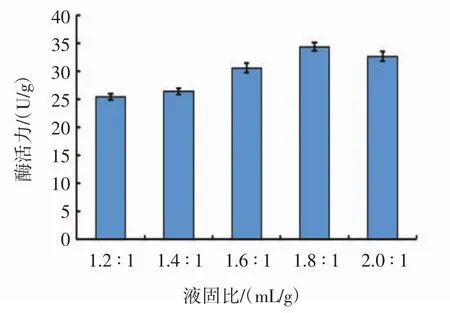
图7 液固比对黑曲霉B1401产单宁酶的影响Fig.7 Effect of different liquid-solid ratio on tannase produced by Asp.niger B1401
由图7可知,液固比为1.8∶1(mL/g)时,单宁酶的活力最高为34.4 U/g。培养基含水量影响微生物的生长和产酶。当培养基中含水量低时,没有充足的水分供微生物生长利用;当培养基中含水量过高时,培养基易出现成团现象,会阻碍培养基中的菌株的氧分供应,进而降低了酶活力。所以,培养基中适宜的含水量能够弥补固体在发酵过程中的水分损失,有利于单宁酶的产生。因此,最终选择盐溶液与发酵培养基的比例为 1.8 ∶1(mL/g)。
2.2 Plackett-Burman试验
PB试验结果见表3、各因素影响情况见表4及PB试验设计主效应分析结果见表5。
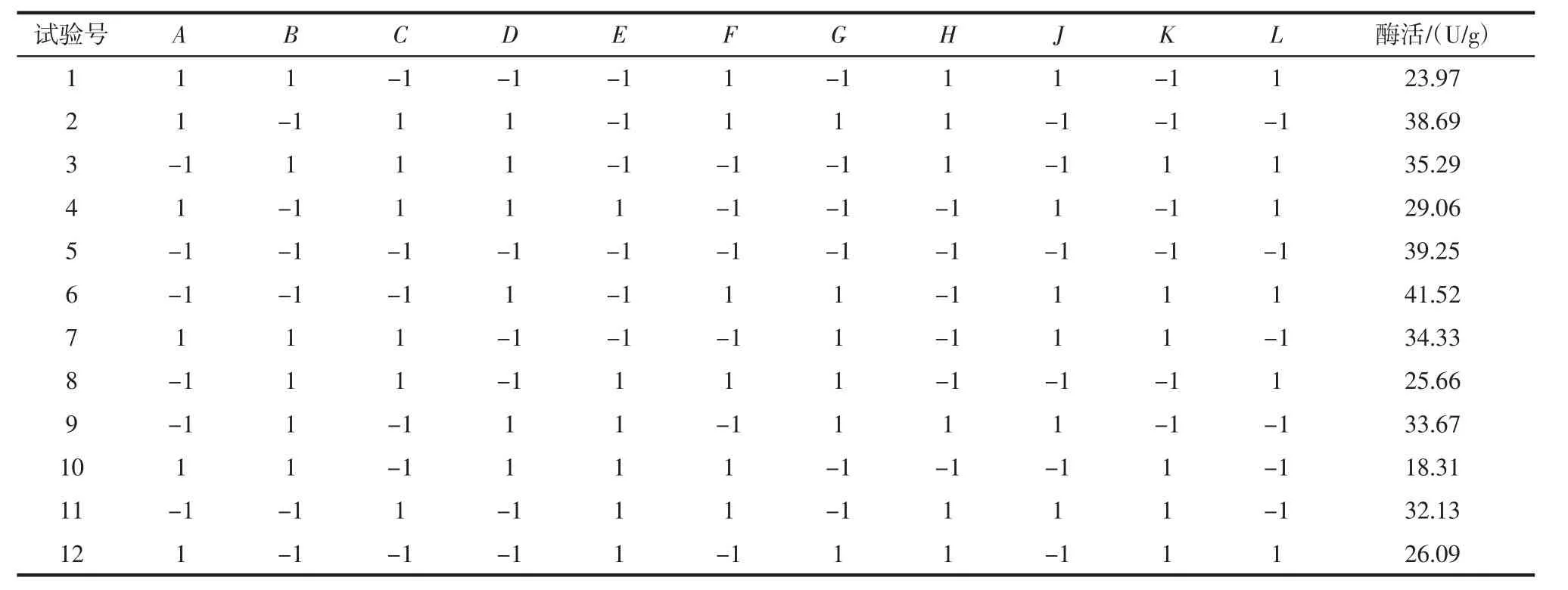
表3 PB试验结果Table 3 The experimental results in PB test

表4 各因素对发酵培养基产单宁酶影响情况Table 4 Various factors on the fermentation medium for tannase production
由表4可以得出液固比、装载量、接种量对提高发酵培养基产单宁酶酶活力有正效应;可溶性淀粉含量、氮源比、发酵时间、发酵温度则具有负效应。由表5可知,这7个因素对单宁酶酶活提高的影响顺序依次为:发酵时间>可溶性淀粉含量>氮源比>接种量>发酵温度>装载量>液固比。因此选择发酵时间、可溶性淀粉含量和氮源比3个显著因素进行下一步优化。
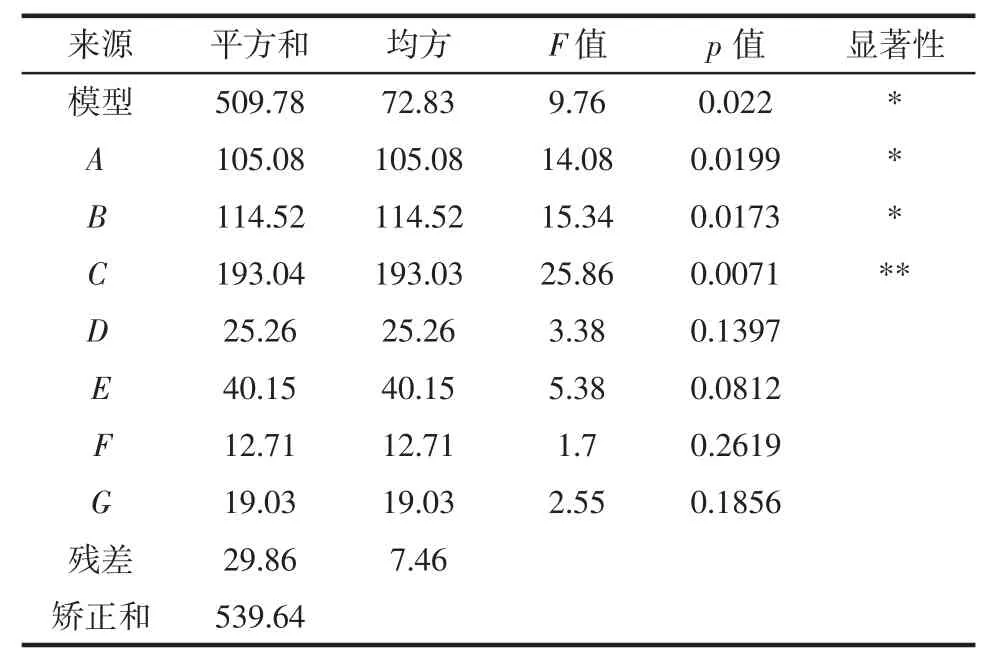
表5 PB试验设计主效应分析结果Table 5 The main effect analysis results of PB experimental design
2.3 Box-Behnken响应面试验
BB试验设计及其响应值结果见表6,方差分析见表7。
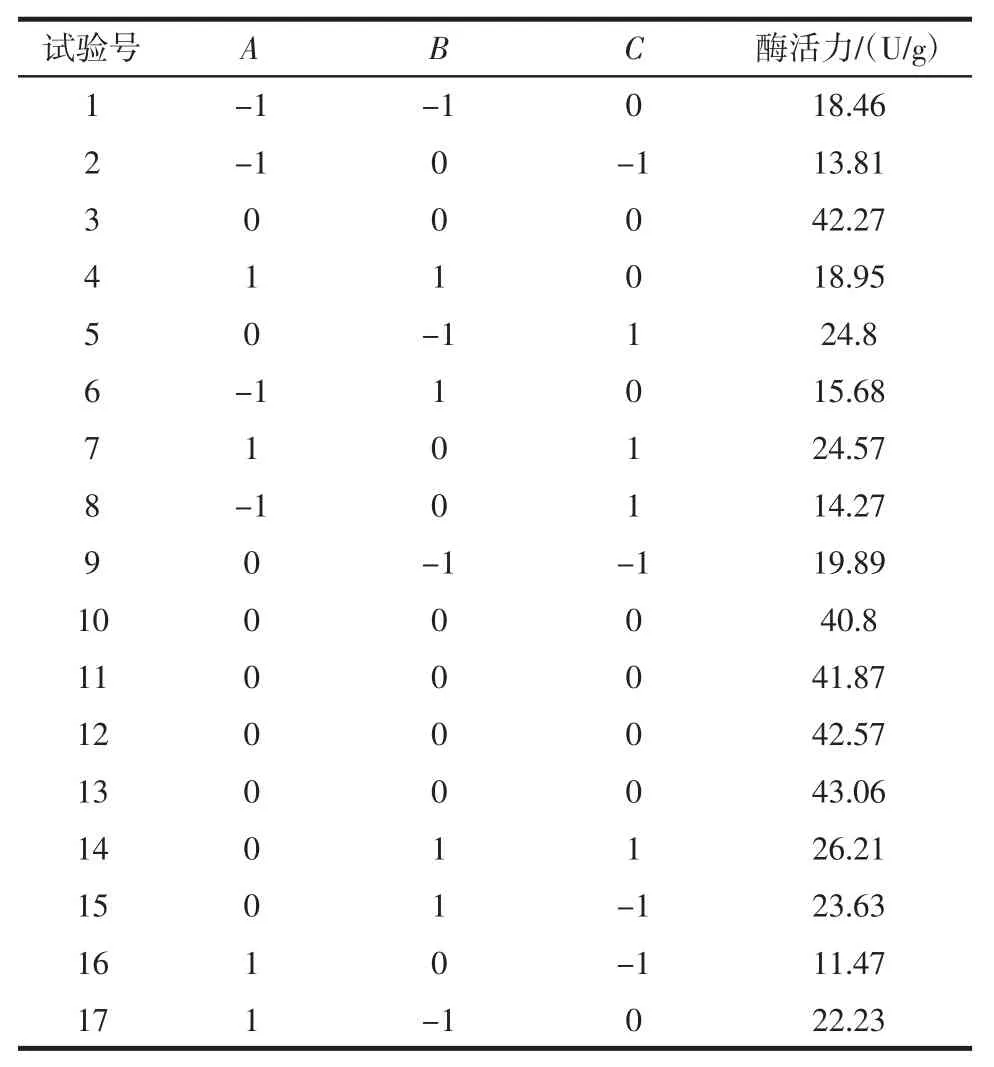
表6 BB试验设计及其响应值结果Table 6 The results of BB experiment design and its response value

表7 BB响应面试验方差分析Table 7 Analysis of variance of Box-Behnken response surface design
采用Design-expert(version8.0.6.1)分析软件对表6中的响应值与各因素进行拟合回归,得到单宁酶酶活力对氮源比(A)、可溶性淀粉含量(B)和发酵时间(C)的多元二次响应面回归模型:酶活力/(U/g)=44.82+5.64A-1.33B+4.03C-0.45AB+2.79AC-2.94BC-15.55A2-6.67B2-9.47C2。
由表7可知,回归方程中各变量对响应值影响的显著性,由F检验来判定,概率p值越小,则其相应变量的显著程度就越高[23]。模型p=0.000 1<0.01,表明回归模型极显著,失拟项p=0.103 4>0.05不显著,因素A、C 极显著(p<0.01),因素 B 显著(p<0.05);各因素的二次项均极显著(p<0.01);交互项中AC及BC极显著(p<0.01)而 AB 不显著(p>0.05)。该模型的决定系数R2=0.996 9,调整决定系数R2Adj=0.992 8,说明该模型与实际试验拟合程度较好,自变量与响应值之间线性关系显著,即该试验可靠,可以用此模型对黑曲霉B1401利用茶叶加工废料固态发酵产单宁酶酶活力进行分析和预测。
响应面结果见图8~图10。

图8 氮源比和可溶性淀粉含量对黑曲霉B1401发酵产单宁酶活性影响的响应面结果Fig.8 Response surface result of the effect of nitrogen source ratio and soluble starch content on the activity of tanninase produced by Asp.niger B1401 fermentation
由图8~图10的响应面结果可知,两因素之间的影响基本呈抛物线型关系,且均有一个极值点,变化趋势都是先增大后减少,等高线呈圆形说明两因素交互作用不显著,呈椭圆或者马鞍形则表明作用显著[24]。图8中单宁酶的酶活力随氮源比和可溶性淀粉含量的增加先升高后降低,图9中酶活力大小随氮源比和发酵时间的增加呈先升高后降低,图10中单宁酶的酶活力大小随着可溶性淀粉含量和发酵时间的增加,呈先升高后降低。结合表7可知,氮源比和发酵时间对单宁酶的酶活力影响大于可溶性淀粉含量。
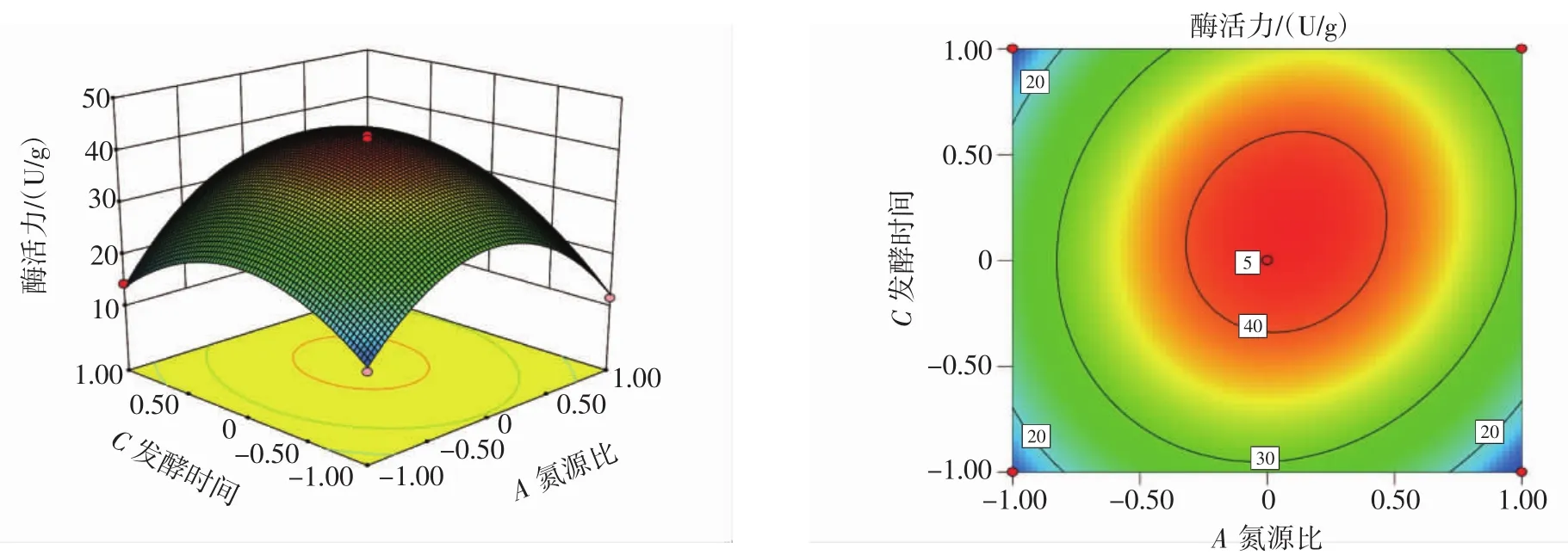
图9 氮源比和发酵时间对黑曲霉B1401发酵产单宁酶活性影响的响应面结果Fig.9 Response surface result of the effect of nitrogen source ratio and fermentation time on the activity of tanninase produced by Asp.niger B1401 fermentation

图10 可溶性淀粉含量和发酵时间对黑曲霉B1401发酵产单宁酶活性影响的响应面结果Fig.10 Response surface result of the effect of soluble starch content and fermentation time on the activity of tanninase produced by Asp.niger B1401 fermentation
2.4 最优配方的确定及验证试验
由Design-expert(version8.0.6.1)软件分析得出:当氮源比(A)即尿素:硝酸钠为 0.74 ∶0.26(g/g)、可溶性淀粉含量(B)为0.48%、发酵时间(C)为99 h时,响应值达到最大值,酶活力为46.06 U/g。为了验证模型的准确性,在预测最佳培养基配方条件下进行固态发酵试验(重复试验5次),试验结果表明(表8),实际酶活值与预测值的精度达99.91%,表明响应面法优化的模型适合于黑曲霉B1401利用茶叶加工废料固态发酵产单宁酶的工艺。该试验基于响应面优化的工艺参数准确可靠,具有使用价值。

表8 响应面验证试验Table 8 Response surface verification test
3 结论与展望
影响黑曲霉生长代谢的因素较多,Plackett-Burman设计可通过比较各个因子两水平的差异与整体的差异来确定因子的显著性,从而达到筛选的目的,避免在后期的优化试验中由于因子数太多或部分因子不显著而浪费试验资源,但筛选试验设计不能区分主效应与交互作用的影响。Box-Behnken设计响应面通过回归分析可研究几种因素间的交互作用,通过建立拟合性较好的数学模型,既能进行相关数据的拟合,筛选出最佳工艺,又能较好地预测试验的响应值,信息量大,精密度高。
本研究运用Plackett-Burman试验,结合Box-Behnken响应面试验优化黑曲霉B1401利用茶叶加工废料固态发酵产单宁酶的培养条件和发酵条件。试验结果表明:0.48%可溶性淀粉,氮源为复配氮源,即尿素∶硝酸钠为 0.74 ∶0.26(g/g),接种量 30%,装载量 5 g,液固比为 1.8 ∶1(mL/g),发酵温度为 30 ℃,发酵时间为 99 h,此条件下单宁酶酶活力可达46.06 U/g。而吴昌正等[25]研究的茶梗固态发酵产单宁酶酶活力为23.6 U/g,张枫等[26]研究的黑曲霉JMU-TS528模拟固态发酵茶梗产单宁酶酶活为19.22 U/g,周罗娜等[27]研究的高产单宁酶的黑曲霉菌株在固态培养中获得的酶活力为27.68 U/g。同时杨亚力等[28]利用黑曲霉发酵所得的单宁酶对滇橄榄汁进行处理,使滇橄榄汁的澄清度、稳定性均有提高,汁中悬浮物、总酸、黏度都得到降低,显著提高了滇橄榄汁的感官品质。本研究中的黑曲霉菌株利用茶叶加工废料固态发酵可获得高产量的单宁酶酶活力(46.02 U/g),可有效降低成本,若将本工艺生产所得的单宁酶应用到食品工业化生产中,在提高产品品质的同时又能降低工业生产成本。但本研究还需在合适的生物反应器中进行放大试验生产,以促进单宁酶固态发酵生产实现工业化。
