日本脑炎病毒感染仔猪扁桃体的细胞嗜性研究
2021-03-29张秋婷关如婷潘俊慧杨兴淼谢盛达余都王学飞曹瑞兵
张秋婷,关如婷,潘俊慧,杨兴淼,谢盛达,余都,王学飞,曹瑞兵
(南京农业大学动物医学院,江苏 南京 210095)
流行性乙型脑炎是一种由日本脑炎病毒(Japanese encephalitis virus,JEV)感染引起的人畜共患传染病,主要流行于东亚和南亚地区,我国是该病的高发区。JEV是黄病毒科黄病毒属成员之一,库蚊是其主要的传播媒介。猪和野生水禽是JEV主要的自然宿主。猪是JEV在自然界的主要扩增宿主,产生高病毒血症,影响蚊媒的病毒阳性率,促进JEV在人类感染与传播[1-2]。不同于人和马会出现致死的脑炎症状,商品猪感染JEV症状通常不明显,怀孕母猪会出现死胎和流产,公猪出现睾丸炎等繁殖障碍症状[3]。
作为一种嗜神经的病毒,JEV在中枢神经系统(central nervous system,CNS)中的易嗜细胞主要是位于大脑皮层和丘脑的椎体神经元和脊髓的大神经元[4]。近期研究发现JEV不仅对CNS具有强烈的趋向性,而且对次级淋巴组织特别是扁桃体具有较强的趋向性[5]。扁桃体可较长时间携带JEV,且病毒滴度相对较高。JEV可在猪间无载体接触(口鼻接触)传播[6-8],有人推测猪扁桃体持续带毒可能与此相关[9]。猪扁桃体是一组淋巴上皮组织,能够参与局部和系统的细胞和体液免疫[10]。扁桃体含有大量的免疫细胞,如T细胞、B细胞、巨噬细胞、树突状细胞和M细胞等,这些细胞相互协同,组成宿主的免疫保护屏障[11]。但也有一些细菌和病毒利用扁桃体作为进入、初次复制和定殖的场所[12],如猪瘟病毒(Classic swine fever virus,CSFV)感染猪扁桃体隐窝上皮细胞[13]。
扁桃体是JEV感染猪的重要外周器官,但JEV感染猪扁桃体的细胞嗜性至今未知。本试验探究JEV NJ2008株感染仔猪的病毒血症和鼻拭子中病毒排出的情况,并鉴定JEV在扁桃体中的细胞嗜性,为进一步探究JEV感染和传播机制提供参考。
1 材料与方法
1.1 试验材料
JEV NJ2008株(GenBank ID:GQ918133)、JEV E鼠源单抗由本课题组保存;JEV NS3兔源单抗购自GeneTEX公司;猪CD11b兔源单抗和猪CD163兔源单抗购自Abcam公司;猪MHC Ⅱ鼠源单抗购自 BIO-RAD 公司;猪乙型脑炎病毒ELISA抗体检测试剂盒为武汉科前生物公司产品;病毒RNA提取试剂盒购自TaKaRa公司;RT-PCR试剂盒(HiScript Ⅱ Q RT SuperMix for qPCR、ChamQ Universal SYBR qPCR Master Mix)购自诺唯赞公司;免疫组化试剂盒(SP R&B HRP KIT)购自康为世纪公司。
1.2 仔猪JEV抗体水平检测
4头60日龄健康杜长大三元杂交猪,购自南京某猪场,采集各组仔猪血清样品,按照ELISA试剂盒的使用说明书检测JEV抗体水平。反应室温度控制在18~25 ℃,用酶标仪测量样品D630值。按说明书以如下公式计算S/P值。S/P≥0.21判定为阳性;S/P<0.21判定为阴性。
S/P=(D630样品平均-D630阴性对照平均)/(D630阳性对照平均-D630阴性对照平均)。
1.3 动物试验及处理
4只商品仔猪在实验动物房饲养4周后,经采血检测其JEV抗原、抗体均为阴性,临床表现健康。将其分为A、B 2组,A组3只为攻毒组,每只仔猪分别颈部皮下及静脉各注射1×107TCID50·mL-1的JEV NJ2008 株1 mL。B组1只,为空白对照组,注射相同剂量的生理盐水。试验猪分栏饲养于实验动物中心,自由饮水和采食。每天对动物进行体温、食欲等临床检查和观察,并从4只仔猪采集血液和口、鼻拭子。攻毒后每天测量4只猪直肠体温,观察临床症状,分别在攻毒后3、5、7 d解剖感染组1只仔猪,采集扁桃体、脑、淋巴结等组织样品,分别进行组织固定和-80 ℃保存备用。对照组仔猪于攻毒后7 d解剖并做相同处理。
1.4 病毒基因检测
1.4.1JEV基因检测引物的设计为检测猪血清、鼻拭子和扁桃体等组织样品中是否存在JEV,参考JEV基因组序列(GenBank ID:GQ918133)设计qPCR检测上/下游引物序列:F:5′-GGCAAACGACAAACCAACATT-3′/R:5′-ATCAGCTCGCTTCTCGTTGTG-3′。
1.4.2 病毒RNA提取、逆转录及qPCR检测使用病毒RNA提取试剂盒对猪血清、处理后的鼻拭子浸液和组织样品研磨上清液进行病毒RNA提取。使用HiScript Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)对提取的RNA进行逆转录。将逆转录产物使用ChamQ Universal SYBR qPCR Master Mix进行qPCR。qPCR反应体系:SYBR Green Mix 10 μL,上、下游引物即Rox各0.4 μL,cDNA模板2 μL,DEPC水6.8 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。反应结束后,样品CT≤30判定为JEV基因阳性;同时核对扩增曲线、熔解曲线,并随机取qPCR产物进行琼脂糖凝胶电泳验证。
1.5 免疫组织化学检测
将保存于含4%多聚甲醛的组织固定液中的扁桃体、脑、淋巴结样品进行梯度乙醇脱水、二甲苯透明、石蜡包埋、切片后再进行免疫组化检测。免疫组化使用SP R&B HRP试剂盒。试验中使用抗体为JEV 结构蛋白E和非结构蛋白NS3单抗。
1.6 组织免疫荧光检测
将采集并保存于含4%多聚甲醛的组织固定液中的组织样品进行免疫荧光检测。组织样品的处理及切片制作过程参照1.5节。组织经0.1% Triton X-100透膜处理后,分别加兔源CD11b抗体+鼠源JEV E蛋白单抗、兔源CD163抗体+鼠源JEV E蛋白单抗、鼠源猪MHC Ⅱ抗体+兔源JEV NS3蛋白单抗,4 ℃孵育过夜。用对应种属的荧光二抗Alexa Fluor Plus 555(抗鼠二抗)和Alexa Fluor Plus 488(Invitrogen,抗兔二抗)孵育。洗涤后用4′,6-二脒基-2-苯基吲哚(DAPI,凯基生物)染色,洗涤后用激光共聚焦显微镜观察和拍照,按照从左到右、从上到下、再选中央的原则拍照并统计5个视野各指标。
2 结果与分析
2.1 仔猪血清JEV抗体水平及临床症状
购入仔猪1周后进行JEV抗体水平的第1次检测,由于母源抗体影响JEV抗体呈阳性,继续对仔猪饲养3周后,第2次检测时所有仔猪JEV抗体水平均为阴性。试验时仔猪为90日龄。所有仔猪在7 d的试验中均未出现发热现象和明显的临床症状。
2.2 感染仔猪JEV病毒血症检测结果
对攻毒后的仔猪每天采血,应用qPCR方法对血清进行JEV检测。病毒血症检测结果见表1。JEV NJ2008株攻毒(A)组3头仔猪仅在攻毒后的1~2 d检测到病毒血症,3~7 d均为阴性。B1仔猪为阴性对照,未检测到乙脑病毒血症。
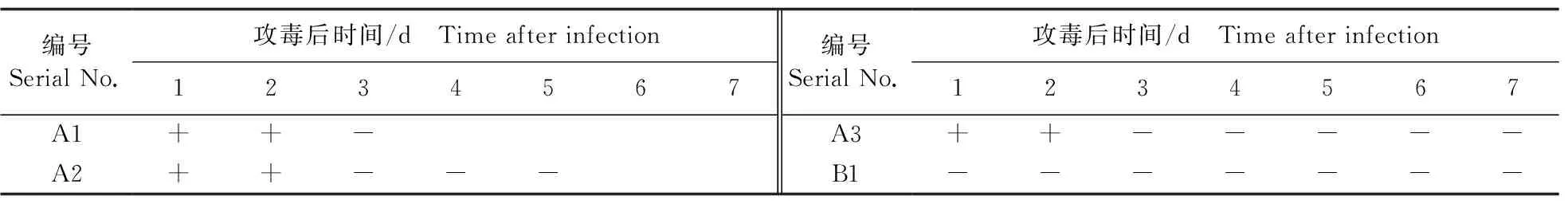
表1 试验猪病毒血症检测结果Table 1 Viremia test results of piglets
2.3 试验猪鼻拭子中JEV基因检测结果
仔猪攻毒后,每天采集各组猪的鼻拭子,通过qPCR方法检测JEV基因,检测结果见表2。仔猪在攻毒后的1~7 d都检测到了JEV的排出,该组所有鼻拭子样品的中JEV基因为全阳性。B1仔猪为阴性对照,未检测到病毒基因。结果表明JEV感染仔猪可以通过口鼻排出病毒,仔猪排出病毒的持续时间较长。
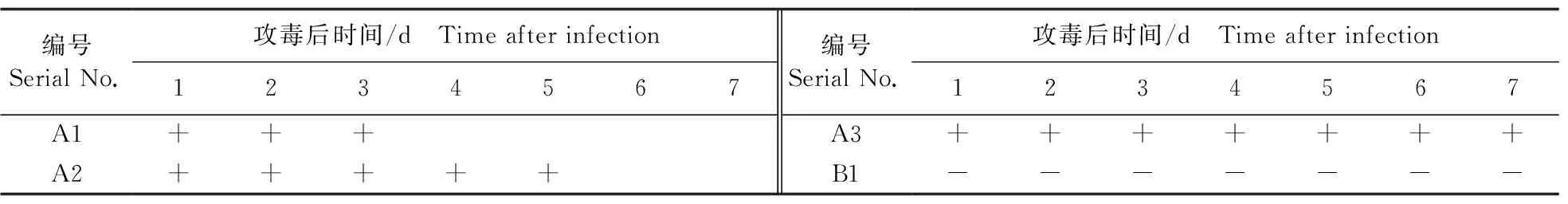
表2 试验猪鼻拭子中病毒JEV基因检测结果Table 2 JEV genes test results of piglets’ nasal swab
2.4 JEV感染仔猪各组织器官病毒基因检测结果
在攻毒后的3、5、7 d,对攻毒(A)组仔猪解剖并采集组织样品,通过qPCR方法检测各组织是否含JEV基因。检测结果(表3)显示,不同仔猪病毒阳性组织存在差异,在脑、脊髓、肺和扁桃体检测到较高水平的病毒基因,表明JEV对于中枢神经系统和扁桃体的组织趋向性。阴性对照(B组)仔猪各组织器官未检测到JEV基因。
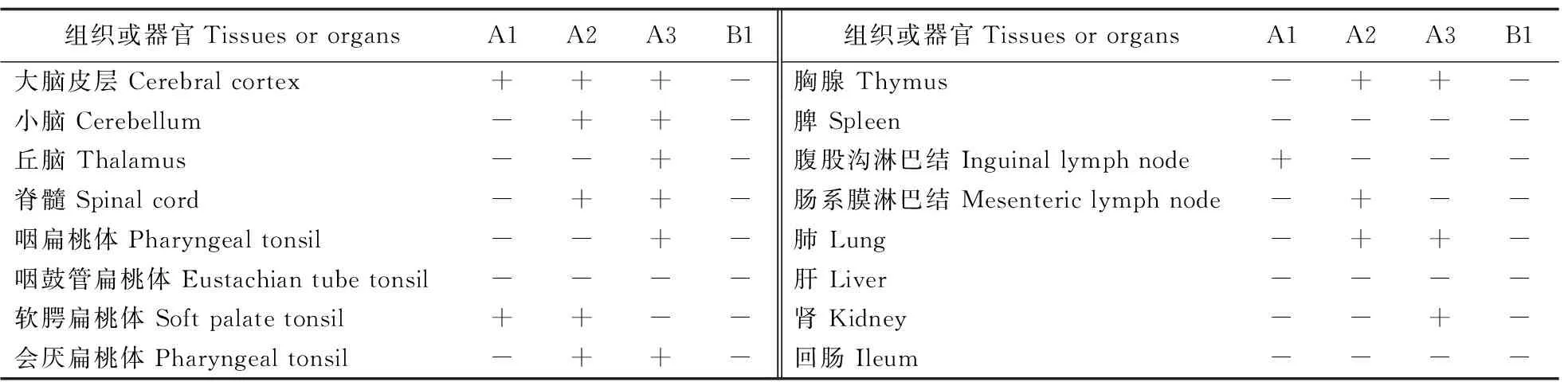
表3 JEV感染仔猪组织器官中病毒基因的qPCR检测结果Table 3 qPCR test results of various tissues and organs of JEV infection piglets
2.5 JEV感染仔猪扁桃体的组织偏嗜性
从免疫组化结果(图1)中可以看出:攻毒仔猪A1的软腭扁桃体淋巴小结和弥散的淋巴组织中均有JEV E抗原阳性细胞;JEV E抗原阳性细胞形态不规则,细胞核较大、染色较淡,多位于弥散的淋巴组织和淋巴小结的周边,推测为树突状细胞或巨噬细胞。A2仔猪软腭扁桃体中也存在JEV E抗原阳性细胞,A3仔猪软腭扁桃体中未发现JEV E抗原阳性细胞,与qPCR检测结果吻合。
3头攻毒仔猪咽扁桃体、咽鼓管扁桃体、会厌扁桃体的免疫组化检测中均未发现JEV E抗原阳性细胞(图1)。而在qPCR检测中,A1仔猪的咽扁桃体和A2、A3仔猪的会厌扁桃体均呈JEV基因阳性,推测是由于JEV在这几个扁桃体样本中含量较低,免疫组化方法未检出。因此,本试验结果显示JEV阳性细胞主要集中于猪软腭扁桃体中。
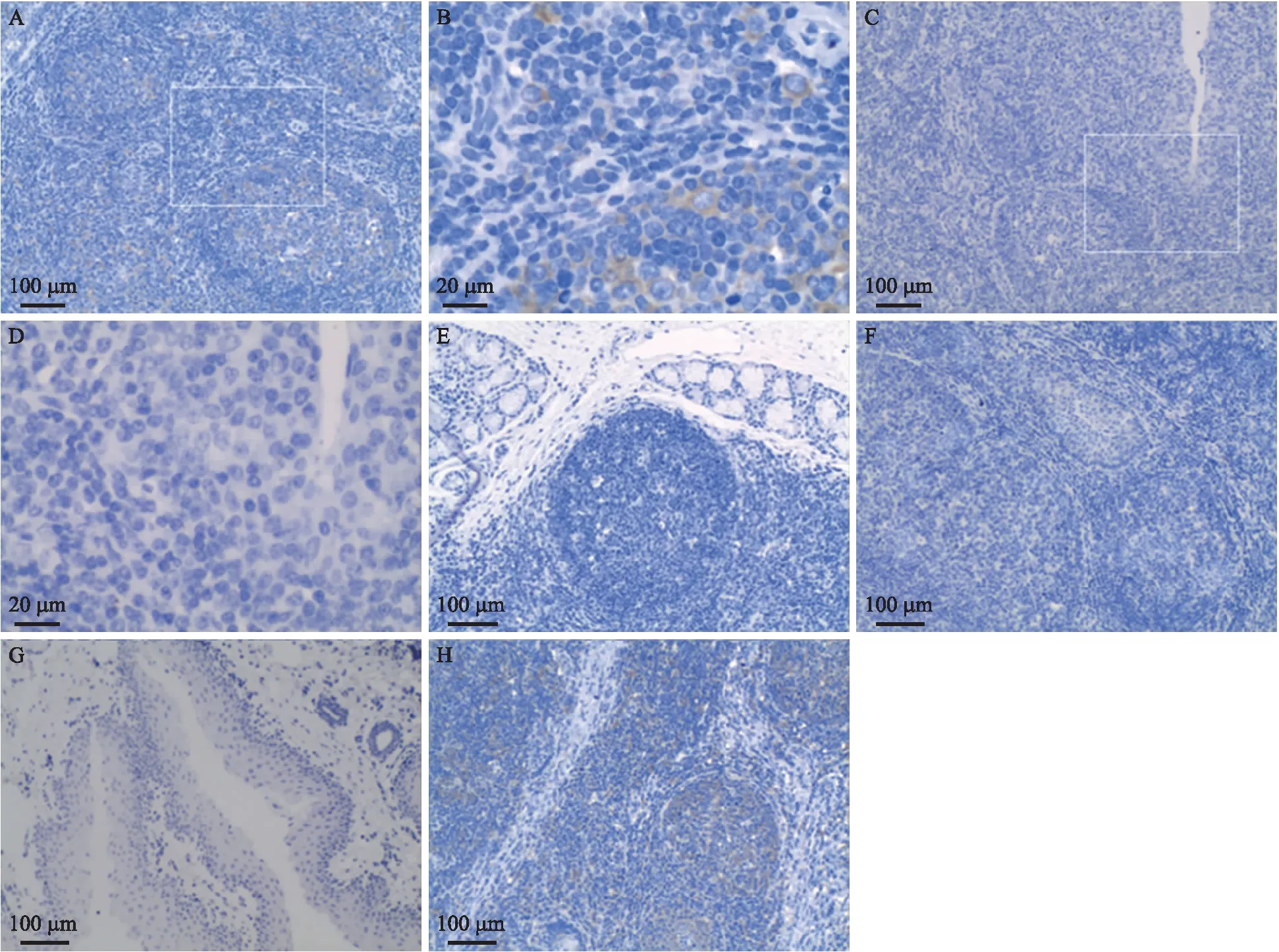
图1 攻毒仔猪扁桃体组织(JEV E蛋白)免疫组化结果Fig.1 Immunohistochemistry results of piglet tonsils with JEV E protein A. A1软腭扁桃体;B. A1软腭扁桃体图A局部放大;C. 阴性对照,B1仔猪软腭扁桃体;D. 阴性对照,B1仔猪软腭扁桃体图C局部放大;E. A1咽扁桃体;F. A3咽鼓管扁桃体;G. A3会厌扁桃体;H. A1软腭扁桃体。A. A1 soft palate tonsil;B. A1 soft palate tonsil in figure A enlarged partly;C. Negative control,B1 piglet soft palate tonsil;D. Negative control,B1 piglets soft palate tonsil in figure C enlarged partly;E. A1 pharyngeal tonsil;F. A3 tubal tonsil;G. A3 epiglottic tonsils;H. A1 soft palate tonsil.
2.6 JEV感染仔猪软腭扁桃体组织中的细胞偏嗜性
为了进一步鉴定仔猪扁桃体中JEV E抗原阳性细胞,本试验应用免疫荧光技术观察JEV E抗原阳性细胞CD11b和CD163的表达情况。JEV感染仔猪软腭扁桃体弥散淋巴组织和淋巴滤泡中可见散在分布的CD11b阳性(CD11b+)细胞,这些CD11b+细胞几乎都呈JEV E抗原阳性,但JEV E抗原阳性细胞还有部分为CD11b阴性细胞(图2-A—D)。在单视野中(×200),JEV E抗原阳性细胞数平均为150,双抗原阳性细胞数平均为49。CD11b+细胞在未攻毒对照仔猪的扁桃体中主要分布于仔猪软腭扁桃体弥散淋巴组织,淋巴滤泡中分布的数量很少(图2-E)。
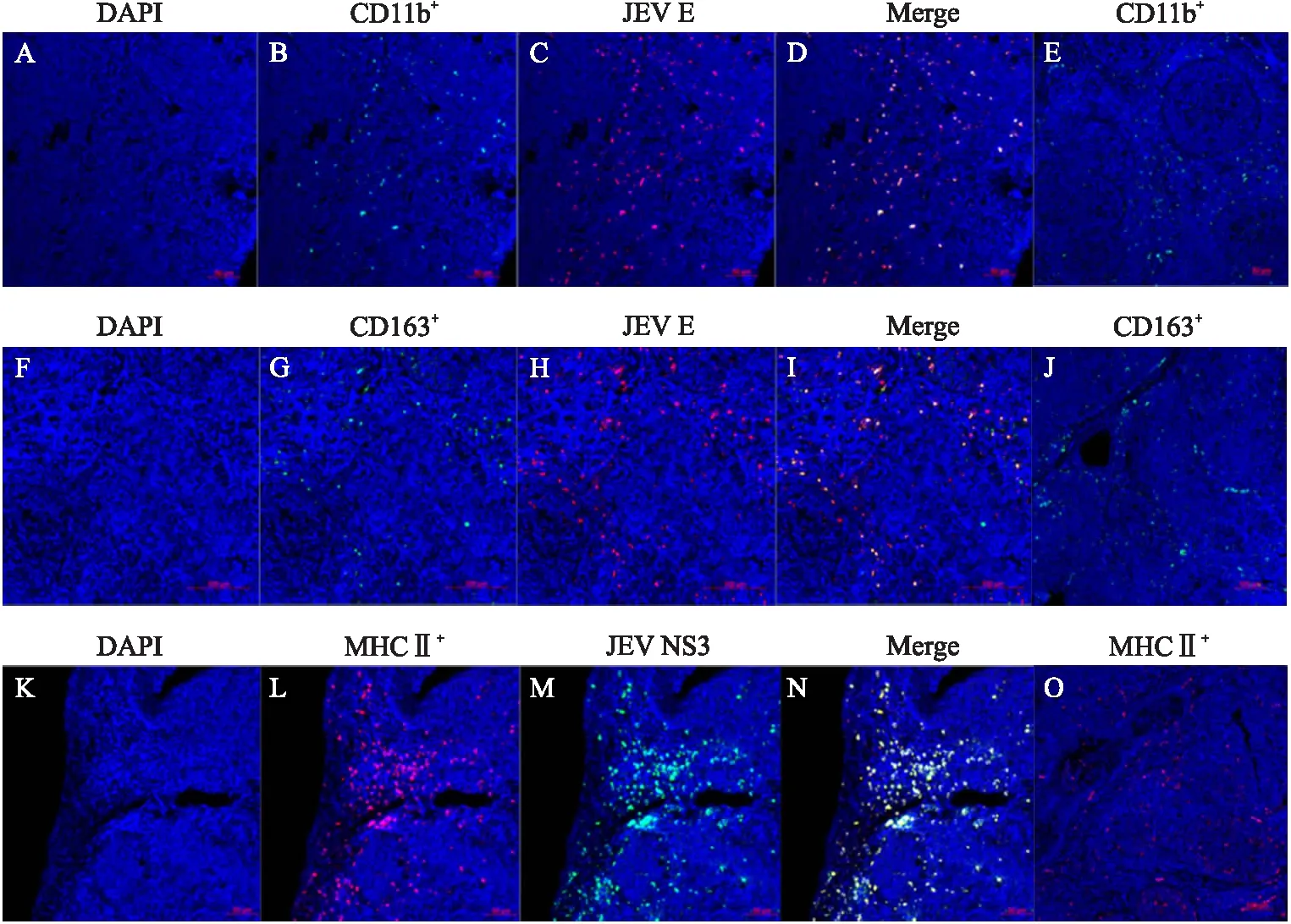
图2 CD11b、CD163和MHC Ⅱ与JEV E在A2仔猪软腭扁桃体中的共定位Fig.2 Colocalization of CD11b,CD163,MHC Ⅱ and JEV E in A2 piglet soft palate tonsil A. DAPI着色细胞核(蓝色);B. 软腭扁桃体内的CD11b+细胞的分布(绿色,anti-CD11b);C. 软腭扁桃体JEV E抗原阳性细胞的分布(红色,anti-JEV E);D. JEV感染的CD11b+细胞(黄色,CD11b类分子与JEV E共染);E. B1软腭扁桃体内的CD11b+细胞的分布(绿色,anti-CD11b);F. DAPI着色细胞核(蓝色);G. 软腭扁桃体内的CD163+细胞的分布(绿色,anti-CD163);H. 软腭扁桃体JEV E抗原阳性细胞的分布(红色,anti-JEV E);I. JEV感染的CD163+细胞(黄色,CD163类分子与JEV E共染);J. B1软腭扁桃体内的CD163+细胞的分布(绿色,anti-CD163);K. DAPI着色细胞核(蓝色);L. 软腭扁桃体MHC Ⅱ+细胞的分布(红色,anti-MHC Ⅱ);M. 软腭扁桃体JEV E抗原阳性细胞的分布(绿色,anti-JEV NS3);N. JEV感染的MHC Ⅱ+细胞(黄色,MHC Ⅱ类分子与JEV NS3共染);O. B1软腭扁桃体MHC Ⅱ+类分子阳性细胞的分布(红色,anti-MHC Ⅱ)。E、J、O各阴性扁桃体中无JEV抗原阳性细胞分布。A. DAPI stained nuclei(blue);B. Distribution of CD11b+ cells in soft palate tonsils(green,anti-CD11b);C. Distribution of JEV E antigen positive cells in soft palate tonsils(red,anti-JEV E);D. JEV infected CD11b+cells(yellow,CD11b co-stained with JEV E);E. Distribution of CD11b+ cells in B1 soft palate tonsils(green,anti-CD11b);F. DAPI stained nuclei(blue);G. Distribution of CD163+ cells in soft palate tonsils(green,anti-CD163);H. Distribution of JEV E antigen positive cells in soft palate tonsils(red,anti-JEV E);I. JEV infected CD163+cells(yellow,CD163 co-stained with JEV E);J. Distribution CD163+ cells in B1 soft palate tonsil(green,anti-CD163);K. DAPI stained nuclei(blue);L. Distribution of MHC Ⅱ+ cells in soft palate tonsils(red,anti-MHC Ⅱ);M. Distribution of JEV E antigen positive cells in soft palate tonsils(green,anti-JEV NS3);N. JEV Infected MHC Ⅱ+ cells(yellow,MHC Ⅱ co-stained with JEV NS3);O. Distribution MHC Ⅱ+ cells in B1 soft palate tonsil(red,anti-MHC Ⅱ). No distribution of JEV antigen positive cell in each negative tonsil in figure E,J and O.
CD163和JEV E抗原双阳性细胞主要分布于软腭扁桃体弥散淋巴组织内和淋巴滤泡周围,在隐窝内皮细胞内的CD163+细胞多数呈JEV E抗原阴性(图2-F—I)。在单视野中(×200),JEV E抗原阳性细胞数平均为126,双抗原阳性细胞数平均为42。CD163+细胞在未攻毒对照仔猪扁桃体分布与攻毒组仔猪并无差异(图2-J)。CD11b+细胞主要有树突状细胞、巨噬细胞、粒细胞和NK细胞,CD163+细胞主要有单核细胞和巨噬细胞,结合扁桃体中这些双抗原阳性细胞的分布和免疫组化中阳性细胞的形态特征分析,猪软腭扁桃体中的JEV抗原阳性细胞主要为树突状细胞和巨噬细胞。
鉴于树突状细胞和巨噬细胞均为抗原提呈细胞,细胞中JEV E抗原阳性有两种可能,一是吞噬获得的外源病毒,二是感染并增殖的病毒。因此,本试验进一步鉴定了猪扁桃体组织中JEV NS3和MHC Ⅱ双抗原阳性细胞的情况,在单视野(×200)中,JEV NS3抗原阳性细胞数为160±5,双抗原阳性细胞数为151±5。组织免疫荧光检测结果显示:MHC Ⅱ+细胞与JEV NS3抗原阳性细胞多在软腭扁桃体弥散淋巴和扁桃体淋巴滤泡的周边部分,扁桃体淋巴滤泡也有少量双阳性细胞分布(图2-K—N)。与未攻毒对照组相比,攻毒组仔猪扁桃体淋巴滤泡内MHCⅡ+细胞减少(图2-O)。这表明JEV 可以在猪扁桃体的两种抗原提呈细胞——树突状细胞和巨噬细胞中复制。
3 讨论
近年来研究发现,JEV可以在猪之间发生非载体传播,且可以在猪扁桃体长达25 d的持续感染[6],但JEV在猪扁桃体中的易感细胞类型至今未见报道。本试验通过人工接种的方法建立了仔猪乙型脑炎感染模型,通过免疫组化法研究发现猪扁桃体中JEV阳性细胞主要为树突状细胞和巨噬细胞等抗原提呈细胞,细胞中JEV NS3蛋白阳性验证了病毒的感染和增殖,表明JEV可以在猪扁桃体中定殖。
本试验中3头接毒仔猪持续7 d的口鼻拭子中均检测到病毒基因,2头仔猪的软腭扁桃体可检测到病毒基因和病毒抗原,这与近期国内外JEV可以通过口鼻排毒、偏嗜感染扁桃体的研究报道一致[6-8]。JEV强毒株攻毒仔猪可产生3~5 d的病毒血症[5]。本试验中攻毒仔猪未见明显临床症状,且3头仔猪只在接毒后2 d检测到病毒血症,这可能与JEV毒株的毒力不够强或仔猪日龄偏大有关,也不排除血液中的病毒为静脉注射来源。由于本文主要聚焦JEV感染后的组织学特征,所以并未进行病毒基因的定量检测。
本试验中通过肌肉注射和静脉注射接种JEV的2头仔猪,可检测到其软腭扁桃体病毒基因和病毒抗原,但3只仔猪的会厌扁桃体、咽扁桃体和咽鼓管扁桃体在免疫组化检测中均未发现病毒抗原阳性细胞,这可能与仔猪的接毒方法有关。如果从水平传播的角度推测,咽扁桃体和咽鼓管扁桃体应是病毒入侵的理想靶标,而且猪咽扁桃体上皮细胞的组织结构比软腭扁桃体更具感染JEV的可能性。
从免疫组化检测的结果发现猪软腭扁桃体中JEV 抗原阳性细胞形态不规则,细胞核较大、染色较淡。进一步通过荧光抗体标记鉴定到JEV 抗原阳性细胞多数为CD11b+或CD163+,且大多数JEV 抗原阳性细胞均表达MHC Ⅱ抗原,因此,猪软腭扁桃体中的JEV阳性细胞多数为树突状细胞和巨噬细胞。这与报道的人和小鼠的JEV外周感染细胞主要为单核巨噬细胞一致[8]。与此类似,猪繁殖和呼吸障碍综合征病毒(PRRSV)也可在扁桃体组织中定殖,在扁桃体实质内抗原阳性细胞分散或聚集成小团,主要为巨噬细胞[12]。而猪瘟病毒(CSFV)则在猪扁桃体隐窝的淋巴上皮内定殖,且可持续带毒数月之久,带毒动物几乎没有临床症状[14]。
本试验的目的是获得病毒阳性组织样品,鉴定JEV感染扁桃体的细胞嗜性,因此在接毒3、5和7 d后对仔猪剖检取样。JEV在猪扁桃体免疫逃逸或免疫耐受机制是学术界关注的问题,本试验虽不能证明扁桃体长期持续带毒,但已有文献报道JEV感染猪的扁桃体持续带毒[4]。本试验结果显示JEV在猪软腭扁桃体中的易嗜细胞为巨噬细胞或树突状细胞等抗原提呈细胞,为探究JEV在猪扁桃体中的持续感染机制提供了关键的参考依据。
