基于网络药理学对四妙散治疗高尿酸血症主要活性成分及潜在靶点分析
2021-03-28叶文静林道斌程亚伟邱晓堂
叶文静 林道斌 程亚伟 邱晓堂
广州中医药大学附属海南中医院内分泌科,海南海口 570100
高尿酸血症(hyperuricemia,HUA)被广泛认为是继“三高”之后的第4 个重要的疾病危险因素[1]。据估计,我国沿海和经济发达地区HUA 患病率在20%以上,已接近欧美发达国家水平。尿酸(UA)的升高,会导致痛风性关节炎、痛风肾病、心血管疾病的发生,并与肥胖、胰岛素抵抗、高血压发病等密切相关[2]。中药具有作用多、靶点广、副作用少的优点,在HUA 的治疗中具有很高的研究应用价值。四妙散来源于清代张秉成的《成方便读》,由黄柏、薏仁、苍术、牛膝构成。现代中药药理研究表明,四妙散能够抑制UA 合成酶XOD、XDH 活性,下调大鼠UA 转运蛋白URAT1、GLUT9 表达,上调OAT1 表达而降低UA[3-4]。临床治疗方面,加味四妙散不仅能显著降低UA,还能缓解全身症状,减少心血管事件发生[5-6]。目前对四妙散治疗HUA 的作用机制研究大多是从单一成分或单一靶点进行的,这与多种成分、多个靶点的中药治疗本质背道而驰。因此本研究使用网络药理学的研究方法,对四妙散治疗HUA 进行系统性探讨,为四妙散治疗HUA 提供理论基础及方法依据。
1 资料与方法
1.1 四妙散有效成分收集与筛选
本研究以中药系统药理数据库和分析平台(TCMSP)(http://tcmspw.com/tcmspsearch.php)检索关键词“黄柏、苍术、牛膝、薏苡仁”以获得四妙散所有活性成分,并将筛选活性成分的条件设定为口服利用度(OB)≥30%和化合物类药性(DL)≥0.18[7]。
1.2 药物靶点的筛选与获取
将药物成分分子结构转化为mol2 格式储存,然后上传至DRAR-CPI 数据库(http://cpi.bio-x.cn/drar/)[8]。筛选靶点蛋白PDB ID,依据(Z-score)<-1,最后导入Uniprot 数据库(https://www.uniprot.org/uniprot/P0A0N5)得到靶点蛋白对应基因。
1.3 获取疾病靶点与交集靶点
通过GeneCards 数据库(https://www.genecards.org/),获取HUA 疾病靶点,并与“1.1”项下筛选出的药物靶点进行韦恩分析,得到交集靶点。
1.4 活性成分-靶点网络的建立
为进一步分析药物作用的机制,本研究将四妙散有效成分及其作用的HUA 靶点导入Cytoscape 3.6.1软件建立网络模型,得到活性成分-靶点关系图,并依据网络节点之间的连接数目进行分析。
1.5 四妙散治疗HUA 的富集分析
将“1.3”项下获取的交集靶点导入DAVID 工具(https://david.ncifcrf.gov/)进行基因本体(GO)、京都基因和基因组数据库(KEGG)分析,并使用Rx64 3.6.2将GO 分析结果及KEGG 结果制成可视化图和高级气泡图。
2 结果
2.1 四妙散有效成分及靶点信息的筛选结果
经TCMSP 平台检索,共获得四妙散活性成分50 种,其中黄柏24 种、苍术4 种、牛膝16 种、薏苡仁6 种,药物靶点经DRAR-CPI 平台共检索到288 个,去重后有36 个。
2.2 疾病靶点及四妙散治疗HUA 靶点的筛选结果
经GeneCards 数据库检索获得471 个HUA 相关靶点,与TCMSP 平台得到的药物作用靶点进行韦恩分析,得到8 个治疗HUA 的潜在靶点。见图1。
2.3 活性成分-靶点相互作用网络关系图的构建
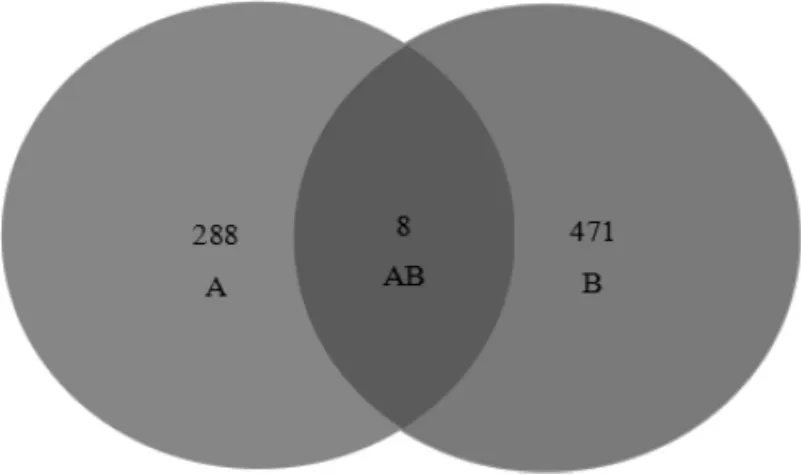
图1 HUA 疾病靶点与药物作用靶点韦恩分析图
活性成分-靶点相互作用网络关系图中共有36 个节点,89 条边。深色节点代表有效化合物,浅色节点代表潜在靶点。以度值(Degree)作为反映节点大小的依据,Degree 数值越大,节点越大。在活性成分方面,Degree 最高的活性成分分别为黄藤素(palmatine)10 个、豆甾醇(stigmasterol)9 个、小檗碱(berberine)8 个、黄连碱(coptisine)6 个、汉黄芩素(wogonin)6 个。在靶点方面,Degree 最高的靶点是前列腺素G/H 合酶2(PTGS2)、类视黄醇X 受体(RXR)、α 雌激素受体(ESR1)、内皮型一氧化氮合酶(NOS3),分别对应35 种、17 种、15 种、11 种药物活性成分。见图2。
2.4 四妙散治疗HUA 的富集分析结果
GO 分析根据阈值P <0.05,错误发现率(FDR)<0.01 确定了26 条GO 富集分析条目,其中生物过程有16 条,分子功能有7 条,细胞成分有3 条,见表1。同时根据FDR<0.01 找到了11 条作用通路,见表2。表1、表2 分别列举了FDR 最小的GO 和KEGG 通路分析结果。
为了使作用通路进一步可视化,制作了GO 分析条形图(图3,封四)和KEGG 分析气泡图(图4,封四)。如图3 所示,四妙散在生物过程中对钙离子转运的负调控、雌二醇的反应作用较大;在分子成分中,对细胞膜作用较大,在分子功能上,对酶结合的作用较大。如图4 所示,cGMP-PKG 信号通路所在P 值最小,基因数最多,表明四妙散对此通路影响最大,而对脂肪细胞中脂解调节通路、血管内皮生长因子(VEGF)信号通路、小细胞肺癌通路、雌激素信号通路的影响次之。
3 讨论
本研究发现了28 种四妙散治疗HUA 的主要活性成分,Degree 最高的前两种活性成分为黄藤素和豆甾醇。黄藤素主要成分为盐酸巴马汀,通过调节胰岛素抵抗、抗氧化应激、抑菌消炎等生理功效发挥作用[9-10]。豆甾醇主要通过抗氧化、消炎、降脂、调节胰岛素抵抗等发挥作用[11-13]。本研究推测黄藤素和豆甾醇可能通过降低胰岛素抵抗、抗氧化应激、抑制炎症、调节代谢紊乱等途径对HUA 间接发挥效用。
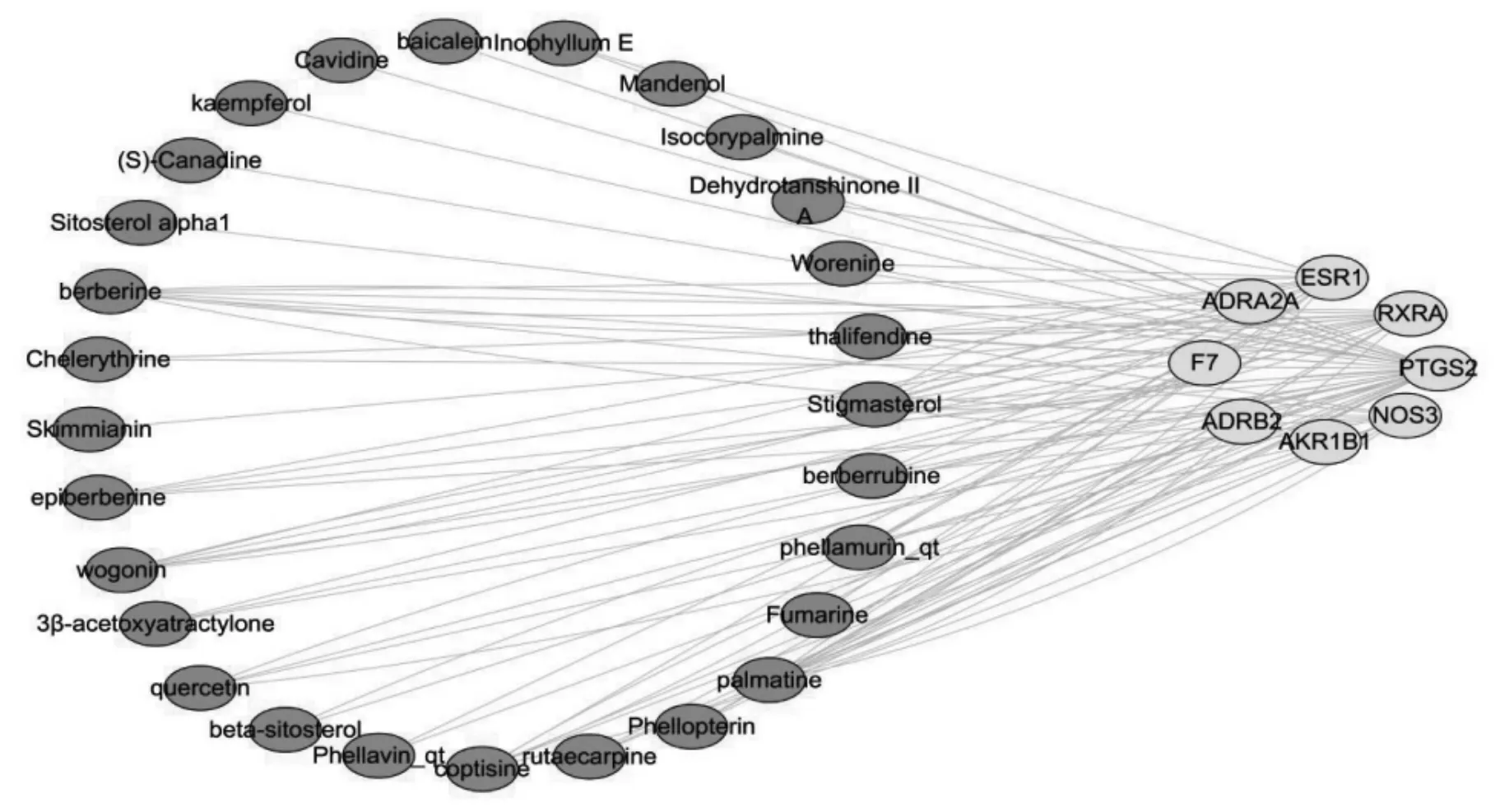
图2 活性成分-靶点相互作用网络关系图
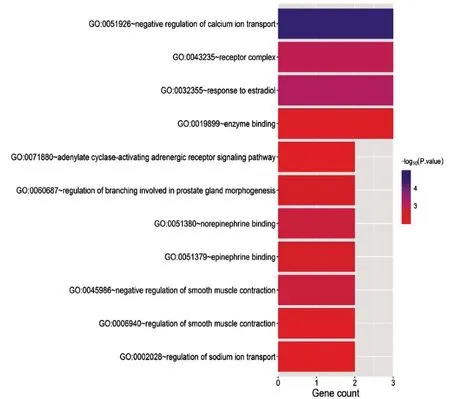
图3 活性成分靶点的GO分析条形图(FDR<0.01)
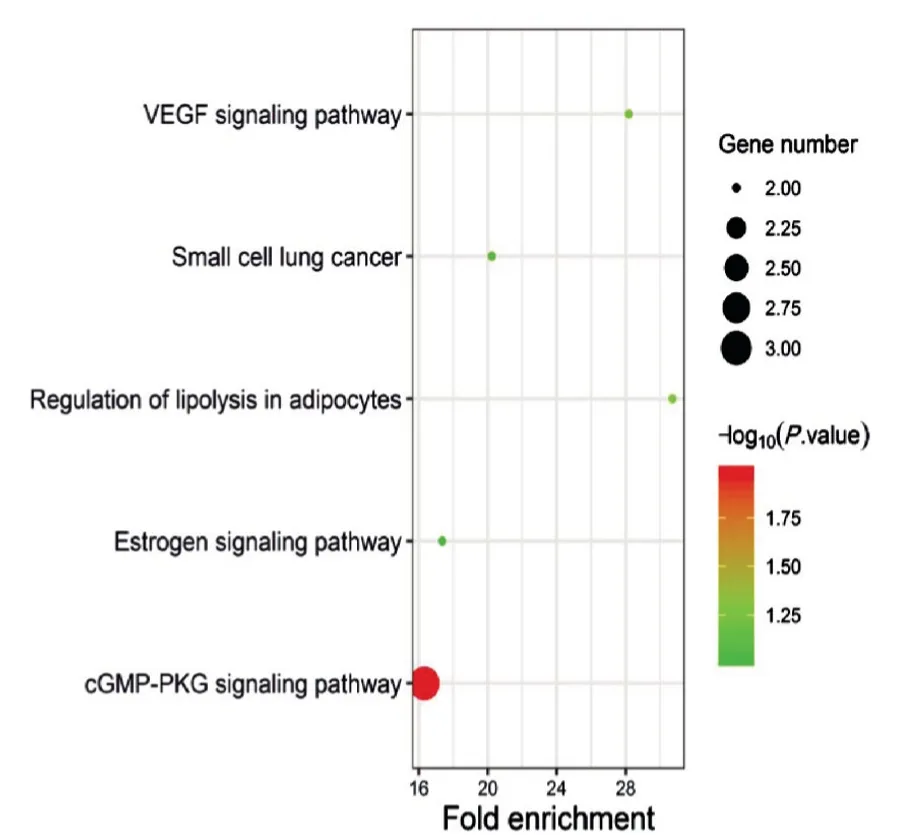
图4 四妙散治疗HUA的靶点KEGG分析气泡图(FDR<0.01)

表1 活性成分靶点的GO 分析结果(FDR<0.01)

表2 活性成分靶点的KEGG 分析结果(FDR<0.01)
靶点方面,本研究发现了8 个治疗HUA 的核心靶点,Degree 最高的靶点分别是PTGS2、RXRA、ESR1、NOS3。
前列腺素G/H 合酶1(PTGS1)与PTGS2 合称为环氧合酶(COX-1/2)。由于COX-1 在HUA 发病过程中鲜有报道,故研究集中在COX-2。COX-2 可诱导机体内毒素、细胞因子、炎症介质等产生,并由内皮细胞、巨噬细胞及其他细胞释放合成前列腺素(PG),进而产生发热、疼痛和炎症反应[14]。有研究显示,UA 可通过血栓烷A2 引起血管平滑肌细胞增殖并上调其COX-2 mRNA 的表达,而选择性的COX-2 抑制剂及血栓烷A2 拮抗剂可显著降低UA[15]。此外,随着UA 浓度的升高及代谢时间的延长,血管平滑肌细胞COX-2也随之升高[16]。另有报道称,沉积在关节中的尿酸盐结晶能够刺激COX-2 表达增加,尤其在痛风急性期,血清中COX-2 水平较慢性期明显增高[17]。因此,四妙散可能通过作用于COX 靶点抑制炎症反应,进而恢复UA 代谢平衡。
RXRA 与视黄酸受体(RAR)形成核受体家族[18]。RXR/RAR 的活化受视黄醇结合蛋白4 (RBP4) 的影响。由脂肪细胞分泌的RBP4 是一种小分子蛋白,主要在肾小管处重吸收[19]。高璐等[20]、Elizalde-Barrera 等[21]研究发现,HUA 患者血浆中RBP4 水平较不伴随危险因素的高尿酸血症患者显著升高,血浆RBP4 与HUA 的发生中心环节主要是胰岛素抵抗,胰岛素抵抗会增加肾小管对钠和UA 的重吸收,减少尿液中UA 的排泄,从而形成HUA。因此,四妙散作用于RXRA 靶点对改善胰岛素抵抗,减少UA 排泄有积极作用。
雌激素受体是一种由ESR1 和β 雌激素受体(ESR2)调节的蛋白质分子。Zeng 等[22]发现雌二醇通过结合ESR2 在转录后期下调GLUT9 表达,减少UA的重吸收。相关研究显示,绝经期女性UA 水平高于非绝经期妇女,而雌二醇较其长期居于较低水平,二者间呈负相关[23]。据此,本研究推测四妙散可能通过补充体内雌激素及作用于尿酸盐转运蛋白降低UA。
一氧化氮(NO)具有舒张血管、抑制白细胞黏附及血小板聚集等特性,在血管生成及神经系统中起着重要作用,而NOS3 是NO 合成途径中的关键限速酶[24]。有研究发现在胰岛素抵抗状态下,细胞内活性氧大量增加,引发氧化应激反应,导致NO 失活,损害肾血管内皮细胞,影响Na+运动,抑制UA 排泄[25]。Serizawa 等[26]发现抑制一氧化氮合酶活性及NOS3 氧化磷酸化的偶联被破坏,可减轻胰岛素抵抗引起的内皮因子损伤。由此,说明四妙散作用于NO 靶点,可通过抑制炎症反应、降低胰岛素抵抗发挥作用。
此外,本研究还确定了11 条相关通路,如通路VEGF 是一种血管再生物质,可促进内皮细胞增殖、血管再生,改善肾缺血组织的侧支循环及灌注,增加肾小球滤过率及UA 排泄[27-28]。雌激素信号通路异常通常与代谢性疾病的发生密切相关[29]。据报道,雌激素通过调节尿酸盐转运蛋白,或抑制XOD 系统,或通过减少肝脏脂肪堆积抑制戊糖磷酸途径的活化,从而降低UA[30]。因此对相关通路的调控也是四妙散治疗HUA 的关键步骤。
