三阴性乳腺癌基因拷贝数变异与患者临床病理特征及预后的关系
2021-03-28李宇翔丰锦春阿孜古丽阿布都热合曼郁璐月朱丽萍
李宇翔 丰锦春 吴 涛 阿孜古丽·阿布都热合曼 郁璐月 朱丽萍
新疆医科大学附属肿瘤医院乳腺外科一病区,新疆乌鲁木齐 830000
乳腺癌现居全球女性恶性肿瘤发病率的首位[1]。随着对乳腺癌在基因水平上探索的深入,为提高其治愈率与生存期提供了基础[2-3],尤其是对侵袭性强、预后差且异质性高的三阴性乳腺癌(triple negative breast cancer,TNBC)的遗传变异的研究带来了新的突破[4]。影响TNBC 发生的相关危险因素中,基因拷贝数变异(copy number variation,CNV)与其联系相当紧密,CNV携带者有很高的乳腺癌发病率[5-7],CNV 亚显微水平的变化与肿瘤的发生呈因果关系[8]。本研究旨在探讨CNV 与TNBC 患者临床病理特征和预后之间的关系,为TNBC 患者预后研究提供新思路。
1 资料与方法
1.1 一般资料
选取新疆医科大学附属肿瘤医院(以下简称“我院”)2014 年1 月—2016 年1 月资料完整的86 例TNBC 患者为研究对象,中位年龄56 岁(32~81 岁);根据中国临床肿瘤学会2019 年分期标准[9],Ⅰ期5 例,Ⅱ期57 例,Ⅲ期24 例。患者入院后均与院方签署知情同意书,本研究经我院医学伦理委员会批准,且标本均经病理诊断、免疫组化及FISH 检测验查。纳入标准:①初次行手术治疗的TNBC;②有完整临床和随访资料。排除标准:①术前接受放化疗;②合并其他恶性肿瘤,有恶性肿瘤病史。
1.2 方法
全外显子高通量平行测序技术检测CNV 情况。从癌组织及癌旁组织中提取DNA 样品,进行基因组DNA 片段化,利用Agilent 2100 Bioanalyzer 生物芯片分析仪进行质控。PCR 扩增后通过Qubit 2.0 核酸蛋白定量仪对文库进行定量。测序所得原始数据双端序列比对到参考序列上,基于比较结果进行染色体结构变异的CNV 情况分析。
1.3 测序结果的判定
采用Control-FREEC[10]系统检测基因组片段的CNV 情况,检测结果中包括:拷贝数缺失、拷贝数扩增以及拷贝数正常的杂合性缺失。进行CNV 比较时需要将同一患者癌组织及癌旁组织样本配对并进行CNV 合并后再行检测,合并方法是使用CNVRuler[11]工具,最后录入每对组织样本中各条染色体中缺失、扩增、杂合性缺失的拷贝数及拷贝数总数。
1.4 随访
采用定期电话随访、门诊复查、入院复查记录的方式对患者进行随访,随访起始时间为患者手术当日,终止时间为死亡,截至2020 年1 月15 日,中位随访时间为38 个月,所有患者均获得有效随访资料。
1.5 临床资料的收集
收集患者临床病理资料,包括:①年龄;②TNM分期;③淋巴结转移情况;④原发肿瘤大小、组织学分级、Ki67 表达、月经情况;⑤恶性肿瘤家族病史;⑥总生存期、5 年生存率。
1.6 统计学方法
采用SPSS 22.0 统计学软件对所得数据进行分析。计数资料以例数或百分比表示,组间比较采用χ2检验。计量资料均数±标准差()表示,采用独立样本t 检验。双变量关联性分析采用Pearson 积矩相关分析、Spearman 秩相关分析法,采用Kaplan-Meier 法进行生存分析,组间曲线比较采用Log-rank 检验,多因素分析采用Cox 回归分析法。以P <0.05 为差异有统计学意义。
2 结果
2.1 患者CNV 分布情况
有效测序数据通过bwa-0.7.15[12]系统的SAM 格式比较,样本经配对合并后共存在5928 个差异CNV,其中扩增41.92%(2485/5928),缺失15.99%(948/5928),正常19.47%(1154/5928),杂合性缺失22.62%(1341/5928)。癌组织(4080 个,68.83%)与癌旁组织(1848 个,31.17%)CNV 分布情况比较,差异有高度统计学意义(P <0.01)。见表1。复发转移组在8 号染色体上有最频繁的CNV 扩增,无病生存组在17 号染色体有最频繁的CNV 丢失及杂合区域(图1)。snpEFF[13]软件对CNV 检测结果进行注释,样本中可能存在发生CNV 的基因型主要有BRCA1/2 基因(在8 号染色体缺失)、FGFR2 基因(在17 号染色体缺失)(图2)。
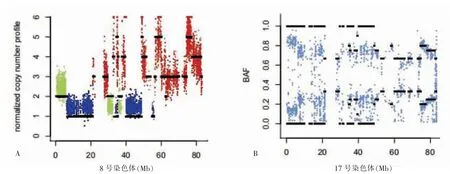
图1 CNV 在染色体上的分布示意图
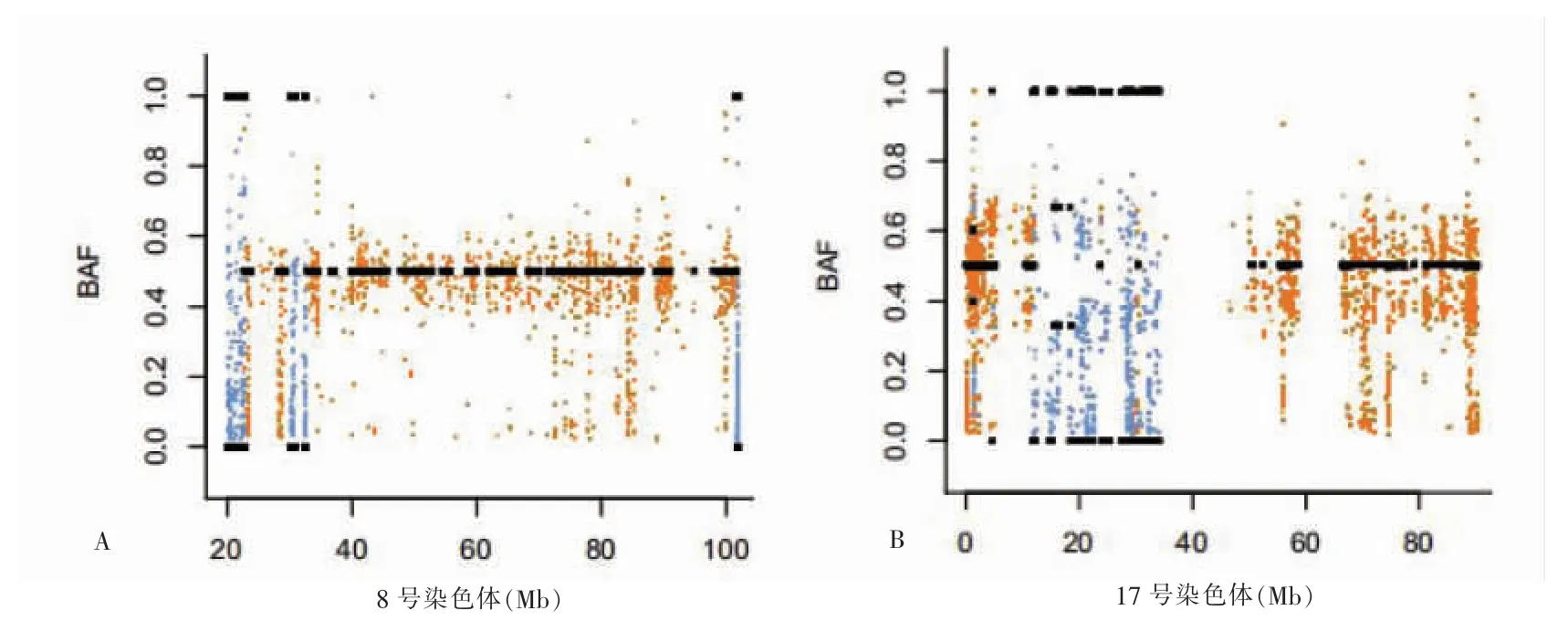
图2 基因缺失在染色体上的分布
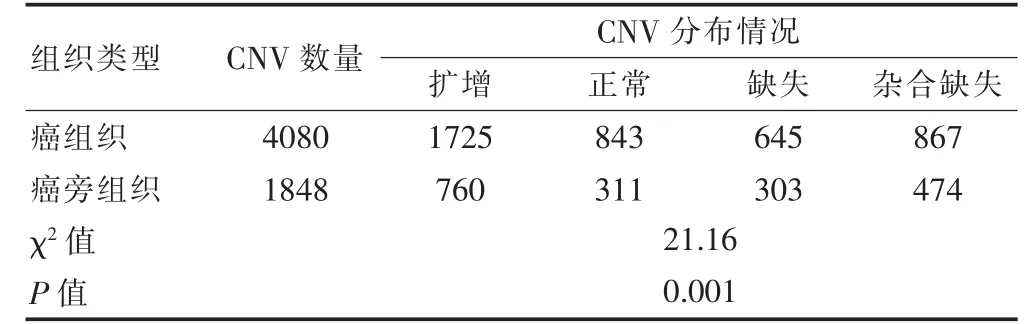
表1 患者CNV 分布情况比较(个)
2.2 CNV 与临床病理特征相关性分析
Pearson 相关性分析显示,CNV 与年龄、原发肿瘤大小、淋巴结转移情况呈线性相关(r=-0.87、0.92、0.94,P <0.05)。Spearman 秩相关分析显示,CNV 与TNM 分期呈正相关(r=0.83,P <0.01)。见图3。
2.3 生存分析
至随访结束,86 例中死亡15 例(17.44%),5 年总生存率为82.56%。8 号染色体发生CNV 者47 例,5 年生存率为74.4%;无CNV 者5 年生存率为92.3%,两组5 年生存率比较,差异有统计学意义(χ2=4.495,P=0.034)。见图4。17 号染色体发生CNV 者51 例,5 年生存率为74.5%;无CNV 者5 年生存率为94.3%,两组5 年生存率比较,差异有统计学意义(χ2=3.145,P=0.046 )。见图5。Cox 多因素回归分析显示,CNV 情况、TNM 分期是TNBC 患者预后的影响因素(HR=0.456、1.927,P <0.0 5)。见表2。
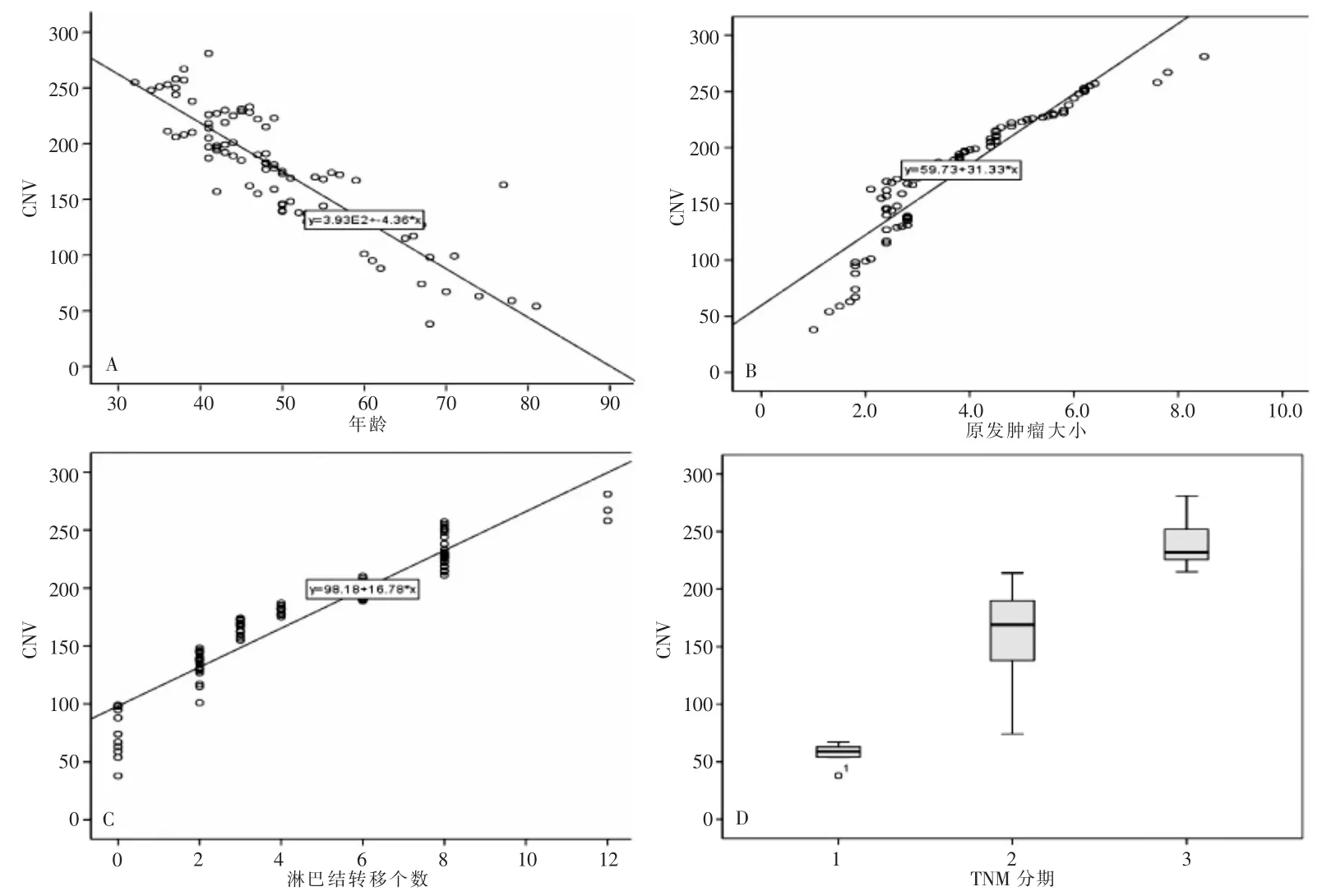
图3 CNV 与病理特征相关性分析
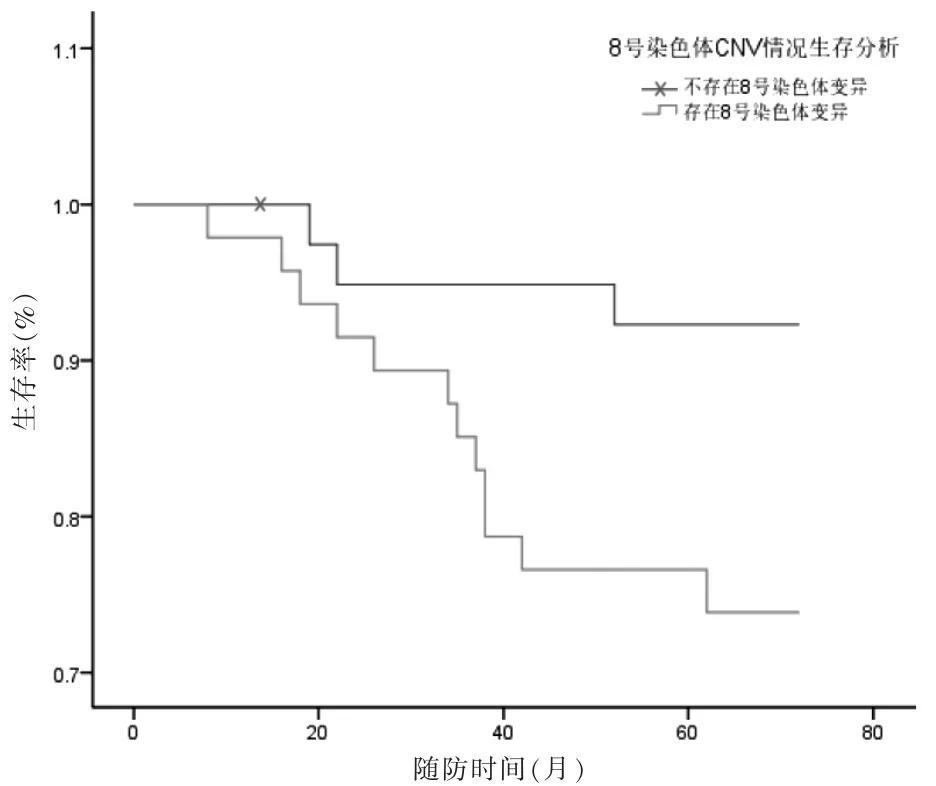
图4 8 号染色体CNV 患者5 年生存率比较
3 讨论
评估肿瘤复发转移风险,并给予医学干预改善患者的预后,是乳腺癌研究领域的热点。常用的TNM 分期预后评价体系,存在明显的局限性。分子遗传学领域多项研究发现,16 号染色体长臂(16 q)拷贝数频繁丢失发生于乳腺癌、肺癌、肝癌等多种恶性肿瘤,16 q拷贝数全部或部分缺失的乳腺癌恶性程度高于非缺失者,并与预后存在明显的相关性[14]。Svetlana 等[15]研究认为CNV 的差异会影响患者的无病生存期,且存在大量CNV 患者在术后可能会较早复发转移。
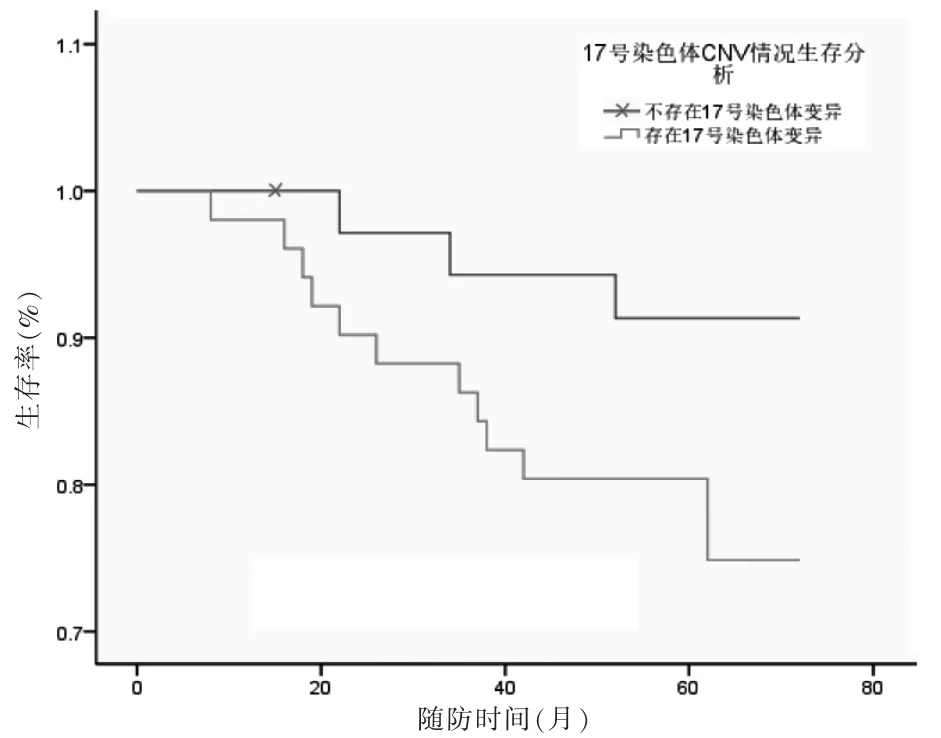
图5 17 号染色体CNV 患者5 年生存率比较
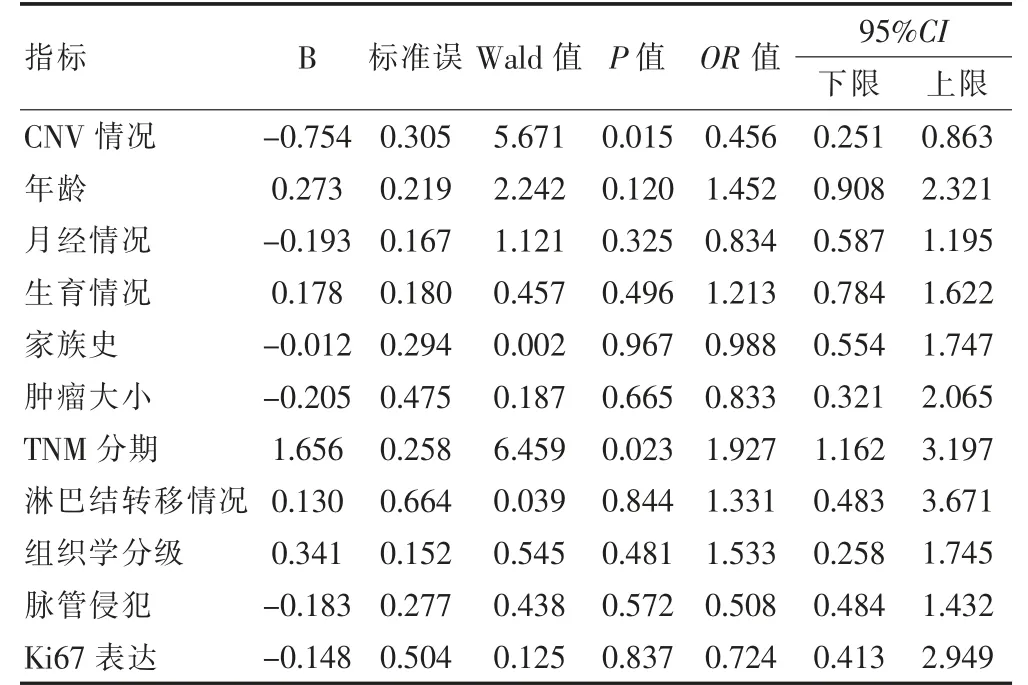
表2 三阴性乳腺癌患者Cox 多因素回归分析
本研究对样本进行了CNV 检测,其中有4691 个基因在不同组织中存在突变,其原因可能是在肿瘤细胞减数分裂过程中,基因组上同一位点的DNA 序列能与其同源序列发生重组,即等位同源重组。但对于基因组上的重复序列,除同一位点上的同源序列外,不同位点上的重复序列也可能具有高度同源性,发生非等位的同源重组[16-17]。本研究样本经检测在负荷最高的8 号、17 号染色体上存在有BRCA1/2 基因、FGFR2 基因、KRAS 基因等基因的突变类型。癌细胞分裂后,据观察同源重组发生的位点不是随机分布在基因组上的,存在一定的序列倾向性,即重组热点,这可能导致了存在多重组热点的TNBC 患者会出现更多的CNV,进而影响其临床病理特征及预后。
癌组织样本中CNV 数目显著高于癌旁组织,这可能由于在疾病进程中,易复发的TNBC 原始癌细胞突变时细胞核异型性更明显,染色体上多对等位基因变异,在DNA 复制过程中存在更多的拷贝数大片丢失或扩增现象,从而带来更大的负荷,导致其组织学分级更高,发生淋巴结及全身转移的更早,对术后化疗敏感度降低,肿瘤恶性程度高且易复发转移。存在大量CNV 的患者术后肿瘤复发转移的风险高于较低数量CNV 的患者,这也提示TNBC 患者发生大量CNV与其预后有很高的相关性。大量研究结果显示,TNBC与其他类型乳腺癌的临床病理特征比较具有更明显的特征[18-20]。相关[21-22]研究认为TNBC 复发及死亡高峰期为术后5 年内,并与肿瘤分级、CNV 情况具有一定的相关性。基于DNA 重组机制与DNA 错误复制机制的基因组重排可以产生多种类型的CNV[23],这也就导致了患者临床病理特征的差异,但是否CNV 种类越多,患者差异越明显,预后越差,还需提高CNV分辨率及基因组覆盖率后进一步探讨研究。
Miron 等[24]进行的前瞻性临床试验对1550 例原发乳腺癌患者的生存进行了分析,其中TNBC 患者5 年总生存率为81.0%,5 年无瘤生存率为84.0%,与本研究患者生存率相似。Zhang 等[25]在拷贝数改变负荷导致乳腺癌生存率的差异分析中认为,CNV 的携带者负荷最高的是1、8 和16 号染色体,且与乳腺癌生存率之间存在显著的关联。发现8 号染色体有最频繁的CNV 扩增,17 号染色体有最频繁的CNV 丢失及杂合区域,同时8、17 号染色体也是负荷最高的两条染色体,这与国内研究结果存在一定的差异。其原因可能是新疆处于我国西部边陲,是一个多民族聚居的地区。本研究中纳入了包括汉族、维吾尔族、哈萨克族、回族等7 种民族患者样本,由于民族的差异,在染色体发生CNV 的过程中,高负荷染色体结果可能因样本多民族种类产生差异,而在负荷较高的8、17 号染色体上发生CNV 的患者5 生存率显著低于未发生CNV的患者。因此,目前数据支持患者在8、17 号染色体差异CNV 可能作为TNBC 的预后指标,但CNV 导致的染色体变异是否与TNBC 的不良预后直接相关仍需要大量的研究,本研究由于样本量偏小尚不能确切论述CNV 与TNBC 患者预后的因果关系,还需要扩大样本量后进一步研究。
