血清MMP-9 和BDNF 在急性脑梗死患者中的表达水平变化及预后临床研究
2021-03-28李又佳韩小妍罗宋宝黄根林黄惠琴吴振梅
李又佳 韩小妍 黄 燕 罗宋宝 黄根林 黄惠琴 陈 莹 吴振梅
广东省肇庆市第一人民医院神经内科,广东肇庆 526000
急性脑梗死(acute cerebral infarction,ACI)是神经科常见疾病,具有高致残率和高致死率,中国脑梗死的发病率为每年246.8/10 万人,死亡率为每年114.8/10 万人[1]。尽早对ACI 患者进行客观有效的预后风险评估和预测在临床工作中有重要意义。目前相关研究多集中于入院时炎症因子和影像学表现[2-5],动态指标变化的研究较少,有必要进一步开展研究。
基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)激活时参与降解形成血脑屏障(blood brain barrier,BBB)基膜的主要成分,与ACI 出现脑水肿密切相关[6]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)对神经元发育分化和神经生长再生起维持促进作用,与损伤后神经恢复相关[7-8]。本研究发现MMP-9 和BDNF 水平变化与患者预后相关。现报道如下:
1 对象与方法
1.1 研究对象
选取2019 年1 月—6 月在广东省肇庆市第一人民医院(以下简称“我院”)就诊,确诊为ACI 并完成3 个月随访的患者42 例为研究组,同期体检健康人群40 名为对照组。本研究为前瞻性研究,经我院医学伦理委员会批准,所有参与研究的患者均签署知情同意书。
研究组纳入标准:①符合《各类脑血管病疾病诊断要点》诊断标准[9],且经头颅计算机断层扫描术(CT)或核磁共振(MRI)证实;②初次发病;③24 h 内入院治疗。排除标准:患肿瘤、严重感染、自身免疫性疾病、严重肝肾功能不全。
对照组为无心脑血管相关重大疾病,且无脑梗病史的健康人群。
研究组42 例,男22 例,女20 例;平均年龄(56.8±10.2)岁。对照组40 例,男20 例,女20 例;平均年龄(57.2±11.4)岁。两组性别、年龄比较,差异无统计学意义(P >0.05),具有可比性。
按改良Rankin(mRS)量表[10]评分将研究组分为预后良好组24 例,预后不良组18 例。
1.2 方法
研究组行药物治疗,入院后根据患者发病时间给予尿激酶(丽珠集团丽珠制药厂,批号:190502)或重组人组织型纤溶酶原激活剂(德国勃林格殷格翰公司,批号:708765)治疗,口服阿司匹林或氯吡格雷预防血栓,他汀类药物稳定斑块。并结合患者情况给予降压、降糖等治疗和生活指导。
研究组所有研究对象均于入院第1 天(T1)以及入院第2 天(T2)、第5 天(T5)分别抽取晨起空腹静脉血3 mL。对照组体检时抽取空腹静脉血3 mL。抽取血液静置30 min 后,3000 r/min 离心10 min,离心半径13 cm,取上清200 μL 分装,-80℃冰箱冻存。
嘱患者出院后1 周、1 个月、3 个月门诊随访病情,不适随时复诊,未及时门诊随访者电话随访。在第3 个月随访时行mRS 量表[10]进行评分。
1.3 检测指标
取冻存血清,使用人MMP-9 酶活试剂盒(上海酶联生物科技有限公司,批号:ML058617M)和人BDNF酶活试剂盒(武汉菲恩生物科技有限公司,批号:EH0043),采用酶联免疫吸附测定法,按说明书进行操作,酶标仪在450 nm 波长下测定吸光度,计算MMP-9 和BDNF 浓度。
mRS 量表判读标注[10]:判断ACI 患者的神经功能恢复情况属于哪个级别,则记录为该级别。需注意:仅考虑疾病发生后的情况;如果患者可自行借助辅助装置行走,视为独立行走;如果两个级别对患者同样适用,按指导意见无法区分,以较为严重的为准。0~2 级为预后良好,≥3 级为预后不良。
1.4 统计学方法
采用SPSS 20.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,组间比较采用t检验,计数资料采用百分率表示,组间比较采用χ2检验或Fisher 确切概率法,对预后良好组与预后不良组不同时间点数据采用重复测量方差分析。以P <0.05为差异有统计学意义。
2 结果
2.1 研究组T1 时间点与对照组体检时的血清MMP-9和BDNF 水平比较
在T1时间点,研究组血清MMP-9 和BDNF 水平均高于对照组,差异均有统计学意义(均P <0.05)。见表1。
表1 研究组T1 时间点与对照组体检时血清MMP-9和BDNF 水平比较(ng/mL,)
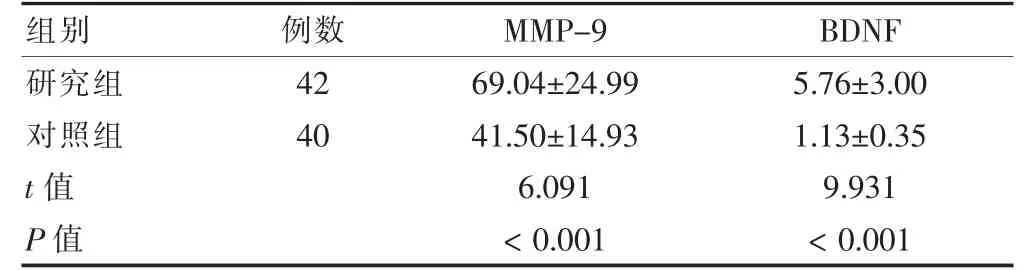
表1 研究组T1 时间点与对照组体检时血清MMP-9和BDNF 水平比较(ng/mL,)
注:MMP-9:基质金属蛋白酶-9;BDNF:脑源性神经营养因子
2.2 预后良好组与预后不良组不同时间点的血清MMP-9 和BDNF 水平比较
整体比较:两组MMP-9 水平组间和交互作用比较,差异均有统计学意义(均P <0.05),时间点比较,差异无统计学意义(P >0.05)。进一步分析,T5时间点,预后不良组MMP-9 水平高于预后良好组,差异有统计学意义(P <0.05)。
整体比较:两组BDNF 水平时间点和交互作用比较,差异均有统计学意义(均P <0.05),组间比较差异无统计学意义(P >0.05)。进一步分析,预后良好组T2时间点BDNF 水平高于T1时间点BDNF 水平,T5时间点BDNF 水平高于T2时间点BDNF 水平,差异均有统计学意义(均P <0.05);预后不良组T2时间点和T5时间点BDNF 水平均低于T1时间点BDNF 水平,差异均有统计学意义(均P <0.05)。见表2。
3 讨论
ACI 是因供血不足导致的大脑组织缺血性坏死,常见于中老年,致死率和致残率较高。尽早对ACI 患者进行客观有效的预后风险预测,以采取相应的处理措施,在临床上有重要意义。此前临床ACI 患者预后主要是通过对患者相关信息进行量化,如美国国立卫生研究院卒中量表,洛桑卒中量表等[11-12],再结合炎症因子、凝血功能指标、影像学等指标进行综合化分析[13-14]。但是这些方法存在一定问题,量表主观影响较大,预测价值并不理想[15],实验室指标随病情变化和治疗动态波动[16-18]。目前对于ACI 患者预后指标的动态变化研究还较为缺乏,本研究选择了MMP-9 和BDNF 这两个指标开展相关研究。
表2 预后良好组与预后不良组不同时间点的血清MMP-9 和BDNF 水平比较(ng/mL,)

表2 预后良好组与预后不良组不同时间点的血清MMP-9 和BDNF 水平比较(ng/mL,)
注:与本组T1 时间点比较,*P <0.05;与本组T2 时间点比较,#P <0.05;与预后良好组比较,ΔP <0.05。MMP-9:基质金属蛋白酶-9;BDNF:脑源性神经营养因子
MMP-9 是基质金属蛋白酶家族主要成员,MMP-9激活会导致细胞外基质降解,BBB 通透性升高,从而导致脑水肿等病理状态[19]。多项研究表明MMP-9 水平与脑微循环受损程度相关,其水平升高提示ACI 患者预后差[20-21]。本研究发现MMP-9 水平变化与预后相关,T5时间点,预后不良组MMP-9 水平高于预后良好组,差异有统计学意义(P <0.05)。
BDNF 是神经营养因子家族的重要成员之一,与ACI 密切相关[8,22]。既往研究认为患者BDNF 会代偿性增高,其增高对缺血后神经损伤有保护性作用[23],BDNF 水平低提示患者预后差[24]。本研究显示,BDNF水平变化与预后密切相关,预后良好组T2时间点BDNF水平高于T1时间点,T5时间点BDNF 水平高于T2时间点,差异均有统计学意义(均P <0.05),预后不良组入院的BDNF 水平较高,之后,预后不良组T2时间点和T5时间点BDNF 水平均低于T1时间点,差异均有统计学意义(均P <0.05),总体与既往研究相符[23-24]。关于入院BDNF 水平,本研究认为疾病最初期BDNF水平上升是机体对缺血性损伤的内源性代偿,其高水平提示初始缺血性损伤严重。
综上所述,MMP-9 和BDNF 水平的变化与ACI预后密切相关,在发病最初期,BDNF 水平高提示预后可能不佳,在治疗数日后,MMP-9 水平高,BDNF 降低提示预后不佳,对早期预测ACI 预后具有一定的临床应用价值。
