HNO3改性促进活性炭低温脱硝机理的研究
2021-03-27郭倩倩侯亚芹刘勇进李风海黄张根
郭倩倩,景 文,侯亚芹,刘勇进,李风海,黄张根,*
(1.菏泽学院 化学化工学院,山东 菏泽 274015;2.中国科学院山西煤炭化学研究所,煤转化国家重点实验室,山西 太原 030001;3.山东玉皇化工 (集团)有限公司,山东 菏泽 274500)
燃煤烟气中的NO是一种主要的大气污染物,会造成酸雨、光化学烟雾、臭氧层破坏,严重危害环境和人体健康[1],因此,有效控制NO的排放是目前亟待解决的重大问题。
以NH3为还原剂的选择催化还原(SCR)是目前最有效和应用最广泛的脱硝方法[2]。目前,工业上主要采用V2O5/TiO2和V2O5-WO3/TiO2催化剂,为避免 SOx的毒化作用,操作温度是 300−400 ℃[3],这与现有的锅炉系统不匹配。低温SCR装置可直接置于除尘和脱SO2床层之后,不仅易于与现有锅炉系统匹配,还可缓解粉尘和SO2对催化剂的堵塞和毒化。
活性炭(AC)作为低温脱硝催化剂,成本较低,制备方法简单,已被广泛应用于 NO 的脱除[4-6]。但AC本身的脱硝活性较低,通过改性提高其脱硝性能得到了广泛关注[7-10]。前期研究结果表明,采用HNO3在不同温度下对AC进行改性处理,随改性温度升高NO转化率明显提高,通过漫反射红外光谱、X射线光电子能谱、热重-质谱联用等方法表明羧基、酸酐和羟基这三种含氧基团含量随改性温度升高明显增加,这是HNO3改性后样品NO转化率提高的主要原因[11]。然而,大量文献研究表明,含氧基团含量增加一方面能明显促进NH3的吸附[11-13];另一方面能促进 NO 向 NO2的氧化[14, 15],这些结果均会导致AC脱硝活性提高,但是对哪种因素发挥主要作用尚不明确;而且随反应温度升高,这些促进作用是否会发生改变尚不清楚。因此,针对以上问题需要进行深入研究。
为了研究HNO3改性对AC低温脱硝机理的影响,将不同温度HNO3改性前后样品在30−250 ℃进行脱硝活性测试,通过程序升温脱附(TPD)和瞬态响应实验对脱硝机理进行分析。
1 实验部分
1.1 AC的氧化
煤基AC为山西新华化工厂商业品,将其研磨、筛分至30−60目,称取10 g置于烧瓶中,加入5 mol/L 的 HNO3溶液 50 mL,在 30、60 或 80 ℃ 下处理10 h,然后过滤、清洗至洗涤液近中性,在110 ℃干燥10 h。改性后样品依据处理温度不同分别标记为 ACN30、ACN60 和 ACN80。HNO3改性前后样品的物理化学性质详见前期研究结果[11]。
1.2 活性测试
活性测试在内径为10 mm固定床反应器上进行,催化剂装填质量为2 g,将催化剂置于反应器中部,在N2气氛下加热至反应温度后通入模拟烟气,各组分组成见表1,反应温度通过程序控温仪控制。
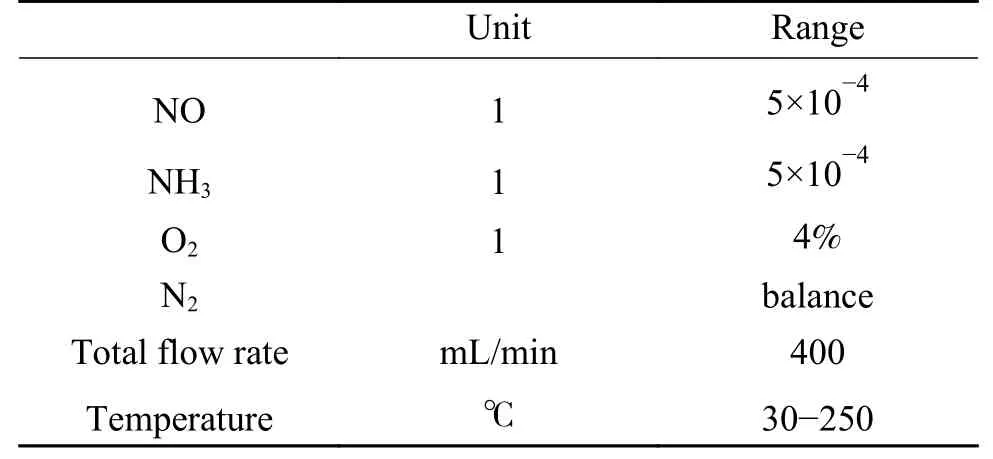
表1 活性测试反应条件Table 1 Reaction conditions for activity test
为避免NH3与NO在通入反应器之前进行反应,将NH3直接通入反应器。原料气与反应尾气中NO及O2含量采用燃气分析仪(KM9106 Quitox,Kane-May International Limited) 进 行 在 线 检 测,NH3的含量采用JNYQ-I-41C型NH3分析仪进行在线检测。在特定条件下,采用Gasmet DX4000型红外分析仪对出口气体含量进行检测,出口N2O 含量低于 5×10−6,表明 AC 上所进行的 SCR反应具有非常高的选择性。在测试过程中,每个反应温度点持续反应3 h以上直至稳定后获得该温度点的NO转化率,然后升温至下一温度点。
1.3 TPD实验
为了研究HNO3改性前后样品上NO和NH3的吸附情况,进行了有氧条件下NO和NH3的吸附以及吸附后的TPD实验。吸附实验所采用的反应器与活性测试相同。将1 g样品置于固定床反应器内,反应气氛为 NO + O2+ N2或 NH3+ O2+ N2,总气量为400 mL/min,所需组分含量与活性测试实验相同。吸附饱和后,用相同气量的N2进行吹扫以除去物理吸附的气体,然后在总气量为400 mL/min的N2气氛下进行TPD实验,升温速率为5 ℃/min,由吸附温度升至500 ℃。在吸附和TPD实验过程中,尾气中NO和NO2含量采用燃气分析仪(KM9106 Quitox, Kane-May International Limited)进行在线检测,NH3的含量采用JNYQ-I-41C型NH3分析仪进行在线检测,脱附量由脱附曲线进行计算而得。
1.4 瞬态响应实验
瞬态响应实验的总气量为400 mL/min,首先将模拟烟气(组成与脱硝活性测试相同)通入装有2 g样品的固定床反应器中进行反应。当反应达到稳定后,将NO或NH3从反应气氛中除去,同时补充等体积的N2,保证剩余组分的含量以及总气量不变。当出口NO和NH3含量达到新的稳态后,再重新通入已除去的气体同时改变N2流量,保证反应条件与最初的实验条件相同,直至达到新的稳态。在整个过程中,在线检测出口NO和NH3的含量。
2 结果与讨论
2.1 活性测试
图1为各样品NO转化率随反应温度的变化关系。AC本身NO转化率随反应温度升高逐渐降低,当反应温度高于150 ℃时,NO转化率趋于稳定,维持在10%左右。ACN30的NO转化率随反应温度的变化趋势与AC相似,只是在各温度点NO转化率有所增加,当反应温度高于150 ℃时,NO转化率维持在22%左右。然而,ACN60和ACN80的NO转化率均随反应温度升高呈现先降低后升高的变化趋势,当反应温度为90 ℃时最低,反应温度高于150 ℃后趋于稳定,分别维持在50%和90%左右。

图1 NO 转化率随反应温度的变化Figure 1 Variation of NO conversion with reaction temperature over AC
前期研究结果表明,AC经HNO3改性后,随改性温度升高,物理结构以及含氮基团含量随改性温度变化不明显,羧基、酸酐和羟基这三种含氧基团含量随改性温度升高明显增加,这是HNO3改性后样品NO转化率提高的主要原因[11]。由图1可以看出,在30−250 ℃,含氧基团含量的不断增加不但有效提高了NO转化率,而且改变了NO转化率随反应温度的变化趋势。AC和ACN30上NO转化率均随反应温度升高逐渐降低,对于ACN60和ACN80,NO转化率随反应温度升高先降低后升高,这明显存在不同反应机理或者至少是反应速率控制步骤发生了改变[16, 17]。为了分析含氧基团对脱硝反应机理的影响,对AC和ACN80进行了TPD和瞬态响应实验。
2.2 TPD 表征
将不同温度下NO+O2+N2吸附饱和后样品进行TPD实验,对脱附曲线进行积分,得到AC 和ACN80上NOx的脱附量,结果见图2。图2(a)中,随温度升高,AC上NOx的脱附量明显降低,当温度为 150 ℃ 时,NOx的脱附量仅为 0.004 mmol/g,随温度的进一步升高脱附量变化不明显。此外,在30 ℃时,NO2是主要的脱附产物,当温度升至50 ℃时,NO的脱附量变化不大,而NO2的脱附量明显降低,NO成为主要的脱附产物,当温度升至120 ℃时,已经检测不到NO2的脱附,NO的脱附量明显降低,这表明升高温度不利于NO的吸附以及NO向NO2的氧化[18]。
由图 2(b)可知,ACN80上NOx的脱附量随反应温度的变化趋势与AC相似,只是在温度低于90 ℃时NOx的脱附量与AC相比略低,这表明增加AC上含氧基团的含量不利于低温下NOx的吸附。此外,当温度为30 ℃时,ACN80上NO2的脱附量(0.458 mmol/g)占 NOx脱附总量(0.611 mmol/g)的75.0%,这明显高于AC上的59.6%,这说明含氧基团提高了AC的氧化性,有效促进了NO向NO2的氧化,随温度升高氧化作用减弱,当温度高于90 ℃时,AC和ACN80上NOx的脱附量相当,当温度高于150 ℃时,AC和ACN80上NOx的脱附量均不发生明显变化。以上结果表明,含氧基团一方面不利于NOx的吸附;另一方面有效促进了NO向NO2的氧化,当反应温度高于90 ℃时,AC和ACN80上NOx的脱附量及其随温度的变化趋势一致,这说明含氧基团影响NOx的吸附行为并不是AC和ACN80在反应温度高于90 ℃后脱硝性能存在明显差异的原因。
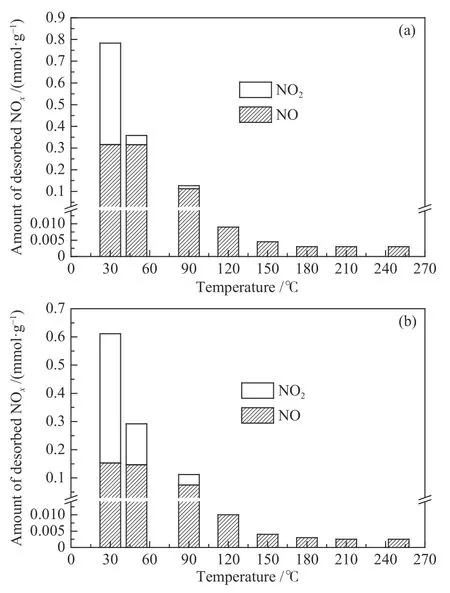
图2 AC (a)和 ACN80 (b)不同温度下 NOx 的脱附量Figure 2 Amount of NOx desorbed on AC (a) and ACN80 (b)at various temperatures
将不同温度下 NH3+ O2+ N2吸附饱和后样品进行TPD实验,对脱附曲线进行积分,得到AC和ACN80不同温度下NH3脱附量,结果见图3。AC和ACN80上NH3脱附量均随反应温度的升高而降低,当反应温度高于150 ℃时趋于稳定,这与NOx脱附量随反应温度的变化趋势一致。ACN80上各反应温度下NH3脱附量都明显高于AC,尤其在温度较低时更加明显,这表明增加AC上含氧基团的含量能明显促进 NH3的吸 附[12, 13]。

图3 AC 和 ACN80 不同温度下 NH3 的脱附量Figure 3 Amount of NH3 desorbed on AC and ACN80 at various temperatures
值得注意的是,当温度为30 ℃时,AC上NOx脱附量(0.783 mmol/g)约是 NH3脱附量(0.018 mmol/g)的43倍,随温度升高比值降低,当温度升至150 ℃以上时,NOx脱附量与NH3脱附量相当。而对于 ACN80而言,30 ℃时 NOx脱附量(0.611 mmol/g)约是 NH3脱附量(0.286 mmol/g)的2倍,随温度升高比值也降低,当温度升至150 ℃以上时,NOx脱附量仅占NH3脱附量的7%。这些结果表明,NOx脱附量随反应温度的下降速度要明显高于NH3。
结合TPD结果和图1活性测试结果进行分析可得:(1)AC上NO转化率随反应温度升高而降低,这与样品上NOx和NH3的吸附随反应温度的变化趋势一致,反应物(NOx或NH3或两者)的吸附应该是该过程的速率控制步骤[18, 19]。(2)当反应温度高于150 ℃时,所有样品的NO转化率均趋于各自的稳定值,NOx和NH3的脱附量在150 ℃后基本保持稳定为此提供了依据。(3)AC上含氧基团含量增加能促进NO向NO2氧化以及NH3吸附,两者都有可能导致NO转化率提高,但因为当温度高于90 ℃时,AC和ACN80上NOx的脱附量及其随温度的变化趋势一致,所以含氧基团促进NH3吸附应该是ACN80在反应温度高于90 ℃时NO转化率提高的主要原因。
但当温度为30 ℃时,ACN80的NH3脱附量约是AC的16倍,而NO转化率仅由AC的63.0%升高至69.2%,仅仅提高了6.2%。为了进一步解释这一现象,对 30 ℃ 时 ACN80 上 NH3+ O2和 NH3+NO + O2两种气氛达到稳定后样品进行NH3的TPD实验,脱附曲线结果见图4。由图4可知,NH3在这两种实验条件下的脱附曲线非常相似,这表明反应气氛中是否存在NO对ACN80上NH3的吸附几乎没有影响。换句话说,在30 ℃时,吸附于ACN80上的NH3几乎不与NO进行反应,这可能是导致该温度下含氧基团明显促进了NH3的吸附,但NO转化率并未明显提高的主要原因。
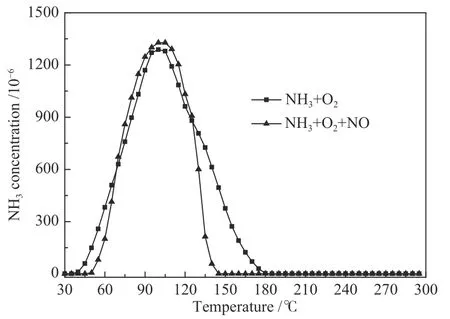
图4 ACN80 在 30 ℃ 不同反应条件下 NH3 的脱附曲线Figure 4 TPD profiles of NH3 after co-adsorption of NH3 and O2 and NO reduction with NH3 over ACN80 at 30 ℃
2.3 瞬态响应实验
为了进一步研究含氧基团对AC脱硝机理的影响,进行了瞬态响应实验,图5为AC在30 ℃时NO和NH3的瞬态响应实验。由图5(a),当反应达到稳定时,将NO从反应气氛中除去,出口NO含量在最初的2 min内迅速下降,之后下降速率减缓,在25 min后出口NO含量降至零;相应的,出口NH3含量缓慢增加,在30 min后基本达到入口含量。当反应气氛中重新通入NO,则在出口立即检测到NO,其含量增加然后达到稳定状态;相应的,出口NH3含量缓慢降低,在20 min后达到稳定状态,且NO瞬态响应实验前后出口NO和NH3的含量相当。
分析以上结果可得:(1)反应过程中,AC上存在一定量吸附态的NO,将NO从反应气氛中除去后,部分会随着反应气从AC上脱附。(2)出口NH3含量缓慢升至入口以及缓慢降至稳定状态表明,NH3在AC上存在明显的吸附行为,应该主要是以吸附态形式参与反应。(3)当反应气氛中重新通入NO,出口NO含量能够较快达到稳定状态,可能是由于NO能够快速吸附并进行反应达到平衡,因为在NH3存在情况下,NO在AC上的吸附量很小[18]。
为了进一步确定反应过程,进行了NH3瞬态响应实验,结果如图5(b)所示。当反应达到稳定时,将NH3从反应气氛中除去,出口NO含量随反应时间的延长而缓慢增加,在30 min后增加至3.45×10−4(即对应NO转化率为31.0%),随后出口NO含量并没有继续上升至入口含量,而是随反应时间的延长而降低,并在大约10 min后达到新的稳定值3.10×10−4,在这一过程中出口并未检测到 NO2;相对应的,NH3含量缓慢降低,在35 min后降至零。
图5 30 ℃ 下 NO (a)和 NH3 (b)瞬态响应实验Figure 5 Results of transient response experiments of NO (a) and NH3 (b) at 30 ℃
当NH3从反应气氛中除去,出口NH3含量缓慢降低表明,在反应中AC上会存在一定量吸附态的NH3,部分会随着反应气从AC上脱附。而出口NO含量随反应时间延长先增加后降低,表明可能存在以下两种反应过程:第一,出口NO含量受吸附态NH3的影响,吸附态NH3占据活性位不利于NO的吸附,随着吸附态NH3的不断减少所产生的影响降低;第二,NH3从反应气氛中去除后,NO在O2存在的条件下发生氧化吸附致使NO发生一定程度的转化,而且在70 min内生成的NO2全部吸附于AC上[18, 20],这样致使出口NO含量远未升至入口且没有检测到NO2逸出。出口NO含量先升高后降低的变化趋势是因为在AC上主要的反应过程由过程一转变为过程二,而且出口NO含量达到最大值所对应的时间(30 min)与出口NH3含量降至为零的时间(35 min)相近也支持这一结论。
切断NH3后70 min再重新通入,出口NO含量在最初的10 min内有所增加,但之后又缓慢降低达到稳态;相对应的,出口NH3含量在重新通入NH3后的70 min内一直为零,之后才缓慢上升至稳态,且NH3瞬态响应实验前后出口NO和NH3的含量相当。为了解释出口NO和NH3含量的变化情况,将NH3重新加入至达到稳定状态(70−180 min)的过程分为三个阶段。阶段Ⅰ(70−80 min),出口NO含量随反应时间延长而增加,出口NH3含量为零。这可能是由于气相NH3的加入会与NO发生竞争吸附,在一定程度上破坏了NO的氧化吸附平衡从而导致出口NO含量升高,在该阶段中NH3完全吸附或参与反应,致使出口NH3含量为零。阶段Ⅱ(80−125 min),出口 NO 含量随反应时间延长而降低,出口NH3含量为零。在这一阶段中NH3与NO进行反应,致使出口NO含量降低。与阶段Ⅰ相似,阶段Ⅱ中NH3亦完全吸附或参与反应。阶段Ⅲ(125−180 min),出口NO含量达到稳定状态,而出口NH3含量在125−140 min仍为零,之后逸出缓慢达到稳定状态。在该阶段中出口NO含量稳定可能是由于NH3经过阶段Ⅰ和阶段Ⅱ的吸附或参与反应后,可以维持较稳定的NO转化。而出口NH3在180 min时才达到稳定状态可能是由于一部分NH3参与反应,继续维持出口NO含量的稳定状态,而另一部分NH3则继续吸附于AC上,而且这部分NH3的吸附主要发生在NH3与吸附态NOx(切断NH3后70 min内所生成的)及反应气氛中NO的反应达到平衡之后(即阶段Ⅲ),并且在30 ℃时这部分吸附态NH3与NO的反应能力很差,几乎不影响稳定条件下NO的转化率。这一结论得到以下数据的支持:(1)在室温时,AC经NO与O2共存后会在样品上形成含氧基团,而且这些含氧基团与吸附态NOx相比酸性较弱,NH3应该与吸附态NOx及反应气氛中NO的反应达到平衡后,再吸附于酸性含氧基团上;(2)所形成的这些酸性含氧基团能够显著促进NH3吸附,但这部分吸附态NH3在30 ℃时几乎不与NO进行反应,图4的实验结果也证明了这一结论。但由于NH3切断时间相对较短,所形成的含氧基团含量可能较少,致使瞬态响应实验前后出口NO和NH3含量并未发生明显改变。
同样,采用NO和NH3瞬态响应技术对ACN80在30 ℃时的脱硝机理进行研究,该结果与AC相似,只是在NH3的瞬态响应实验中重新通入NH3后逸出时间延长,这是由于含氧基团的增加促进了NH3的吸附,NH3的TPD实验结果也证明了这一结论。
为了进一步解释随反应温度升高,AC和ACN80上NO转化率的差异,进行了150 ℃时NO和NH3瞬态响应实验,结果见图6。为了清晰地比较AC和ACN80出口NO含量在整个实验过程中的差异,图中未给出所对应出口NH3含量的变化曲线。
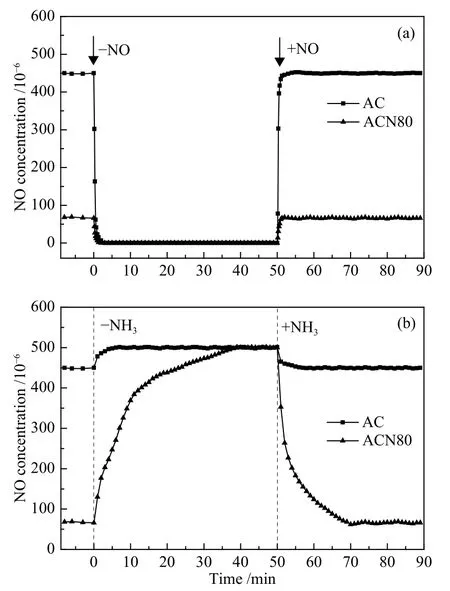
图6 150 ℃ 下 NO (a)和 NH3 (b)瞬态响应实验Figure 6 Results of transient response experiments of NO (a)and NH3 (b) over AC and ACN80 at 150 ℃
由图6(a)可知,对于AC而言,当反应达到稳定时,将NO从反应气氛中除去,出口NO含量迅速下降,并在2 min后变为零。当在反应气氛中重新加入NO,则在出口立即检测到NO,其含量迅速增加并在3 min后达到稳定状态。ACN80的NO瞬态响应实验结果与AC相似,只是ACN80出口NO含量较低,对应其较高的NO转化率。在AC和ACN80上都没有检测到NO明显的吸附行为,这主要是由于两样品在150 ℃时NO的吸附量都很小(图2中NOx的脱附结果可以证明这一结论)。
图6(b)为 AC和 ACN80上NH3的瞬态响应结果。在AC上,当反应达到稳定时,将NH3从反应气氛中除去,NO含量随反应时间的延长而增加,在5 min后增加至入口含量。当切断NH3的50 min后再重新通入NH3,出口NO含量在之后的大约5 min内达到稳定。与NO的瞬态响应结果不同,ACN80与AC的NH3瞬态响应结果存在明显差异。在ACN80上,当反应达到稳定时,将NH3从反应气氛中除去,NO含量随反应时间的延长而缓慢增加,在大约40 min后增加至入口含量,这一时间远高于AC上出口NO含量达到入口的时间。这表明在ACN80上可能存在大量吸附态NH3,当反应气氛中除去NH3后,吸附态的NH3会与NO进行反应,致使出口NH3含量缓慢增加,随着吸附态NH3减少,反应速率逐渐降低,直到可以参与反应的吸附态的NH3完全消耗,最终出口NO含量升至入口。当切断NH3的50 min后再重新加入,出口NO含量降低,在20 min后缓慢达到稳定状态,这表明NH3可能需要先吸附于样品上,才能与参与反应,最终达到反应稳定状态。两样品在NO和NH3瞬态响应实验前后出口NO含量相当,这表明以上实验条件没有引起样品反应性能的改变。
2.4 反应机理的探讨
对于SCR反应,文献中存在着两种反应机理。一种是Eley-Rideal(E-R)机理:SCR反应发生于吸附态的NH3与气相(或弱吸附)的NO之间,两者最终生成N2和H2O。另一种是Langmuir-Hinshelwood(L-H)机理:SCR反应发生于处在相邻活性位的吸附态的NO和吸附态的NH3之间,然后相互作用生成 N2和 H2O[18, 19, 21-25]。在这两种 SCR反应机理中,NH3的吸附是必须的,而本文中TPD实验结果表明,AC对NO的吸附能力要明显高于NH3,含氧基团的增加又显著促进了NH3的吸附,对于AC和ACN80上SCR反应机理有如下解释。
AC上的SCR反应主要通过吸附态NOx与吸附态NH3进行,即主要遵循L-H机理。30 ℃时瞬态响应实验中,切断NO和NH3后,出口NO和NH3缓慢降至零,这表明反应过程中AC上存在一定量吸附态NOx和吸附态NH3,重新通入NO和NH3后,需要经过一定时间达到稳定状态,这表明反应物需要吸附才可以进行反应。150 ℃时的瞬态响应实验中,吸附行为并不明显,可能是由于该温度下NO和NH3在AC上的脱附量都很小,所以并不存在明显的吸附过程即达到反应的稳定状态。AC脱硝活性测试(图1)与反应物脱附结果(图2和图3)随反应温度的变化趋势一致进一步表明吸附是速率控制步骤[18, 19]。AC上的脱硝反应主要是在吸附态NO与吸附态NH3之间进行,NO和NH3分别吸附于相邻的活性位,然后相互作用生成产物[26]。
对于ACN80,30 ℃时瞬态响应实验结果与AC相似,反应主要遵循L-H机理。由150 ℃的瞬态响应实验结果明显看出,ACN80上反应主要是通过吸附态NH3与气相中NO之间进行,即主要遵循E−R机理。ACN80上NO转化率出现图1中变化趋势可能是随反应温度升高SCR反应过程由L-H机理逐渐向E-R机理转变然后趋于稳定。在30−90 ℃,反应以遵循L-H机理为主,反应物的吸附是速率控制步骤,随反应温度升高,吸附能力降低,NO 转化率降低;在 90−250 ℃,以遵循 ER机理为主,吸附态NH3逐渐活化为具有较高反应活性的等结构[27, 28]是速率控制步骤,NO转化率在90−150 ℃随反应温度升高而升高,主要是由于升高温度有利于吸附态NH3的活化,当反应温度高于150 ℃时,活化达到稳定状态,NO转化率也趋于稳定。
3 结 论
采用TPD和瞬态响应方法研究了含氧基团对脱硝机理的影响。结果表明,AC上的SCR反应主要遵循L-H机理,反应物的吸附是速率控制步骤。ACN80在 30−90 ℃主要遵循 L-H机理,在90−250 ℃主要遵循E-R机理,吸附态NH3的活化是速率控制步骤。AC上含氧基团的增加促进了NH3的吸附,但这部分吸附态NH3在30 ℃时几乎不参与反应,随反应温度升高不同程度活化,这是90−150 ℃ NO转化率随反应温度提高的主要原因,当温度高于150 ℃时,活化达到稳定状态,NO转化率也趋于稳定。
