慢性乙型病毒性肝炎肝硬化合并非酒精性脂肪性肝病的临床探讨
2021-03-27于蕊孙倩师强伟王春峰姚建宁张连峰
于蕊 孙倩 师强伟 王春峰 姚建宁 张连峰
慢性乙型病毒性肝炎(简称慢乙肝)是世界性的公共卫生问题,约有3.5亿人口受其困扰,其中亚太地区发病率较高。CHB也是我国肝细胞肝癌和终末期肝病的主要原因[1]。非酒精性脂肪性肝病(NAFLD)是欧美等西方国家最常见的慢性肝脏疾病,近年来其发病率在我国也呈上升趋势[2-3]。随着人们生活方式改变和肥胖人群数量增加,合并NAFLD的CHB患者也越来越多。在全球范围内,CHB患者和乙型肝炎病毒(HBV)慢性感染患者中的NAFLD患病率约为12.1%~76.0%[4],因NAFLD的诊断标准及地域、人种不同,其患病率差异也较大。有研究发现,HBV慢性感染者中NAFLD的发病率较非HBV感染人群低,且乙肝表面抗原(HBsAg)阳性率与NAFLD呈负相关[5-6]。目前关于慢乙肝肝硬化患者脂肪肝发病率的研究有待进一步深入,我们对我院经肝脏组织病理学检查诊断的慢乙肝肝硬化患者NAFLD的发病率及临床特点进行回顾性分析,现报道如下。
对象与方法
1.对象:收集2005年1月~2017年12月在我院住院的慢性HBV感染且经肝脏组织穿刺病理活检确诊为肝硬化的患者226例,排除显著饮酒2例,合并丙型肝炎病毒(HCV)感染1例,合并丁型肝炎1例,最终共纳入慢乙肝患者222例。其中男180例,女42例,年龄18~64岁,平均年龄(33.6±9.2)岁。纳入标准:(1)年龄≥18岁;(2)乙肝表面抗原(HBsAg)阳性时间≥6个月,肝脏穿刺肝纤维化评分≥4(Scheuer评分系统)。排除标准:(1)合并甲、丙、丁、戊型肝炎病毒和人类免疫缺陷病毒感染;(2)诊断为肝细胞肝癌或者其他恶性肿瘤;(3)合并自身免疫性肝病、酒精性肝病、药物性肝损伤、肝豆状核变性及血色病;(4)显著饮酒。本研究经我院伦理委员会审批通过。
2.方法
(1)肝脏穿刺检查:在超声定位引导下,由经验丰富的临床医师行肝脏组织穿刺检查,采用Bard 16G一次性活组织检查针快速穿刺,获取长度为1.0~2.0 cm的肝脏组织,包含6个以上汇管区。标本采用10%甲醛固定,常规脱水,石蜡包埋,制片,常规Masson、苏木素-伊红(HE)及网状纤维染色,并由本院专业病理科医师阅片评估脂肪变程度、炎症和纤维化分期及分级,肝硬化诊断符合Scheuer评分系统肝纤维化评分≥4[7],NAFLD诊断符合《非酒精脂肪性脂肪性肝病诊疗指南(2010年修订版)》的病理诊断标准[8]。
(2)生化指标检测:使用全自动生物化学检测仪测定患者的血常规、ALT、AST、白蛋白(Alb)、总胆红素(TBil)、肌酐(Cr)、总胆固醇(TC)、甘油三酯(TG)及低密度脂蛋白胆固醇(LDL-C)水平。
(3)病毒学指标检测:HBV DNA和HBV血清学指标分别采用实时荧光定量聚合酶链反应仪及其配套试剂(广东达安)和Roche Elecsys方法检测。
结 果
1.NAFLD组和非NAFLD组患者临床资料比较:222例慢乙肝肝硬化患者中,合并NAFLD者19例(8.56%)。根据是否合并NAFLD将222例患者分为NAFLD组19例和非NAFLD组203例。与非NAFLD组患者比较,NAFLD患者的年龄更大,TG和AST水平更高(P<0.05),而两组患者血常规及病毒学指标比较差异均无统计学意义(P>0.05)。见表1。

表1 NAFLD组和非NAFLD组患者临床资料比较M(P25,P75)
2.慢乙肝肝硬化患者发生NAFLD的危险因素分析:Logistic单因素回归分析结果显示,年龄、AST水平和TG水平是乙肝肝硬化患者发生NAFLD的影响因素(P<0.05),而HBV DNA、HBsAg及乙肝e抗原(HBeAg)状态与其无相关性(P>0.05),见表2。二元logistic回归分析结果显示,年龄增加(OR=1.087,95%CI1.025~1.152)、AST水平升高(OR=1.003,95%CI1.002~1.004)及TG水平升高(OR=1.971,95%CI1.759~2.230)是慢乙肝肝硬化患者发生NAFLD的独立危险因素。
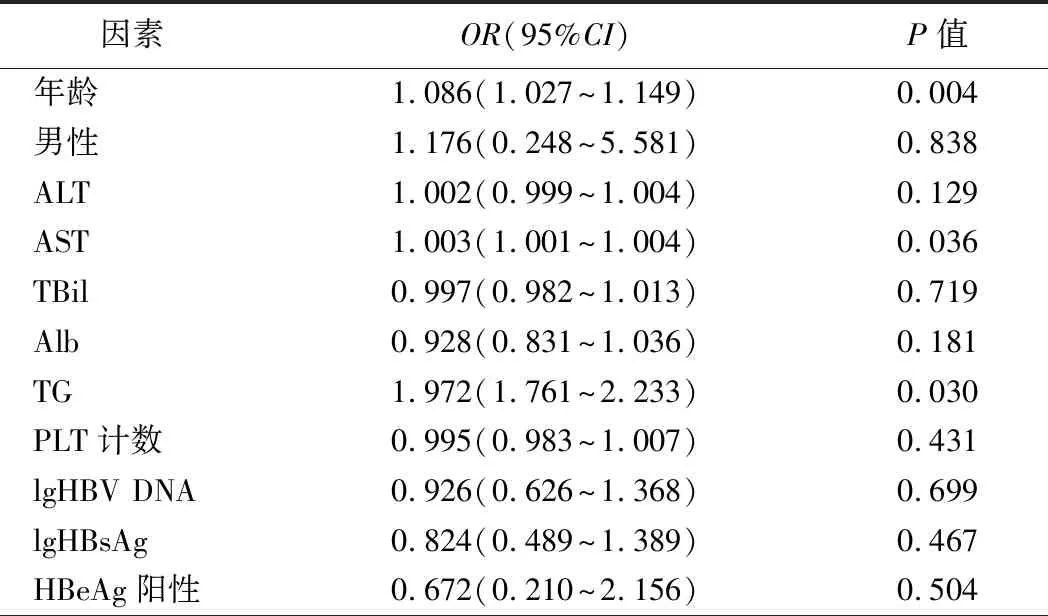
表2 慢乙肝肝硬化患者发生NAFLD的logistic单因素回归分析
讨 论
本研究结果显示,慢乙肝肝硬化患者的NAFLD患病率为8.56%,logistic回归分析结果显示,高龄、AST水平及TG水平升高是慢乙肝肝硬化患者发生NAFLD的危险因素。
据文献报道,在全球范围内,慢性HBV感染者中合并NAFLD的发生率为12.1%~76.1%[4]。一项Meta分析结果显示,慢性HBV感染者中NAFLD的发生率为29.6%[9],均高于本研究中慢乙肝肝硬化患者NAFLD的发生率(8.56%)。肝脏作为脂质代谢的重要器官,在脂类的合成、分解和运输中均具有重要作用,有研究结果显示肝硬化患者血脂水平较低[10-11],而多项研究发现,高TG水平是NAFLD发生的危险因素[12-14],这可能是本研究中NAFLD患病率较低的原因。
本研究发现,年龄增加、AST及TG水平升高是慢乙肝肝硬化患者发生NAFLD的危险因素,与既往研究结果一致[15]。老龄人群中NAFLD的患病率较高,推测可能与衰老相关的肝脏储备能力减弱、肝脏代谢酶活性下降、易受到多重打击而使得肝细胞脂肪变性有关[16];此外,随着年龄增长,胰岛素抵抗的发生率增加,导致脂肪分解和游离脂肪酸产生增多,大量游离脂肪酸可被肝脏摄取导致肝脏内脂质沉积。本研究结果显示,合并NAFLD患者的AST水平明显高于不合并NAFLD患者;而两组患者ALT水平比较差异无统计学意义,与既往报道慢乙肝接受口服抗病毒药物人群的研究结果一致[17];这在一定程度上提示,合并NAFLD的肝硬化患者转氨酶水平更高,反映出更严重的肝脏炎症程度,有加速肝纤维化进展及肝细胞肝癌发生的潜在风险[18]。TG由肝脏合成,再以极低密度脂蛋白的形式转运出肝脏,当摄入及合成脂类过多、肝脏转出能力下降而导致TG水平升高时,肝细胞内就会出现大量的脂滴堆积,从而形成肝细胞脂肪病变[19]。目前,通过改善饮食、运动生活方式及减轻体重仍是预防和治疗NAFLD的首选方法[20]。
目前诊断NAFLD及肝硬化的方法较多,但均存在一定缺陷:超声作为最常见的方法,受操作者及机器影响较大;Fibroscan的诊断效力受皮肤肝包膜距离影响;多种无创指标联合诊断NAFLD及肝硬化均具有局限性[12]。本研究采用作为诊断金标准的肝脏活组织检查方法评估肝硬化及NAFLD,进一步增加了研究结果的可靠性。但本研究为回顾性研究,且合并NAFLD的肝硬化患者例数较少,在一定程度上影响了数据统计分析的效力;此外,本研究未收集与NAFLD相关的重要指标如BMI、血压、腹围等,因而需要更多大样本的前瞻性研究进一步探索和证实。
乙肝肝硬化是慢性HBV感染的一个特殊阶段,由代偿期肝硬化进展为失代偿期的年发生率为3%~5%,而其肝细胞癌的年发生率为3%~6%[21],因此需要密切监测和关注。本研究中乙肝肝硬化患者合并NAFLD的发生率虽然低于既往文献报道的慢性HBV感染者NAFLD的发生率,但因慢性HBV感染合并NAFLD可对肝脏造成双重打击,加速肝纤维化进展及肝细胞肝癌的发生风险,因此临床工作中如遇到高龄合并高血脂、转氨酶水平较高的患者需警惕NAFLD的发生,尽早采取干预措施。
