基于TGFβ/Smads信号通路探讨补肾促排卵汤治疗PCOS大鼠卵巢纤维化的分子机制*
2021-03-26王旭东周洁谈勇朱美红曹琳高洁仲晨霞
王旭东 ,周洁 ,,谈勇 ,朱美红 ,曹琳 ,高洁 ,仲晨霞
(1.南通市第一人民医院,南通 226001;2.南京中医药大学,南京 210029;3.南京中医药大学附属中西医结合医院,南京 210028)
多囊卵巢综合征(PCOS)是育龄女性常见的一种生殖内分泌疾病,全世界范围的发生率为5%~10%[1],该病的特征性表现多种多样,包括稀发排卵、月经紊乱、高雄激素血症、卵巢多囊样改变等[2]。据最新的研究显示,PCOS患者并发不孕症、2型糖尿病、心血管疾病、恶性肿瘤和心理疾病的风险显著增加[3-6]。PCOS的病理机制较为复杂,确切的机制至今仍不明确,目前已有的研究提示可能与下丘脑-垂体-卵巢(HPO)轴功能异常、高雄激素血症、胰岛素抵抗、卵巢功能异常、遗传异常、卵巢纤维化相关[7-9]。目前克罗米芬为PCOS的一线促排卵药物,由于克罗米芬对子宫内膜与宫颈的作用以及克罗米芬抵抗等原因,出现排卵率高、妊娠率低的临床结局,因此积极寻找临床治疗PCOS不孕症的有效药物改善PCOS不孕症患者的妊娠结局极为必要[10]。卵巢纤维化是PCOS重要的发病机制之一,能引起卵巢功能的异常[11],近来越来越受到关注,TGF-β/Smads信号通路在卵巢纤维化中起重要作用[9,12]。补肾促排卵汤为国医大师夏桂成教授治疗PCOS女性不孕症的临床经验方,本课题组既往研究也发现补肾促排卵汤联合氯米芬治疗多囊卵巢综合症所致不孕症,可提高周期妊娠率,改善妊娠结局[13]。本实验通过进一步探讨国医大师夏桂成教授临床经验方补肾促排卵汤对PCOS大鼠纤维化TGF-β/Smads信号通路的影响,探讨补肾促排卵汤通过调节卵巢纤维化治疗PCOS的可能性。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 40只SD雌性大鼠,SPF级,3周龄,体质量40~60 g,由南京医科大学实验动物中心提供,合格证号:SCXK(苏)2016-0002。饲养于南京医科大学实验动物中心,环境温度20~24℃,相对湿度60%~70%,24 h昼夜循环光环境。本实验方案由南京医科大学实验动物中心审核批准。
1.1.2 药品与试剂 补肾促排卵汤由炒当归10 g,淮山药 10 g,赤芍 10 g,白芍 10 g,牡丹皮 10 g,茯苓 10 g,熟地黄10 g,续断 10 g,红花 5 g,菟丝子10 g,五灵脂10 g,鹿角片 10 g,山茱萸 9 g。药物由南京中医药大学附属医院提供并制备成水煎剂2.232 g/mL,4℃冰箱冷藏,临时用生理盐水配成相应浓度。甲苯胺蓝染色液(1%硼酸盐法)(北京索莱宝科技有限公司,G3663);脱氢表雄酮(DHEA)(美国 APExBIO 公司,批号:B1375)。雌二醇(E2)、黄体生成激素(LH)、促卵泡激素(FSH)、睾酮(T)酶联免疫吸附实验(ELASA)试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:E-EL-0152c,E-EL-R0026c,E-EL-R0391c,E-EL-0155c);苏木精-伊红染色(HE)试剂盒及天狼猩红染液试剂盒(武汉赛维尔生物科技有限公司,批号:G1005,G1018);生物素标记山羊抗兔免疫球蛋白G(IgG)标记二抗、生物素标记驴抗山羊IgG标记二抗(武汉赛维尔生物科技有限公司,批号:GB23303、GB23404);转化生长因子-β1(TGF-β1)抗体(武汉三鹰生物技术有限公司,批号:21898-1-ap),p-Smad3及Smad7抗体(武汉赛维尔生物科技有限公司,批号:GB11174、GB1511);SYBR Green(瑞士罗氏公司,批号 04913914001);ECL 发光试剂盒(美国Thermo公司,批号32209);β-actin(武汉赛维尔生物科技有限公司,批号:GB11001)。
1.1.3 实验仪器 Rt2100c型酶标检测仪(美国Rayto公司);neofuge 13R型冷冻离心机(中国heal force公司);V300型扫描仪(中国EPSON公司);Image J分析软件(美国National Institutes of Health公司);Adobe PhotoShop型图像分析软件(美国Adobe公司);KZ-Ⅱ型匀浆仪,TSY-B型脱色摇床,ML-1600型平板显微镜(中国武汉赛维尔生物科技有限公司);NanoDrop2000超微量分光光度计(美国Thermo公司);AJC-0501-P纯水仪(中国重庆艾科浦公司);RM2016病理切片机(中国上海徕卡仪器有限公司);JJ-12J脱水机、JB-P5包埋机(中国武汉俊杰电子有限公司);Stepone plus荧光定量PCR仪(美国ABI公司);DYCZ-24DN型双垂直电泳仪,DYCZ-40D型转印电泳仪(北京六一仪器厂)。
1.2 方法
1.2.1 造模、分组及给药 40只SD大鼠,适应性饲养3 d后,随机分为空白组8只及脱氢表雄酮(DHEA)给药组32只,DHEA给药组每日颈部皮下注射DHEA 60 mg/kg溶于0.2 mL注射用大豆油中,空白组每日颈部皮下注射0.2 mL注射用大豆油,连续给药35 d[12],造模第20天开始于每日上午9∶00-10∶00制作大鼠阴道涂片,观察大鼠动情周期,大鼠失去规律的动情周期即为造模成功。将造模成功的大鼠随机分为模型组、补肾促排卵汤低、中、高剂量组,每组8只,各组间SD大鼠体质量无统计学意义(P>0.05)。补肾促排卵汤临床70 kg成人用量为124 g/d(生药)。按照体表面积法换算,补肾促排卵汤低、中、高剂量组分别予以5.58、11.16、22.32 g/kg生药(相当于临床70 kg成人等效量的0.5、1、2倍)。各组药物临用前按照10 mg/kg给药体积,用生理盐水配成适当浓度,连续灌胃给药4周,每日1次。同时空白组与模型组大鼠灌胃给予等量生理盐水。
1.2.2 动情周期的检查 给药第16天开始,每天上午9点到10点,用生理盐水蘸湿棉签行阴道涂片检查,来判断大鼠的动情周期:动情前期(P):以椭圆形有核上皮细胞为主,伴有少量菱形角化上皮及白细胞;动情期(E):以菱形角化上皮为主,伴有少量椭圆形有核上皮细胞及白细胞;动情后期(M):椭圆形有核上皮细胞、菱形角化上皮、白细胞比例相当;动情间期(D):以白细胞为主,伴有少量菱形角化上皮及椭圆形有核上皮细胞。
1.2.3 血清性激素水平的检测 腹主动脉取血收集血样,立即离心分离,取血清保存在-80℃留以后续性激素的检测。据ELISA试剂盒说明书检测血清中 E2、T、LH、FSH 水平。
1.2.4 大鼠卵巢组织病理形态的检查 取大鼠卵巢标本,使用4%多聚甲醛进行固定,石蜡包埋。石蜡切片厚度为4 μm。采用HE染色法对部分卵巢石蜡切片进行染色,在普通光学显微镜下观察各大鼠卵巢中卵泡的形态变化。采用天狼星红染色法对部分卵巢石蜡切片进行染色,在普通光学显微镜下对卵巢组织切片中纤维化部位进行采集,应用Image J软件进行纤维化阳性面积半定量分析[14]。
1.2.5 实时荧光定量聚合酶链反应(RT-qPCR)法检测大鼠卵巢 TGF-β1、Smad3、Smad7 mRNA 的表达 将100 mg卵巢冰冻组织加进匀浆管,用匀浆仪充分研磨,使用Trizol试剂提取卵巢样本总RNA,离心半径10 cm,12 000 r/min,离心10 min后吸取上清液,加入250 μL三氯甲烷,接着颠倒离心管15 s,予充分混匀,静置3 min,在4℃离心半径10 cm,12 000 r/min离心10 min,把上清液转移到另一新离心管中,加入0.8倍体积的异丙醇,颠倒混匀,-20℃放置15 min,4℃下离心半径10 cm,12 000 r/min离心10 min,吸除液体加接着入75%乙醇1.5 mL洗涤沉淀,4℃下12 000 r/min离心5 min,液体吸除干净后再将离心管置于超净台上吹3 min,加入15μL无RNA酶的水溶解RNA,55℃孵育5 min,用Nanodrop 2000测出RNA的纯度和浓度。接着根据逆转录试剂盒说明书将RNA逆转录成cDNA,反应条件:65℃5 min,42 ℃ 60 min,70 ℃ 5 min。RT-PCR检测,反应条件:95 ℃ 10 min;95 ℃ 15 sec,60 ℃ 60 sec,循环40 次。以内参基因 β-actin 为参照,采用 2-ΔΔCT方法测定目的基因水平的变化。引物序列见表1。

表1 PCR引物序列Tab.1 PCR primer sequences
1.2.6 Western Blot法测定大鼠卵巢 TGF-β1、p-Smad3、Smad7的蛋白表达 使用RIPA裂解缓冲液提取卵巢中总蛋白,将裂解后的混合物置于冰上保存15 min,然后于4℃离心半径10 cm,12 000 r/min离心10 min,取上清液进行Western Blot分析。取蛋白质样品加入10%SDS-PAGE凝胶中进行电泳分离,样品的浓缩压为75 V,分离压为120 V。接着将蛋白转至聚偏二氟乙烯氟(PVDF)膜,300 mA恒流转膜,0.5 h后取出PVDF膜,保留目的蛋白条带及内参蛋白条带,用5%脱脂牛奶封闭1 h,再用TBST清洗。将目标条带分别孵育于一抗TGF-β1、p-Smad3、Smad7、β-actin中4℃过夜。第2天将PVDF膜洗净后,于室温下孵育二抗1 h,再用TBST溶液洗净。接着滴加ECL发光液,使用化学成像仪检测目的蛋白的含量。采用Image J软件对目标条带进行灰度分析。
1.3 统计学方法 采用SPSS 22.0统计软件进行分析,计量资料以数±标准差(±s)表示,多组比较采用单因素方差分析,组间两两比较采用LSD检验,不符合正态分布或方差齐的组间比较采用Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
2 结果
2.1 补肾促排卵汤对各组大鼠动情周期的影响 空白组大鼠出现规律的动情周期,与空白组相比,PCOS模型组大鼠丧失规律的动情周期,且长时间处在动情间期,给予补肾促排卵汤治疗后,补肾促排卵汤中、高剂量组可有效地逆转这一病理变化,且高剂量组的效果更明显。见图1,图2。

图1 大鼠动情周期阴道分泌物细胞形态(甲苯胺蓝染色,×100)Fig.1 Cell morphology of vaginal secretions during estrous cycle in rats(Toluidine blue staining,×100)
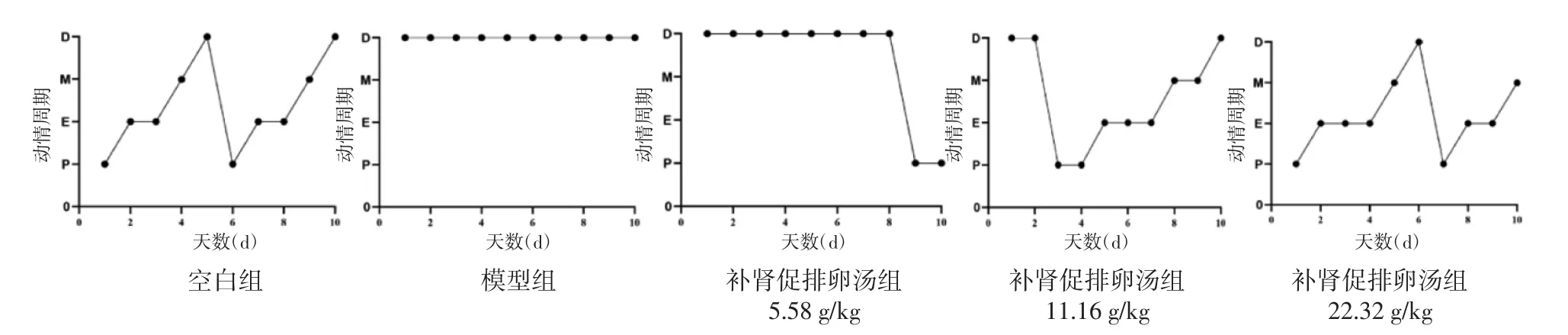
图2 补肾促排卵汤对各组大鼠动情周期的影响Fig.2 Effects of Bushen Cupailuan Decoction on estrous cycle of rats in each group
2.2 补肾促排卵汤对各组大鼠血清性激素水平的影响 与空白组相比,模型组血清T、LH水平显著升高(P<0.01),血清 E2、FSH 水平变化无统计学差异;与模型组相比,补肾促排卵汤低中高剂量组血清T水平及LH水平均有不同程度地降低,其中补肾促排卵汤高剂量组降低最为明显(P<0.01)。见表2。
表2 补肾促排卵汤对大鼠血清性激素水平的影响(±s)Tab.2 Effect of Bushen Cupailuan Decoction on serum sex hormone levels in rats(±s)
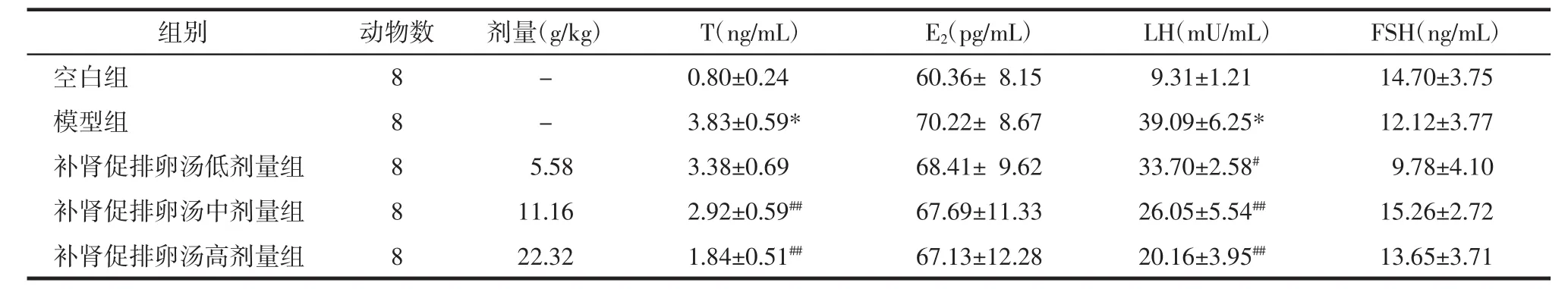
表2 补肾促排卵汤对大鼠血清性激素水平的影响(±s)Tab.2 Effect of Bushen Cupailuan Decoction on serum sex hormone levels in rats(±s)
注:与空白组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白组模型组补肾促排卵汤低剂量组补肾促排卵汤中剂量组补肾促排卵汤高剂量组动物数8 8 8 8 8剂量(g/kg)T(ng/mL)E2(pg/mL)LH(mU/mL)FSH(ng/mL)-0.80±0.24 60.36± 8.15 9.31±1.21 14.70±3.75-3.83±0.59* 70.22± 8.67 39.09±6.25* 12.12±3.77 5.58 3.38±0.69 68.41± 9.62 33.70±2.58# 9.78±4.10 11.16 2.92±0.59## 67.69±11.33 26.05±5.54## 15.26±2.72 22.32 1.84±0.51## 67.13±12.28 20.16±3.95## 13.65±3.71
2.3 补肾促排卵汤对各组大鼠卵泡发育及卵巢纤维化的影响 空白组大鼠卵巢组织切片镜下可见多个黄体及不同阶段发育的卵泡,极少见囊性扩张卵泡;模型组大鼠卵巢呈多囊样改变,可见囊状扩张的卵泡,黄体数目显著减少,卵泡内颗粒细胞层较空白组减少;经补肾促排卵汤低中、高剂量组治疗后上述病理改变可被有效改善,与模型组相比,补肾促排卵汤低、中、高剂量组卵巢组织中囊状扩张的卵泡减少,黄体数目增多,颗粒细胞层增厚,其中补肾促排卵汤高剂量组改善最为明显。见图3。与空白组相比,模型组大鼠卵巢纤维化阳性面积增多(P<0.01);与模型组相比,补肾促排卵汤低中高剂量组纤维化阳性面积均较模型组降低,且高剂量组的变化最为明显(P<0.01)。见图4,表3。
表3 补肾促排卵汤对各组大鼠卵巢纤维化阳性面积的影响(±s)Tab.3 Effect of Bushen Cupailuan Decoction on positive area of ovarian fibrosis of rats in each group(±s)%
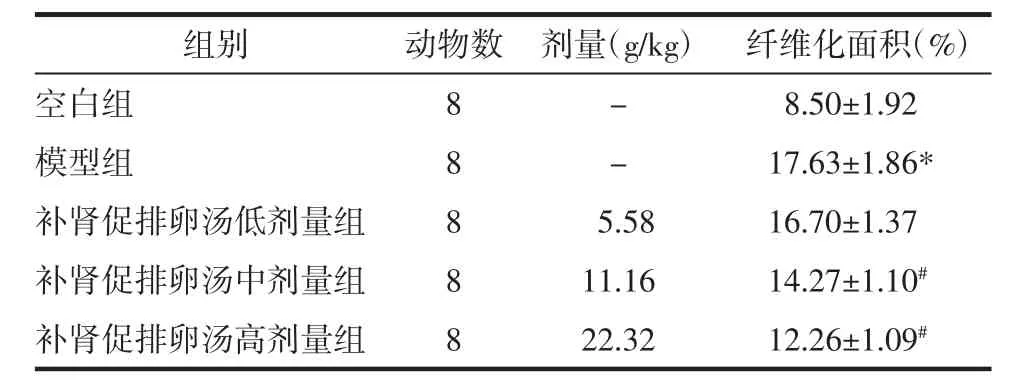
表3 补肾促排卵汤对各组大鼠卵巢纤维化阳性面积的影响(±s)Tab.3 Effect of Bushen Cupailuan Decoction on positive area of ovarian fibrosis of rats in each group(±s)%
注:与空白组比较,*P<0.01;与模型组比较,#P<0.01。
组别空白组模型组补肾促排卵汤低剂量组补肾促排卵汤中剂量组补肾促排卵汤高剂量组动物数8 8 8 8 8剂量(g/kg) 纤维化面积(%)-8.50±1.92- 17.63±1.86*5.58 16.70±1.37 11.16 14.27±1.10#22.32 12.26±1.09#
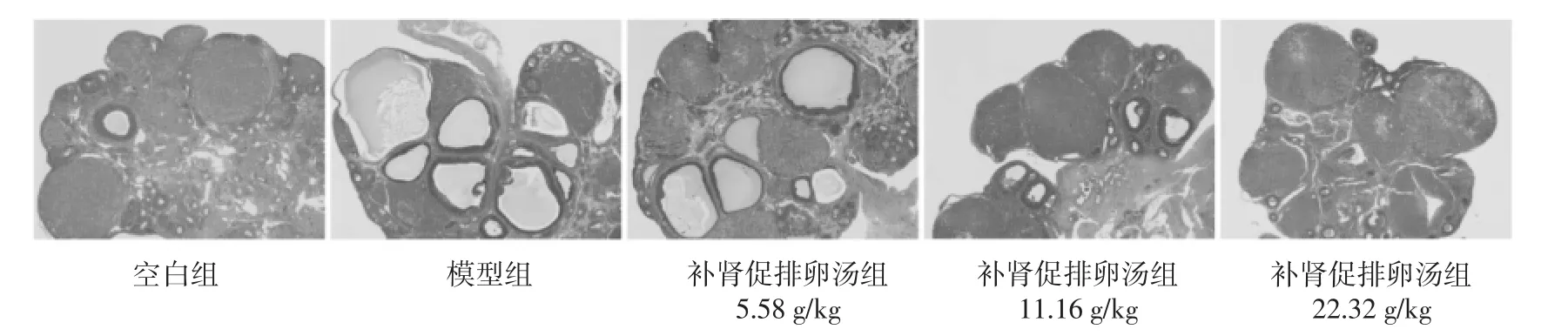
图3 PCOS大鼠卵巢内卵泡发育的变化(HE染色,×40)Fig.3 Changes of follicular development in ovaries of PCOS rats(HE staining,×40)
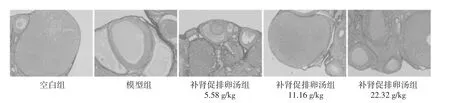
图4 PCOS大鼠卵巢纤维化的变化(天狼猩红染色,×100)Fig.4 Changes of ovarian fibrosis in ovaries of PCOS rats(Sirius red staining,×100)
2.4 补肾促排卵汤对各组大鼠卵巢组织TGF-β1,Smad3,Smad7mRNA的影响 与空白组比较,模型组大鼠卵巢组织TGF-β1、Smad3 mRNA表达显著升高,Smad7 mRNA 表达显著降低(P<0.01);与模型组比较,补肾促排卵汤中、高剂量组的TGF-β1 mRNA表达均程度不等地降低(P<0.05,P<0.01);补肾促排卵汤中、高剂量组Smad3 mRNA表达均程度不等地降低(P<0.01);补肾促排卵汤中、高剂量组Smad7 mRNA 的表达均程度不等地升高(P<0.05,P<0.01)。见表4。
表4 补肾促排卵汤对各组大鼠卵巢组织TGF-β1,Smad3,Smad7 mRNA的影响(±s)Tab.4 Effect of Bushen Cupailuan Decoction on TGF-β1,Smad3,Smad7 mRNA of ovarian of rats in each group(±s)
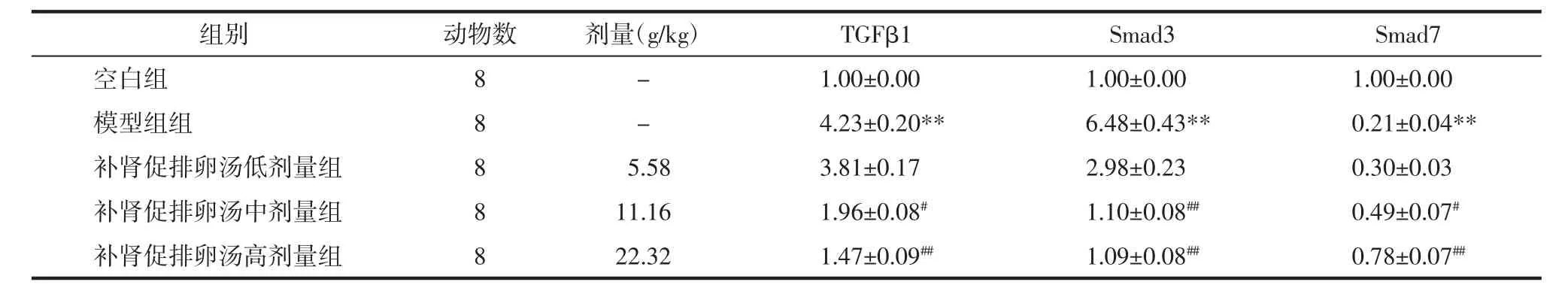
表4 补肾促排卵汤对各组大鼠卵巢组织TGF-β1,Smad3,Smad7 mRNA的影响(±s)Tab.4 Effect of Bushen Cupailuan Decoction on TGF-β1,Smad3,Smad7 mRNA of ovarian of rats in each group(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白组模型组组补肾促排卵汤低剂量组补肾促排卵汤中剂量组补肾促排卵汤高剂量组动物数8 8 8 8 8剂量(g/kg) TGFβ1 Smad3 Smad7-1.00±0.00 1.00±0.00 1.00±0.00-4.23±0.20** 6.48±0.43** 0.21±0.04**5.58 3.81±0.17 2.98±0.23 0.30±0.03 11.16 1.96±0.08# 1.10±0.08## 0.49±0.07#22.32 1.47±0.09## 1.09±0.08## 0.78±0.07##
2.5 补肾促排卵汤对各组大鼠卵巢组织TGF-β1、p-Smad3、Smad7蛋白表达的影响 与空白组相比,模型组大鼠卵巢中TGF-β1、p-Smad3的蛋白表达均显著升高,Smad7表达显著降低(P<0.01);与模型组相比,补肾促排卵汤中、高剂量组大鼠卵巢中TGF-β1、p-Smad3 蛋白表达显著下调,Smad7 蛋白表达显著上调,其中以补肾促排卵汤高剂量组变化程度最显著(P<0.01)。见图 5、表 5。
表5 补肾促排卵汤对各组大鼠卵巢组织TGF-β1、p-Smad3、Smad7蛋白表达的影响(±s)Tab.5 Effect of Bushen Cupailuan Decoction on expression of TGF-β1,p-Smad3,Smad7 of ovarian of rats in each group(±s)
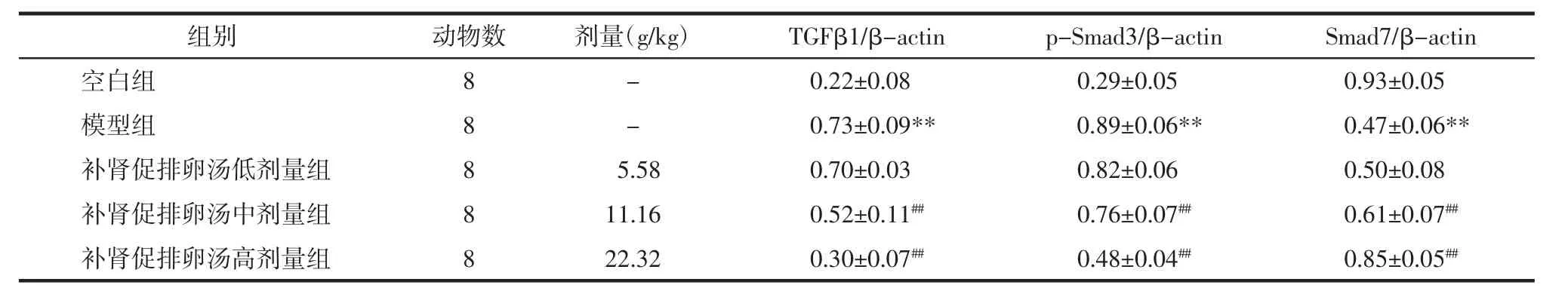
表5 补肾促排卵汤对各组大鼠卵巢组织TGF-β1、p-Smad3、Smad7蛋白表达的影响(±s)Tab.5 Effect of Bushen Cupailuan Decoction on expression of TGF-β1,p-Smad3,Smad7 of ovarian of rats in each group(±s)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01。
组别空白组模型组补肾促排卵汤低剂量组补肾促排卵汤中剂量组补肾促排卵汤高剂量组动物数8 8 8 8 8剂量(g/kg) TGFβ1/β-actin p-Smad3/β-actin Smad7/β-actin-0.22±0.08 0.29±0.05 0.93±0.05-0.73±0.09** 0.89±0.06** 0.47±0.06**5.58 0.70±0.03 0.82±0.06 0.50±0.08 11.16 0.52±0.11## 0.76±0.07## 0.61±0.07##22.32 0.30±0.07## 0.48±0.04## 0.85±0.05##
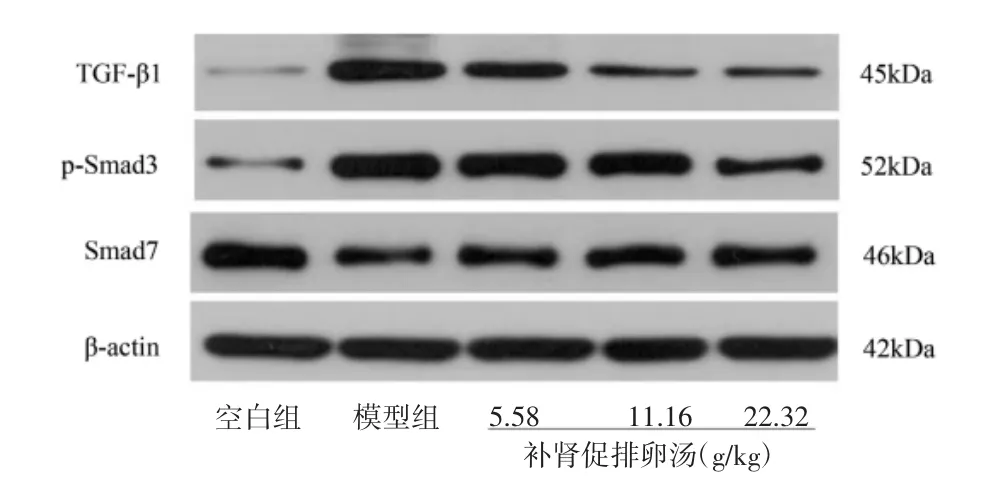
图5 大鼠卵巢组织TGF-β1、p-Smad3、Smad7蛋白表达电泳图Fig.5 Electrophoresis of TGF-β1,p-Smad3,Smad7 protein expressions in ovarian tissue of rats
3 讨论
中医根据PCOS的临床表现可将其归类于“闭经”“月经后期”“崩漏”“不孕”等疾病的范畴。其中,PCOS女性不孕可归类于“不孕”范畴。《圣济总录妇人无子》中指出:“妇人所以无子者……肾气虚弱故也。”《素问·上古天真论》中指出:“女子七岁,肾气盛……二七天癸至,任脉通……月事以时下,故有子……七七任脉虚,太冲脉衰少……故形坏而无子。”《医学衷中参西录》亦指出:“男女生育,皆赖肾气作强……肾气旺自能荫胎也。”肾乃是先天之本,可藏精主生殖;卵子为生殖之精,肾精充肾气盛,故肾主生殖的功能才能正常,卵子才能成熟从而顺利地排出,综上,肾虚是PCOS不孕的发病基础。同时不少医家认为PCOS肾虚还夹杂着瘀血,为本虚标实,肾虚日久,血液运行不畅则瘀血内阻[15-16]。国医大师夏桂成教授认为[17]PCOS之所以排卵障碍,大多是与肾虚有关,所以补肾为前提,结合活血通络,以祛瘀生新方法从而使成熟的卵子突破卵巢表层以促发排卵。
补肾促排卵汤为国医大师夏桂成教授治疗PCOS女性不孕症的临床经验方,药物组成:炒当归 10 g,怀山药 10 g,赤芍 10 g,白芍 10 g,牡丹皮10 g,茯苓10 g,熟地黄 10 g,川续断 10 g,红花5 g,菟丝子 10 g,五灵脂 10 g,鹿角片 10 g,山茱萸9 g。夏桂成教授认为,方以归芍地黄汤为基础,以滋补肾阴,肾阴充实,癸水高涨,才可能排卵,故肾阴癸水是排卵的基础;方中续断、菟丝子、鹿角片者,为温补肾阳也,温补肾阳,以阳中扶阴;当归、赤芍、五灵脂、红花活血化瘀,以祛瘀生新方法,使成熟的卵子突破卵巢表层以促发排卵[13,15]。现代研究表明,补肾活血类中药方可以改善卵巢纤维化。刘碧源等[18]使用护卵汤治疗慢性应激超排卵小鼠,结果发现模型组卵巢组织的 TGF-β1、FSHR、p-Smad3蛋白表达较正常组同期均显著降低(P<0.05);与模型组同期比较,中药组和西药组卵巢TGF-β1、FSHR、p-Smad3蛋白表达均明显升高(P<0.05)。柴海兰等[19]用归肾丸与针刺治疗PCOS排卵障碍性不孕症,结果发现归肾丸联合针刺能有效地提高PCOS不孕症患者的临床治疗效果,于治疗3个月后与停药4个月后,治疗组卵巢组织中结缔组织生长因子(CTGF)、TGF-β1的蛋白水平均低于对照组。随访1年时间内,治疗组妊娠率高于对照组。现代药理证实,该补肾促排卵汤中多种中药的活性成分具有不同的抑制TGF-β1/Smad的抗纤维化作用。丹皮,主要成分丹皮酚,对肝星状细胞活化α-SMA蛋白的表达产生明显抑制[20];红花,主要成分羟基红花黄色素A,能够抑制TGF-β1诱导NIH/3T3细胞与肺纤维化相关的信号转导,并可呈现明显的量效关系,作用靶点可能是TGF-βRII[21];赤芍,主要成分赤芍总苷,具有明显的抗肝纤维化作用,其机制可能与其阻断TGF-β1/Smad信号传导通路有关[22];茯苓,主要成分茯苓多糖,可以防治大鼠的肾间质纤维化[23];熟地黄均能缓解肾间质纤维化,其作用机制可能与下调TGF-β1、Collagen-Ⅰ及 α-SMA 的表达有关[24]。
在1982年,Hughesdon第一次证实了PCOS患者共有的卵巢纤维化特征,即卵巢皮质及皮质下基质增厚[25]。纤维化性疾病由于细胞外基质的过量生成、沉积和收缩导致过多疤痕形成[26]。TGF-β为转化生长因子-β超家族中非常重要的一员,包括三种亚型:TGF-β1、TGF-β2、TGF-β3,其中 TGF-β1 与纤维化的形成密切相关,诱导和激活多种纤维化疾病[27]。Smads蛋白是转化生长因子-β受体(TGF-βR)的直接作用底物,是生物信号从胞浆传递到细胞核内的关键效应分子,活化的Smads蛋白进入核内后共同激活或者抑制与它们相对应的目的基因的转录。TGF-β/Smads通路是TGF-β超家族传递信号的经典途径,已被证实在组织器官的纤维化中发挥重要作用[28]。TGF-β使受体磷酸化,然后激活Smad2/Smad3使其磷酸化,磷酸化的Smad2/Smad3(p-Smad2/p-Smad3)与Smad4形成低聚体复合体,这些低聚体复合物转位到细胞核并调节纤维化相关基因的表达[29],使有促纤维化生长因子分泌增多,使得细胞外基质(ECM)降解减少沉积增多,造成组织纤维化。该纤维化过程同时受负反馈机制的调节,Smad7能抑制TGF-β1/Smad信号通路的活性[30]。卵巢纤维化的原因可能是颗粒细胞的变性导致间质成纤维细胞增生、纤维蛋白原和胶原蛋白的沉积,TGF-β激活 Smad3和 Smad2,随后 TGF-β/Smads复合体可能促进CTGF、fibronectin和α-平滑肌肌动蛋白(α-SMA)在细胞核中的转录[12,31]。最新的研究表明,DHEA诱导的PCOS模型大鼠卵巢纤维蛋白和胶原蛋白水平显著提高,而主要纤维化指标TGF-β、p-Smad3等明显升高,TGF-βR抑制剂SB431542可以下调TGF-β、p-Smad3等纤维化相关因子的表达,卵巢过度纤维化可以通过TGF-βR抑制剂来改善,抑制促纤维化基因的转录[12]。
本研究结果显示,补肾促排卵汤可有效改善PCOS大鼠动情周期,降低血清T、LH水平,改善卵泡发育,减少囊状扩张的卵泡数量,减少卵巢纤维化形成,下调卵巢TGF-β1、p-Smad3蛋白及mRNA的表达,上调Smad7蛋白及mRNA的表达,有效治疗PCOS模型大鼠;补肾促排卵汤治疗PCOS模型大鼠可能的机制是通过调节纤维化TGF-β/Smads信号通路上重要分子 TGF-β1、p-Smad3、Smad7 的表达从而发挥作用。但PCOS卵巢纤维化的发病机制复杂,参与的信号通路众多,同时中药复方的作用常常又具有多靶点,因此,补肾促排卵汤改善PCOS模型大鼠卵巢纤维化的作用机制仍需进一步研究。