潮白河再生水生态补给河道区浅层地下水氮转化
2021-03-25夏绮文李炳华何江涛黄俊雄郭敏丽
夏绮文, 李炳华, 何江涛, 黄俊雄, 郭敏丽
1.中国地质大学(北京)水资源与环境学院, 水资源与环境工程北京市重点实验室, 北京 100083 2.北京市水科学技术研究院, 北京市非常规水资源开发利用与节水工程技术研究中心, 北京 100048
再生水回用是人类与自然兼容协调、创建良好水环境、保证水资源可持续利用、促进循环型社会进程的重要举措[1-3],河道利用是再生水利用的一种重要方式,但由于再生水与天然地下水水质存在差异,利用再生水生态补给河道区可能会带来环境风险[4-5]. 引温济潮调水工程是将温榆河的污水处理后经过暗涵管道输送至减河,再通过减河转运至潮白河. 引温济潮调水工程旨在改善河道水生态环境,并通过河流入渗补给地下水,围绕该项目已开展了多项研究. 熊燕娜[6]基于场地典型土壤介质,以3种单一介质和组合介质的土柱模拟了再生水淋溶下TN、NO3--N和NH4+-N的迁移转化特征,认为以透水性较大的砾石含砂为主的北段比以粉质黏土为主的南段更易受到污染. 刘玉梅[7]从河道-包气带-地下水系统出发,建立Hydras-1D包气带模型与Visual-MODFLOW饱和带模型,模拟不同含水层中NO3--N的污染范围与浓度,并划分出不同地段地下水的污染风险. 李杰[8]采集受水区双兴桥河道底泥研究不同水质条件下,底泥中氮组分的转化途径,认为在闭合系统与开放系统条件下,底泥中的氮转化存在差异. YANG等[9]研究发现,潮白河水域浮游植物光合作用和水体反硝化作用显著高于减河水域,使得ρ(TN)、ρ(NO3--N)沿流向上显著降低. LI等[10]研究了彩虹桥断面再生水长期入渗影响下地下水中氮组分的演化机制,利用衰减因子测定氮行为,认为NO3--N在高水力负荷条件下衰减率高达99.6%,当补给水中ρ(NH4+-N)的波动超过4 mgL时,会改变吸附平衡,导致土壤-地下水系统中NH4+-N的吸附解吸.
针对再生水入渗对地下水中氮组分的影响,以上学者基于室内试验与模拟进行了相关研究,但对于再生水长期河道入渗条件下,地下水中氮转化机制尚未清楚,并且由于受水区不同位置再生水水质与水文地质条件存在差异,不同位置地下水在再生水长期入渗影响下,氮组分的演化特征与演化机制需要进一步探讨,以期为再生水河道利用过程中氮的污染防控提供依据.
1 材料与方法
1.1 场地描述
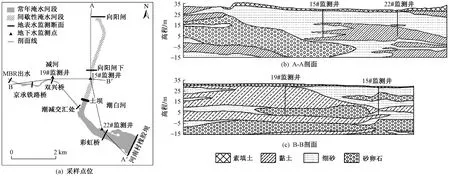
图1 采样位置与水文地质剖面图Fig.1 Sampling location and hydrogeological profile
研究区域为顺义潮白河支流减河与从向阳闸至河南村橡胶坝之间的潮白河段(见图1). 土坝切断了向阳闸与潮白河下游的水力联系,水流方向为自减河至潮白河下游. 补水前研究区河段长期干涸,北京市水务局为了恢复潮白河生态用水,并补充地下水,于2006年实施调水工程. 该项目将温榆河城市污水经氧化池与MBR (膜生物反应器)处理后利用地下管道引入人工修筑的减河,最终以0.015 ms的平均流速进入潮白河补水场地[11]. 2007年10月,该项目完成,改善了潮白河水生态环境,并补充了地下水. 减河为人工型河道,两侧砌边坡,自然河底,在潮白河向阳闸下游约4 km处与潮白河交汇. 潮白河受水区段为向阳闸至河南村橡胶坝,长度约为7.3 km,其中土坝以南为常年补水区,土坝以北在补水初期进行间歇性补水. 经过多年补水,减河水深0.64~1.70 m,平均1.11 m;土坝以北潮白河水深2.10 m,土坝以南潮白河水深2.30~2.60 m,平均2.45 m;由于河南村橡胶坝的拦截,潮白河下游河水流速仅1.49×10-3ms,减河和潮白河的基本参数见表1. MBR出水主要指标的浓度如图2所示,补水以来,TN、TP、NH4+-N、BOD5浓度时常超过GB 3838—2002《地表水环境质量标准》Ⅲ类标准限值,随MBR处理工艺的改进,出水中ρ(TP)、ρ(TN)、ρ(NH4+-N)、ρ(COD)、ρ(HCO3-)等呈波动降低趋势,仅ρ(SO42-)逐渐升高,但再生水入渗仍可能引起地下水的污染风险.
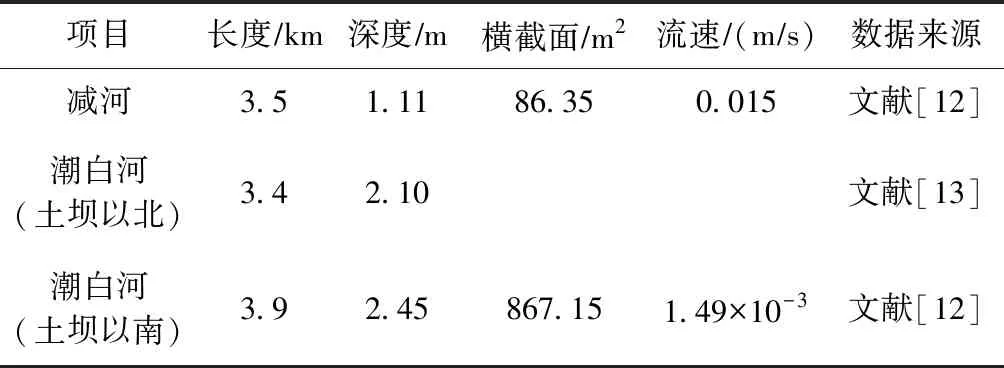
表1 减河与潮白河的基本参数
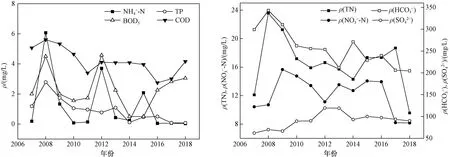
图2 污水处理厂MBR出水的主要成分Fig.2 Main constituents of the MBR effluent detected in the wastewater treatment plant
研究区位于潮白河冲洪积扇中部,岩性颗粒较粗. 该研究以30 m左右的浅层含水层为研究对象. 研究区不同位置水文地质条件具有差异. 由向阳闸至河南村橡胶坝南北向地质剖面图可以看出,自向阳闸至河南村橡胶坝,浅层含水层岩性由砾石含砂渐变至黏土和粉细砂. 东西向的水文地质剖面图表明,自减河至潮白河,浅层含水层由黏土渐变至含砂砾石(见图1). 根据研究区多年降雨数据,1985—2018年均降雨量为578.5 mm,蒸发强烈,不同年份蒸发量差别不大,近年来研究区水面蒸发量年均值为 1 107.5 mm. 场地调查显示研究区周边河道大多干涸,且没有农田等大规模灌溉场地,因此认为该研究中周边环境和土地利用类型对当地地下水的影响较小.
1.2 监测数据
自2007年9月开始对研究区地表水与地下水进行监测,至今已达11年,在河道周边分别设置8个地表水监测断面与3个30 m左右的浅层地下水监测井(见图1). 监测频率每年不少于两次,以确保可以研究长期入渗条件下地下水水质的演变. 监测指标包括pH、ρ(TDS)、总硬度、ρ(HCO3-)、ρ(CO32-)、ρ(SO42-)、ρ(Cl-)、ρ(NO3--N)、ρ(NO2--N)、ρ(NH4+-N)、ρ(TN)、ρ(TP)、ρ(COD)、ρ(BOD5)、ρ(DO)、ρ(TOC) (TOC为总有机碳)、ρ(Chla)及细胞总数等〔地下水监测指标中无BOD5指标,且ρ(DO)、ρ(TOC)、ρ(Chla)、细胞总数仅包含2016—2018年数据〕. 所有测试均由北京市理化分析测试中心进行.
1.3 数据处理
采用R型聚类分析对地表水进行分区,数据在进行多元统计分析之前,进行平均值为0、方差为1的标准化转换. 该研究所有的计算均在IBM SPSS Statistics 24.0统计分析软件中完成. 选用Ward (离差平方和)算法与欧式距离[14],根据欧式距离的大小,按照采样点地理位置的相似性和差异性,将地表水断面进行分区.
2 结果与讨论
2.1 地表水水质特征及分区
YANG等[9]于2012—2013年对减河和土坝以南潮白河段的地表水进行了监测,发现再生水从减河流入潮白河过程中水质存在明显变化,主要的变化特征:pH沿水流向上显著升高;ρ(TN)、ρ(TDS)在减河与潮白河交汇后显著降低. 由于其研究未包括土坝至向阳闸之间的潮白河段,为证实补水期间再生水在河道中的变化是否均具有以上特征,利用各断面地表水不同时段的典型指标pH、ρ(TN)、ρ(TDS)绘制箱型图进行对比分析,发现与YANG等[9]研究结果相同,不同时段减河的pH均低于潮白河,而ρ(TN)和ρ(TDS)高于潮白河.
由于不同断面地表水的水化学具有显著差异,需对地表水监测断面进行聚类,分析地表水水质的空间变化特征. 考虑指标的代表性与连续性,选取2007—2018年地表水18项指标(见1.2节)的中位数进行统计分析,数据处理方法见1.3节. 空间尺度的聚类分析可分为3组(见图3),A组为减河,包括减河河段的MBR出水、京承铁路桥、双兴桥、潮减交汇处4个断面;B组为潮白河,其中B1组为土坝以南潮白河段,包括土坝以南的彩虹桥、河南村橡胶坝2个断面;B2组为土坝以北潮白河段,包括土坝以北的向阳闸下、向阳闸2个断面.
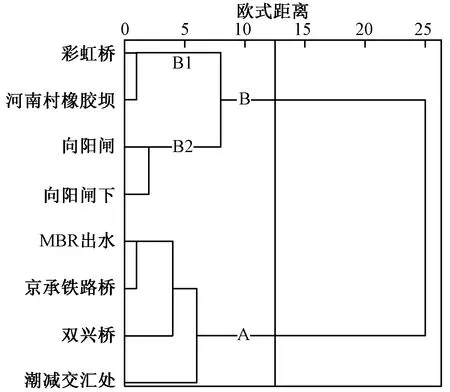
注:A组为减河,包括减河河段的MBR出水、京承铁路桥、双兴桥、潮减交汇处4个断面;B组为潮白河,其中B1组为土坝以南潮白河段,包括土坝以南的彩虹桥、河南村橡胶坝2个断面;B2组为土坝以北潮白河段,包括土坝以北的向阳闸下、向阳闸2个断面. 下同.图3 地表水监测断面聚类分析Fig.3 Cluster analysis of surface water monitoring section
聚类分析结果显示,各组间指标的浓度存在显著差异. 故利用箱型图分析各组间不同指标的浓度变化特征(见图4). 减河与潮白河各指标的浓度差异较大,而土坝以南潮白河段与土坝以北潮白河段各指标的浓度差异较小. 减河为人工型河道,流速快,河道窄,是再生水回用于河道的初始阶段;土坝以南潮白河段水量大,河道宽,常年有水;土坝以北潮白河段水量小,河道宽,间歇性受水. 受土坝的阻隔,土坝以北潮白河段与减河、土坝以南潮白河段无水力联系. 对于减河与土坝以南潮白河段的地表水水质差异,反映再生水由减河进入土坝以南潮白河段会经过一系列水化学与生物化学作用,水质沿程发生变化. HE等[11]研究认为富含氮、磷的再生水回用于河道后,受水区水体均处于富营养化状态. 减河河段水体流速较快,浮游植物生长数量较少,富营养化程度低,因此水体的光合作用与反硝化作用较弱,pH的升幅与其他水质指标浓度的变幅均较小. 再生水进入土坝以南潮白河段后,水体流速变缓,浮游植物在该河段大量繁殖,有利于形成厌氧微环境,反硝化作用增强使水体氮浓度明显下降,水体pH大幅升高,并使其他水质指标ρ(HCO3-)、ρ(Ca2+)、ρ(Mg2+)及ρ(TDS)大幅降低. 浮游植物大量繁殖也使得水体ρ(Chla)急剧升高,同时大量消耗水中的磷. HE等[11]研究了基本符合11年的水质监测数据,而对无水力联系的土坝以北潮白河段未进行研究. 土坝以北潮白河段的各指标浓度接近土坝以南潮白河段,但部分指标与土坝以南潮白河段具有差异,根据其ρ(Chla)、ρ(COD)、ρ(BOD5)均低于土坝以南潮白河段,认为该河段浮游植物生长数量较少,因此水体的光合作用与反硝化作用相对较弱,使得水体pH的升幅与ρ(TDS)、总硬度的降幅均较小.

图4 地表水主要指标分区对比Fig.4 Comparison of main indexes of surface water
2.2 氮组分迁移特征
地表水与地下水之间的ρ(TN)变化可反映入渗过程中营养物质的总体变化. TN是一个综合性指标,为识别地下水的总体质量变化,需进一步分析ρ(NO3--N)、ρ(NO2--N)和ρ(NH4+-N). 由于MBR处理后ρ(DON) (DON为溶解性有机氮)很低,该研究未对ρ(DON)进行监测. 监测数据显示地表水与地下水中ρ(NO2--N)较低,分别为0.160、0.008 mgL,由于再生水入渗未导致地下水中ρ(NO2--N)升高,该文主要分析ρ(TN)、ρ(NO3--N)和ρ(NH4+-N)的变化.
聚类分析将地表水水质分为三组,选择双兴桥、向阳闸下、彩虹桥断面分别代表减河、土坝以北潮白河段、土坝以南潮白河段,对应的地下水监测井分别为19#、15#、22#. 不同断面地表水的氮组分随时间发生变化(见图5),2007—2018年,双兴桥地表水氮组分波动降低,向阳闸下与彩虹桥地表水氮组分较为稳定,但双兴桥的氮组分明显高于其余2个断面. 在地表水入渗的影响下,19#、15#监测井的氮组分未发生明显变化,仅引起22#监测井ρ(TN)与ρ(NH4+-N)明显升高. 为研究地表水入渗过程中的氮转化及与地下水发生的混合作用对地下水氮组分的影响,假设在入渗过程中仅发生地表水与地下水的物理混合,对比ρ(TN)、ρ(NO3--N)和ρ(NH4+-N)的实测值与计算值.

图5 地表水与地下水中氮组分浓度的变化特征Fig.5 Variation characteristics of nitrogen components concentration in surface water and groundwater
计算浓度按照式(1)得出,Cl-性质稳定,通常在入渗过程中不受吸附和其他化学或生物过程的影响. 因此,采用Cl-作为保守示踪剂,计算地下水中补给水的分数(Mr). 假设只发生了物理混合,即可计算出地下水中目标成分的计算浓度[10,15].
Ccal=Mr×CRW+(1-Mr)×CGW
(1)
(2)
式中:Ccal为地下水中目标组分的计算浓度,mgL; Mr为地下水中补给水的分数,无量纲;Cmix为地下水与补给水混合后的Cl-浓度,mgL;Cb为地下水中Cl-的背景浓度,mgL;Ci为补给水中Cl-的输入浓度,mgL;CRW和CGW分别为补给水和地下水中目标组分的检测浓度,mgL.
氮组分浓度的实测值与计算结果见图6,地表水入渗过程中若未发生氮转化,则地下水中ρ(TN)、ρ(NO3--N)、ρ(NH4+-N)的计算值应接近实测值. 但19#监测井的ρ(TN)、ρ(NO3--N)、ρ(NH4+-N)的计算值明显高于实测值,表明地表水的ρ(TN)、ρ(NO3--N)、ρ(NH4+-N)在入渗过程中明显衰减;15#监测井的ρ(TN)与ρ(NO3--N)的计算值高于实测值,ρ(NH4+-N)的计算值接近实测值,表明地表水入渗过程中,主要为ρ(TN)与ρ(NO3--N)的衰减;22#监测井的ρ(NO3--N)实测值始终低于计算值,但ρ(NH4+-N)在监测后期实测值高于计算值,表明地表水入渗过程中不仅发生ρ(NO3--N)衰减,后期也生成了部分NH4+-N.

图6 地下水氮组分浓度计算值与实测值Fig.6 Calculated and measured values of nitrogen components concentration in groundwater
地表水中ρ(NO3--N)在入渗过程中降低,可能发生了反硝化与同化作用,而地表水入渗过程中也可发生有机氮矿化作用使ρ(NH4+-N)升高. 通过氮组分浓度的计算值与实测值的差值(ΔX),可推算入渗过程发生氮转化的量. 利用式(1)对地下水氮组分浓度的计算值与实测值进行计算.
ΔX=Xcal-Xmea
(2)
式中:Xcal为氮组分浓度的计算值,mgL;Xmea为氮组分浓度的实测值,mgL.
计算得到地表水中ρ(TN)在入渗过程中明显衰减,19#监测井地表水中ρ(TN)平均降低了13.5 mgL,ρ(NO3--N)平均降低了10.4 mgL,ρ(NH4+-N)平均降低了1.2 mgL,入渗过程中以NO3--N和NH4+-N形式降低的氮组分占ρ(TN)降低的85.93%. 15#监测井地表水中ρ(TN)平均降低了4.43 mgL,ρ(NO3--N)平均降低了2.87 mgL,ρ(NH4+-N)平均降低了0.07 mgL,入渗过程中以NO3--N和NH4+-N形式降低的氮组分占ρ(TN)降低的66.37%. 对于22#监测井,2007—2013年地表水中ρ(TN)平均降低了4.34 mgL,ρ(NO3--N)平均降低了1.78 mgL,ρ(NH4+-N)平均降低了0.42 mgL,入渗过程中以NO3--N和NH4+-N形式降低的氮组分占ρ(TN)降低的50.69%;2013—2018年,其地表水中ρ(TN)平均降低了3 mgL,ρ(NO3--N)平均降低了2.87 mgL,ρ(NH4+-N)平均升高了1.71 mgL.
2.3 氮组分演化机理
在地表水入渗过程中,氮组分通过包气带时会经历吸附、挥发、生物利用、硝化、反硝化等复杂的生物化学反应,其浓度与形态可能发生改变[16-18]. 地表水中ρ(NH4+-N)较低,故主要探讨入渗过程中ρ(NO3--N)衰减与ρ(NH4+-N)增加.
2.3.1反硝化作用与同化作用
土壤中的黏土颗粒带负电,基本不吸附水中NO3--N,因此其对水中NO3--N几乎无阻滞作用[19]. 闫雅妮等[20]以粉砂土作为介质,研究NO3--N的衰减机制,发现ρ(DO)小于4 mgL时,通过反硝化作用与同化作用可使NO3--N衰减率在90%以上. 该研究区内NO3--N的衰减率为80.00%~99.75%,表明地表水入渗过程中可能发生反硝化作用和同化作用去除NO3--N. HE等[11]研究发现,该地区地表水发生了反硝化作用,且地表水入渗过程中连续水流穿过氧化-还原界面有助于形成反硝化热点[21]. 监测数据显示,地表水中ρ(DO)明显高于地下水(见图7),利于发生反硝化作用. 同时反硝化作用会消耗水中的ρ(TOC)[22],地表水中ρ(TOC)在3.60~13.80 mgL之间,由于藻类和浮游植物的代谢和死亡,沿水流向上ρ(TOC)逐渐升高[12];而地下水中平均ρ(TOC)为3.09 mgL. 故ρ(TOC)的差异可能为地表水入渗时发生反硝化的迹象. 其中19#监测井地下水中ρ(TOC)较低,表明地表水入渗过程中较多的NO3--N通过反硝化作用去除;15#、22#监测井地表水中NO3--N入渗到地下水中几乎完全衰减,但由于地表水中平均ρ(NO3--N)较低,分别为3.02、2.36 mgL,入渗过程中虽发生反硝化作用,但反硝化消耗的TOC相对较少.
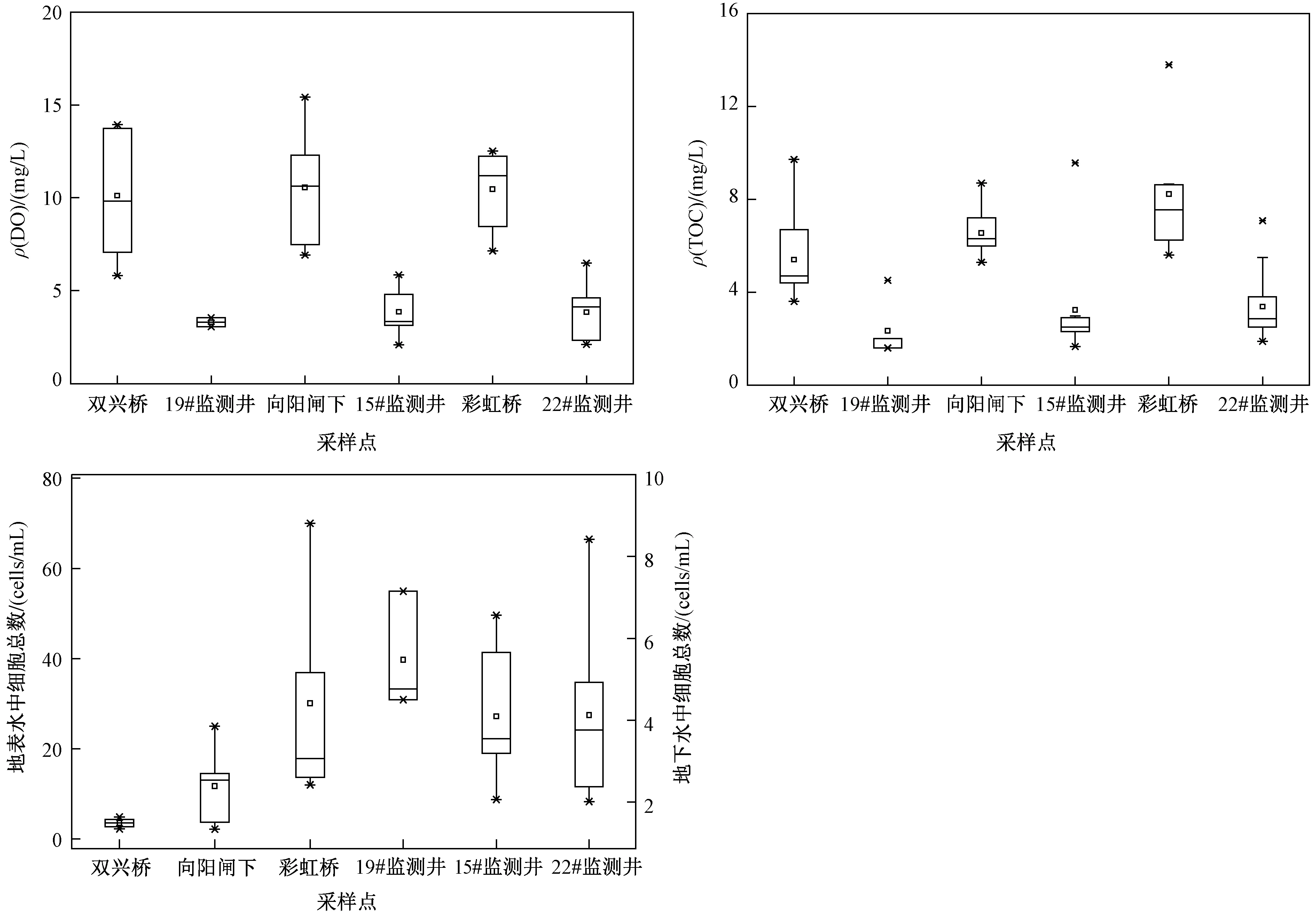
注: 双兴桥、向阳闸下、彩虹桥为地表水采样点,19#、15#、22#监测井为地下水采样点.图7 地表水与地下水中主要组分的浓度Fig.7 Concentration of main components of surface water and groundwater
此外,微生物会利用NO3--N合成有机氮而发生NO3--N同化作用,其反应式[20,23]如下:0.142 9NO3--N+C+0.285 7H2O→0.142 9C5H7NO2+0.142 9OH-+0.285 8CO2. 细菌在生长和繁殖过程中会将无机氮转化为自身所需的有机氮[24]. 在水-土界面上,碳源最充足,细菌大量繁殖,大量的NO3--N被细菌利用并合成有机氮. 相对其余采样点,双兴桥地表水中ρ(NO3--N)较高(10.86 mgL),监测期间地下水中ρ(NO3--N)始终低于0.1 mgL,在入渗过程中NO3--N几乎完全衰减. 同时,19#监测井中的细胞总数为5.36 cellsmL,明显高于地表水(3.07 cellsmL),表明该采样点地表水入渗过程中发生同化作用而有利于细菌的繁殖,使得19#监测井中的细胞总数高于15#和22#监测井.
2.3.2有机氮矿化作用
在有氧或无氧条件下,不同的微生物均能分解各类含氮有机物,有机氮矿化过程中会产生有机酸,使得ρ(TOC)增加[25-26]. 通过分析地下水中ρ(TOC)与ρ(NH4+-N)的关系,可以清楚地观察到两种趋势(见图8):ρ(NH4+-N)随ρ(TOC)的增加而增加(趋势1);ρ(NH4+-N)几乎不随ρ(TOC)变化(趋势2). 22#监测井呈趋势1,表明地表水入渗过程中可能产生有机氮矿化作用,增加了地下水中ρ(NH4+-N)和ρ(TOC). 其余监测井遵循趋势2,推测地表水入渗过程中,19#、15#监测井未发生矿化或仅少量矿化.

图8 ρ(NH4+-N)与ρ(TOC)之间的关系Fig.8 The relationship between ρ(NH4+-N) and ρ(TOC)
通过数据处理可以得出,19#和15#监测井地表水入渗过程中,ρ(TN)的衰减主要为ρ(NO3--N)和ρ(NH4+-N)的降低(见图6),二者占比为66.37%~85.93%,其余的DON吸附于土壤介质中;22#监测井地表水入渗前期,ρ(NO3--N)和ρ(NH4+-N)的降低仅占ρ(TN)衰减的50.69%,有较多DON在入渗过程中被吸附,并且数据显示自2007年再生水入渗以来,由于浮游植物净光合作用速率远大于底泥分解速率,在该河段存在较大量的底泥有机质积累,并使河段底泥中w(TN)明显高于背景值(见图9). 底泥中含有丰富的有机氮,在矿化作用下易导致地下水中ρ(NH4+-N)升高[27]. 另外,在底泥中,有效碳氮比在有机氮矿化过程中起着重要作用,高碳氮比会抑制有机氮的矿化[28-29]. 随着地表水的入渗,使得该河段底泥的碳氮比为9.77(<15),有利于2013年后地表水入渗过程中产生有机氮矿化作用[30]. 而双兴桥底泥分解速率与浮游植物净光合作用速率相近,该河段基本没有底泥的积累,不利于氮的积累;向阳闸下底泥中w(TN)较低,低于检出限(20 mgkg). 2个河段的碳氮比均远高于15,不利于产生有机氮矿化作用,故其未发生矿化或仅少量矿化.
2.3.3水文地质条件对氮转化的影响
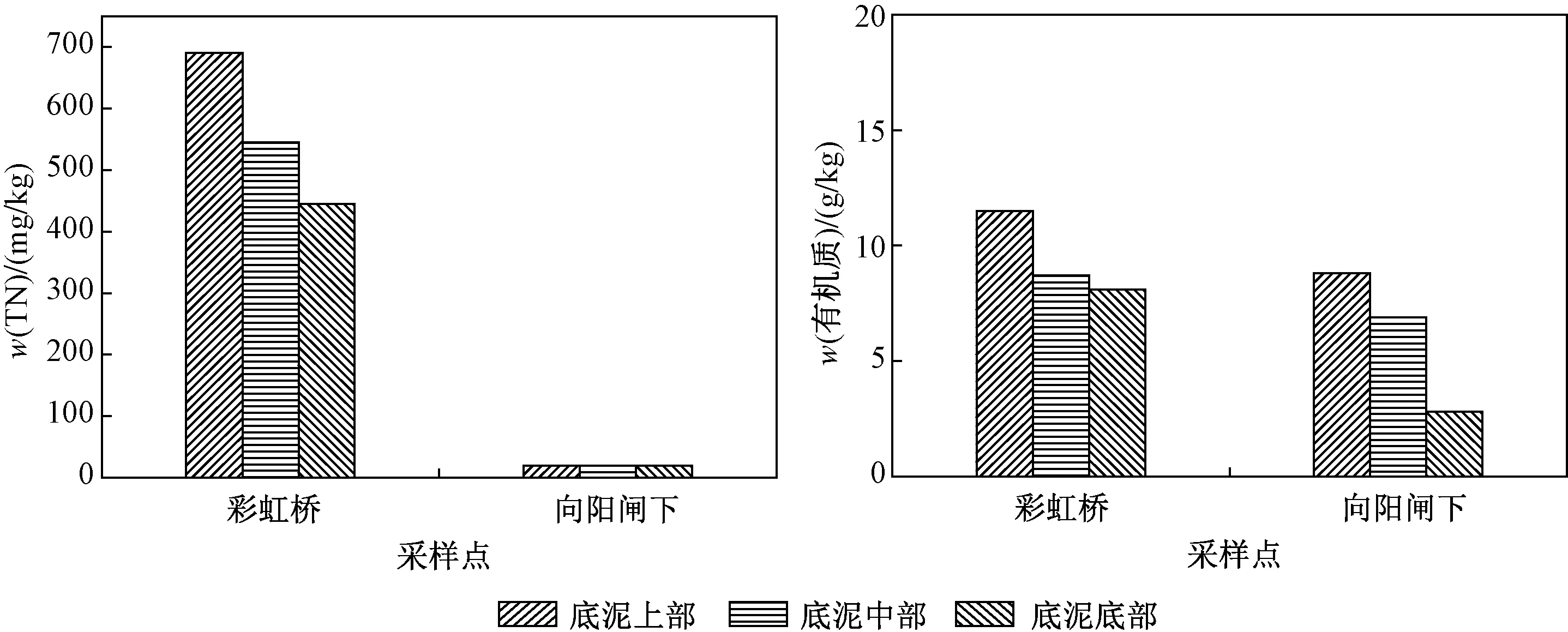
图9 河道底泥成分Fig.9 Composition of river sediments

图10 氮转化机理Fig.10 Mechanisms of nitrogen transformation
水文地质条件会对地表水入渗时的氮转化产生重要影响. 河道补水后翌年各监测井的地下水位抬升并趋于稳定,22#和15#监测井地下水位抬升幅度较大(见图10). 双兴桥地表水中ρ(NO3--N)与ρ(NH4+-N)虽均较高,但19#监测井浅层地下水埋深较大,补水前地下水埋深为9.5 m,补水后地下水埋深为8.8 m,包括1.3 m的素填土与7.5 m的黏土,有利于氮的去除. 浅层地下水相对处于还原环境,地表水入渗过程中连续水流经过氧化-还原界面利于形成反硝化作用,部分NO3--N被微生物利用合成有机氮. NH4+-N在入渗过程中被包气带中的黏土矿物和有机物吸附去除[31-33]. 向阳闸下地表水中氮浓度较低,15#监测井补水前地下水埋深为8.27 m,补水后地下水埋深为6.28 m,包气带包括0.5 m的素填土与5.78 m的细砂,地表水入渗过程中发生的氮转化与19#监测井类似. 2个断面地表水的氮组分入渗过程中基本衰减,未引起地下水中氮浓度明显升高. 2.#监测井的氮转化不同于上述2个断面,该断面地表水中氮浓度虽较低,但入渗后导致地下水中的ρ(NH4+-N)增加,并明显高于地表水. 这主要由于该河段发生有机氮矿化作用,且22#监测井地下水埋深较浅,补水前地下水埋深为5.48 m,补水后地下水埋深仅为2.2 m,包气带包括1 m的素填土与1.2 m的粉细砂,包气带较薄,通过有机氮矿化作用生成的NH4+-N入渗过程中仅少量吸附于介质中,易随水流入渗而引起地下水中ρ(NH4+-N)升高. 19#和15#监测井的环境条件不利于发生有机氮矿化作用,其未发生矿化或仅少量矿化,且包气带较厚,生成的NH4+-N在入渗过程中易吸附于土壤中,未引起地下水中ρ(NH4+-N)明显升高.
3 结论
a) 再生水由减河进入潮白河后会经过一系列水化学与生物化学作用,沿程水质会发生变化. 聚类分析将地表水分为减河、土坝以北潮白河段和土坝以南潮白河段,各组间指标存在显著差异,影响水质差异的主要因素为再生水的氮、磷含量及水体流态.
b) 水文地质条件是影响再生水入渗条件下地下水中氮浓度变化的主要因素,包气带或黏土层较厚可以有效地去除氮组分. 再生水入渗过程中,减河和土坝以北的潮白河段地表水中的NO3--N经过包气带时通过反硝化与同化作用衰减,NH4+-N通过硝化与吸附作用得以去除,因此再生水入渗后未引起地下水中氮浓度明显增加.
c) 土坝以南的潮白河段,河道补水后翌年地下水位抬升并趋于稳定,长期地表水入渗使底泥的氮和有机质含量升高,使该断面于2013年后达到适宜的碳氮比而发生有机氮矿化作用,由于包气带较薄,生成的NH4+-N较少吸附于土壤介质中,易随水流进入地下水,引起地下水中ρ(NH4+-N)升高.
