siRNA 抑制人卵巢癌SKOV-3细胞MDM2的表达及细胞增殖的研究
2021-03-25贾志勇赵燕颖
王 莹,贾志勇,赵燕颖
(1.内蒙古弘慈医疗集团包钢三医院 妇产科,内蒙古 包头014010;2.内蒙古科技大学包头医学院第一附属医院 普外二科;3.吉林大学第四医院)
卵巢癌(OC)是女性生殖系统常见3大恶性肿瘤之一,患者病死率居妇科恶性肿瘤首位,严重威胁女性的健康与生命,卵巢癌恶性程度高,侵袭性强,术后复发率高,病人预后不良。鼠双微粒体-2基因(MDM2)是近年发现的一种癌基因,MDM2作为一个癌基因,主要是抑制野生型p53的激活转录功能和抗肿瘤活性。经研究证实,MDM2因子过度表达可使同期表达的p53下调,进而引发肿瘤[1]。相关研究结果显示,在肺癌、骨肉瘤、胶质瘤以及膀胱癌等疾病中,均可发现MDM2过度表达现象[2]。本研究完成了MDM2因子特异性siRNA的体外合成,对后者抑制MDM2的作用展开分析,并探究其抑制人卵巢癌SKOV-3细胞的生长增殖功能,为OC的基因治疗开启了一个新方向。
1 材料与方法
1.1 材料
胎牛血清(四季青生物制品公司);LipofectamineTM2000转染试剂盒(购自Invitrogen);IMDM培养基(购自Gibco);MTT(Sigma公司);SilencerTMsiRNA (Ambion公司);引物由上海生工生物技术公司合成;人卵巢癌细胞株 SKOV-3 (中国科学院上海生物化学与细胞生物学细胞所)。
1.2 siRNA 的设计和合成
参照已知Genebank所示MDM2 mRNA序列以及siRNA 的设计要求[3],借助Ambion公司的在线设计,对靶序列加以确定,同时开展同源序列搜索,以将同EST或其他编码序列同源的那些序列排除掉。通过silencerTMsiRNA construction kit完成si-MDM2-1、si-MDM2-2的体外合成,阴性对照control siRNA为Ambion公司产品,同其他所有的编码序列均不存在同源性。同时合成荧光 GFP 标记的 si-MDM2-1,si-MDM2-2及 Ctrl-siRNA。
1.3 siRNAMDM2的构建与转染细胞培养及转染
人卵巢癌细胞株SKOV-3由中国科学院上海生物化学与细胞生物学研究所提供。在含 10%小牛血清的 IMDM 培养液中培养,于 5%CO2和 37℃条件下培养。取已达对数生长期的 SKOV3细胞,先对其实施胰酶(0.25 %)消化处理,再进行单细胞悬液的制备,借助细胞记数板对细胞量进行统计。将细胞按照每孔1×104细胞密度接种到 96孔板中,培养瓶接种 1×106,待细胞密度达到80%左右后,更换无血清的培养基,在无抗生素的培养基中培养24 h后,SKOV-3细胞采用脂质体 Lipo-fectamineTM2000 进行转染。于转染前1 d,挑取呈良好长势的SKOV-3细胞接种至6孔板内,接种密度为1×106/孔。实验安排:对照组、未转染组、转染组、随机乱码组、siRNAMDM2 组,根据转染试剂说明书所示实施转染。
1.4 Real-time PCR检测mRNA表达
收集转染2 d后各组细胞,分别提取总RNA,紫外分光光度计定量。引物序列如下:上游:5′-ACCTTCCAAGTGCTGGTGCT-3′,下 游: 5′-TGTCTACCATGTAGCCAGCTTTCA- 3′;β-actin,上游:5′-CCTGGCACCCAGCACAAT-3′ 下游:5′-GGGCCGGACTCGTGATAC-3′。RNA样品经逆转录反应合成cDNA,在ABI7300b荧光定量PCR仪上进行检测。反应条件为:95℃ 30 s,95℃ 5 s,60℃ 30 s,40个循环,用2-ΔΔCt法[5]计算基因相对表达水平。实验重复3次。
1.5 MTT检测细胞增殖抑制率
取已达对数生长期的SKOV3细胞接种至96孔板内,接种密度为5×103/孔,待见贴壁细胞,进行si-MDM2-1、si-MDM2-2以及controlsiRNA的转染操作,调节转染质粒组的终浓度为50 nmol/L,待完成1 d、2 d、3 d转染处理,将5 mg/ml的MTT添加至各孔,各孔添加量均为15 μl,均接受4 h培养,之后向各孔内逐一添加DMSO,添加量均为0.15 ml,行10 min振荡处理,借助酶标仪对570 nm下吸光度值(即A值)进行检测。通过下述公式:细胞增殖抑制率(%)=[(1-处理组吸光度A值)/未处理组吸光度A值]×100,计算出抑制率。各组都安排4个平行孔,均进行3次重复操作。
1.6 流式细胞术检测凋亡
取已达对数生长期的细胞接种至培养瓶内,接种密度为7.5×105/瓶,分别完成2组siRNAMDM2以及controlsiRNA的转染操作。经3 d培养使收集细胞消化充分,由低温PBS进行两次洗涤,完成单细胞悬液的配制,由低温乙醇(70%)固定过夜,再实施碘化丙啶染色处理,最后借助流式细胞仪对凋亡率进行测定。
1.7 Western blot检测蛋白表达
待完成细胞转染操作,再行3 d培养,培养结束,由PBS进行洗涤,再加入已预冷的裂解液行裂解处理,将以上各组细胞收集起来,用 100 μl 细胞裂解液(10 mM Tris-Cl,pH8.0,1 mM EDTA,2%SDS,7.5 mM DTT,10 mM PMSF)裂解,Bafford 法测定蛋白质浓度,在 10%的 SDS-PAGE 凝胶上按每孔 50 μg 进行上样,110 V 电压下电泳,Bio-Rad 半干转膜仪转膜后,依次经过 5%脱脂牛奶封闭过夜后,由TBTS进行洗涤,于37℃下通过已行1∶200 稀释处理的兔抗人MDM2以及β-actin单克隆抗体行120 min振荡处理,再由TBST洗涤,接着于37℃下通过已行1∶1 000稀释处理的山羊抗兔二抗实施60 min反应,再由TBST洗涤,最后DAB显色 。同时选择 β-actin 做内参,所有结果扫描后,用图像分析系统测定各条带灰度值,来反映蛋白的表达变化。
1.8 统计学方法
2 结果
2.1 siRNAMDM2转染 SKOV-3 细胞效率的结果观察
逐一用50 nmol/L、80 nmol/L与100 nmol/L浓度进行SKOV-3细胞转染操作,待转染完成,借助荧光倒置显微镜,发现细胞中见绿色荧光,可判定转染有效(图1)。经过1 d,于100×镜下经随机方式确定出5个视野,对视野内总细胞、荧光细胞的数量进行分别统计,对转染效率进行求解。此次试验实现了80%的转染效率,结果表明,浓度为80 nmol/L时可获得最大的转染效率,故而,此次实验确定siRNA的转染浓度为80 nmol/L。

A:未转染 siRNAMDM2时SKOV-3细胞图 B:有效转染 si-MDM2-1 后 SKOV-3 细胞图 C:有效转染 si-MDM2-2后 SKOV-3 细胞图
2.2 siRNA转染后对SKOV-3细胞 MDM2基因表达的影响
为检测siRNA对SKOV-3细胞中MDM2基因mRNA表达的影响,收集各组获得的细胞株以及未转染对照细胞,采用荧光定量PCR检测各组细胞中MDM2基因mRNA表达水平变化,结果如图2所示,在MDM2-mRNA 表达量方面,相比对照组,转染 si-MDM2-1下调到48.41%,si-MDM2-2则下调到46.51%,表达水平均显著下调(P<0.05),与对照组相比,差异具有统计学意义。说明siRNA MDM2靶向序列具有较高的沉默效率,基因干扰实验mRNA水平验证符合预期。

图2 siRNA对卵巢癌SKOV-3细胞MDM2mRNA表达的影响
2.3 MTT 法检测细胞增殖抑制
经MTT 法测定发现,结果如图3所示,转染 si-MDM2后,不管是细胞的分裂指数,还是其增殖速度,均受到了大幅抑制;比空白对照组和阴性对照组减低(P<0.05);随着转染时间的延长细胞生长的抑制率逐渐增高。在增殖抑制率方面,相较空白对照组,si-MDM2-1组和 si-MDM2-2 组均表现出显著不同(P<0.05);同时,在1 d、2 d、3 d这3个时间节点上,细胞增殖抑制率与阴性对照组和空白对照组比较,差异有统计学意义(P<0.05),以上实验说明,MDM2 具有促进细胞增殖的能力。

图3 si-MDM2对细胞增殖的影响
2.4 si-MDM2转染后对SKOV-3细胞凋亡的影响
待si-MDM2-1、2转染完成后的3 d,经测定发现,细胞凋亡率依次是47.8%,38.2%,细胞凋亡率明显升高,差异有统计学意义。流式细胞仪检测细胞周期结果显示si-MDM2-1组和si-MDM2-2组细胞处在S期的占比依次是28.8%、30.1%,相较于对照组55.3%的占比明显较低;在细胞处在G0/G1期的占比而言,相较于对照组,上述两组则偏高,差异有统计学意义。
2.5 siRNAMDM2转染后对SKOV-3细胞 MDM2蛋白表达的影响
Western blot结果显示SKOV-3细胞转染后各组β-actin蛋白表达量基本相同,阴性对照组和空白组的各目的蛋白表达量相似,si-MDM2-1和si-MDM2-2组的各目的蛋白表达量相似,差异均无统计学意义(P>0.05)。和对照组比较,转染2组siRNAMDM2的MDM2蛋白表达水平明显降低,和空白组比较转染2组si-MDM2的MDM2/β-actin平均下调51.30%,结果如图4所示。
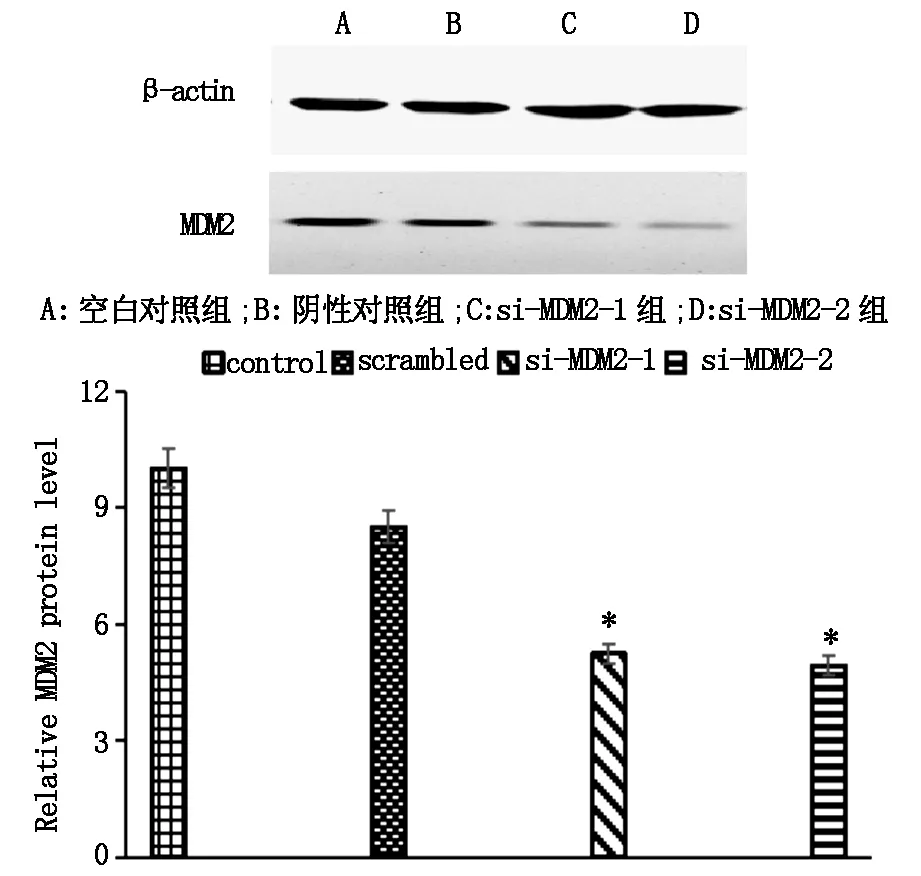
图4 转染后各组中SKOV-3 中MDM2mRNA蛋白的表达的变化
3 讨论
卵巢癌是临床上妇科肿瘤中最常见的一种。卵巢癌起病隐匿,目前尚缺乏有效的早期诊疗手段。近几年,已认识到诸多促癌因子与抑癌因子异常表达可引发OC以及促进其发展[4]。基因治疗已成为卵巢癌治疗的新途径。尤其是MDM2基因的扩增或过表达与 p53 抑癌基因的失活在促进卵巢癌的发生、发展中起着举足轻重的作用。
抑癌基因p53诱导细胞凋亡和DNA修复,而MDM2能够结合野生型p53蛋白而产生复合体,来负向调控p53,导致后者受抑或丧失全部活性,对于肿瘤形成起到关键性作用[5]。经研究证实,抑癌因子p53的失活、原癌因子MDM2的活化,可对细胞异常增殖起到促进作用,由此引发肿瘤[6]。p53突变失活是发生率较高的其中一类遗传学改变,MDM2同卵巢肿瘤的扩增、肿瘤复发与转移存在一定联系。 Gu J与Peres LC[7-8]等曾报道在卵巢癌中有MDM2因子过度表达现象。同时观察到高度恶性的肿瘤细胞内存在MDM2高表达现象;因此可判断,MDM2同OC等肿瘤的发展、转移存在一定联系。
siRNA能够对相应基因的mRNA施以特异性降解作用,使此基因表达减弱。微量siRNA就能够大幅降低其编码致病因子的含量,实现剔除目的;此外,在抑制效应方面,siRNA表现出严格的序列特异性,具备良好的治疗针对性,且不良反应弱,能够对癌基因、癌症相关因子等的高表达施以特异性抑制。故而,对于肿瘤基因治疗,siRNA技术提供了一项新研究方法与新技术平台。
此次实验完成了针对MDM2的两对干扰位点序列si-MDM2的人工设计与合成[3]。si-MDM2真核表达质粒完成OC细胞SKOV-3有效转染,开展基因水平与凋亡的测定。在干扰效果上,MDM2的两个干扰位点均表现出高效性。经Real-time PCR 测定发现,si-MDM2可对MDM2因子表达施以有效抑制,采用 MTT 法检测 si-RNA对细胞生长的抑制作用,瞬时转染si-MDM2-1和si-MDM2-2能有效抑制细胞增殖,与对照组和阴性转染组相比,SKOV-3细胞生长抑制作用明显,细胞倍增时间延长。流式细胞术检测si-MDM2可诱发肿瘤细胞凋亡,并导致S期细胞量下降,G0/G1期细胞占比提高,其细胞阻滞效应可能是其能够诱发细胞凋亡的其中一项机制。提示 siRNA基因能明显抑制SKOV-3细胞的增殖性。
此次实验在赵燕颖[9]等研究者探究si-MDM2影响肝癌细胞增殖的基础上,进一步证实si-MDM2也可有效抑制卵巢癌细胞增殖以及有效诱导此类细胞凋亡。表明MDM2在OC治疗方面发挥着关键性作用。通过上述分析可明确,将siRNA技术融入到基因疗法中,可使OC细胞株 SKOV-3增殖明显受抑,能够有效抑制细胞生长,倍增时间延长,对MDM2表达施以特异性干扰具备作为治疗OC新途径的潜力。
