不同左室几何构型阻塞性睡眠呼吸暂停综合征病人颈动脉内中膜厚度与MPV 的相关性
2021-03-25马婧,王健,张勇
马 婧,王 健,张 勇
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是临床常见的睡眠障碍性疾病,与心血管疾病密切相关[1]。已有研究表明,异常左室几何构型与动脉粥样硬化是OSAS 病人较常见的并发症,亦是心血管疾病预后的独立危险因素[2-3]。随着OSAS 患病率的逐年上升,早期诊断动脉粥样硬化对预防其并发症至关重要。OSAS 病人全身炎症及氧化应激是动脉粥样硬化及心血管疾病进展的重要机制[3]。平滑肌细胞向内皮的迁移及增殖以及血小板的活化、聚集是动脉粥样硬化的早期机制[4]。血小板大小与其功能有关,血小板平均体积(mean platelet volume,MPV)可作为血小板活性测量指标,亦可预测动脉粥样硬化[5]。而颈动脉内中膜厚度(carotid intimamedia thickness,CIMT)是临床广泛使用的检测早期内皮缺损和动脉粥样硬化的指标[6]。本研究依据左室几何构型分组,分析OSAS 病人中CIMT 与MPV 的相关性。现报道如下。
1 资料与方法
1.1 研究对象 收集因打鼾于我院呼吸科门诊就诊,经多导睡眠监测确诊为OSAS 的病人2 1 9 例作为OSAS 组,其中女57 例,男162 例,年龄(47.85±11.18)岁。OSAS 诊断标准为每小时呼吸暂停低通气指数(apnea hypopnea index,AHI)≥5 次。排除标准:心力衰竭、心脏瓣膜病、脑血管病、心房颤动、吸烟、糖尿病、血脂异常、肝肾功能障碍、自身免疫病、血液病、癌症、血小板减少症、持续气道正压通气(continuous positive airway pressure,CPAP)治疗史或腭垂腭咽成形术者。同时收集性别、年龄相匹配的50 名健康者为对照组。本研究方案取得受试者知情同意并签署知情同意书。
1.2 方法
1.2.1 多导睡眠呼吸监测 采用EMBlaN-7000(美国邦德)多导睡眠描记仪,对受试者行整夜多导睡眠监测,时间≥7 h。监测前24 h 内禁用安眠药、茶和咖啡。记录呼吸暂停低通气指数(apnea hypopnea index,AHI)、夜间最低血氧饱和度(SaO2)、夜间平均SaO2、SaO2低于90%的时间占总睡眠时间的百分比(T90)。
2011 年修订版的阻塞性睡眠呼吸暂停低通气综合征诊治指南[7]将AHI 定义为平均每小时呼吸暂停与低通气的次数之和;呼吸暂停:睡眠过程中口鼻呼吸气流消失或明显减弱(较基线幅度下降≥90%),持续时间≥10 s;低通气:睡眠过程中口鼻气流较基线水平降低≥30%并伴SaO2下降≥4%,持续时间≥10 s。
1.2.2 一般资料采集方法 记录病人性别、年龄、身高、体重、心率、既往史,计算体质指数(BMI)、体表面积(BSA)。次日晨起空腹、休息20 min 后抽取血液样本,检测病人血小板平均体积、血小板计数、血糖、总胆固醇、三酰甘油。
1.2.3 超声心动图检查 病人平静状态休息30 min后,连接心电图,左侧卧位,采用PHILIPS EPIQ7C 超声仪,探头S5-1,频率1~5 MHz。依据美国超声心动图协会(ASE)[8]标准,常规行经胸M 型超声心动图检查,所有参数至少测量3 个心动周期,并取平均值。记录病人左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室后壁厚度(left ventricular posterior wall thickness,PWTd)和室间隔厚度(interventricular septal thickness,IVSd)。并根据国际标准[9]计算左室质量(left ventricular mass,LVM)、左室质量指数(left ventricular mass index,LVMI)、相对室壁厚度(relative wall thickness,RWT)。左室射血分数(LVEF)由双平面Simpson 法测定。LVM=0.8×1.04[(LVEDD+
IVSd+PWTd)3-LVEDD3]+0.6;LVMI=LVM/BSA;RWT=(2×PWTd)/LVEDD。依据2018 年盛媛媛等[10]的多中心研究,LVMI 临界值女性为99 g/m2,男性为108 g/m2;RWT 的临界值:女性为0.49,男性为0.51。将左室分为4 个构型,正常构型(normal geometry,NG):LVMI、RWT 均正常;向心性重构(concentric remodeling,CR):LVMI 正常,RWT 大于临界值;离心性肥厚(eccentric hypertrophy,EH):LVMI 大于临界值,RWT 正常;向心性肥厚(concentric hypertrophy,CH):LVMI 和RWT均大于临界值。依据LVMI 和RWT 将OSAS 病人分为NG 组、CR 组、EH 组、CH 组。
1.2.4 颈动脉超声检查 采用PHILIPS EPIQ7C 超声仪,探头12-3,频率3~12 MHz。病人去枕仰卧位,头略偏向对侧,先横切面扫查,将颈总动脉置于图像正中,随后纵切面清晰显示内膜面,选取颈总动脉分叉处近端1.0 cm 内的内中膜最厚处进行测量,双侧各测量3 次,取平均值作为CIMT 值[11-12]。
1.3 统计学处理 使用SPSS 20.0 统计软件进行数据分析。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析;计数资料以百分比表示,组间比较采用χ2检验;采用Pearson 相关分析及逐步线性回归确定CIMT 的影响因素。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组临床资料、多导睡眠呼吸监测参数比较 NG 组107 例(48.9%),CR 组36 例(16.4%),EH 组47例(21.5%),CH 组29 例(13.2%)。各组男性、年龄、心率、三酰甘油、血糖、血小板计数比较差异均无统计学意义(P>0.05);与对照组相比,NG 组、CR 组、EH组、CH 组BMI、MPV 增加(P<0.05),CH 组总胆固醇升高(P<0.05)。CH 组MPV 高于NG 组、CR 组、EH组(P<0.05)。NG 组、CR 组、EH 组、CH 组间AHI、夜间最低SaO2、夜间平均SaO2、T90 比较差异均无统计学意义(P>0.05)。详见表1。
表1 各组一般资料、多导睡眠呼吸监测参数比较(±s)
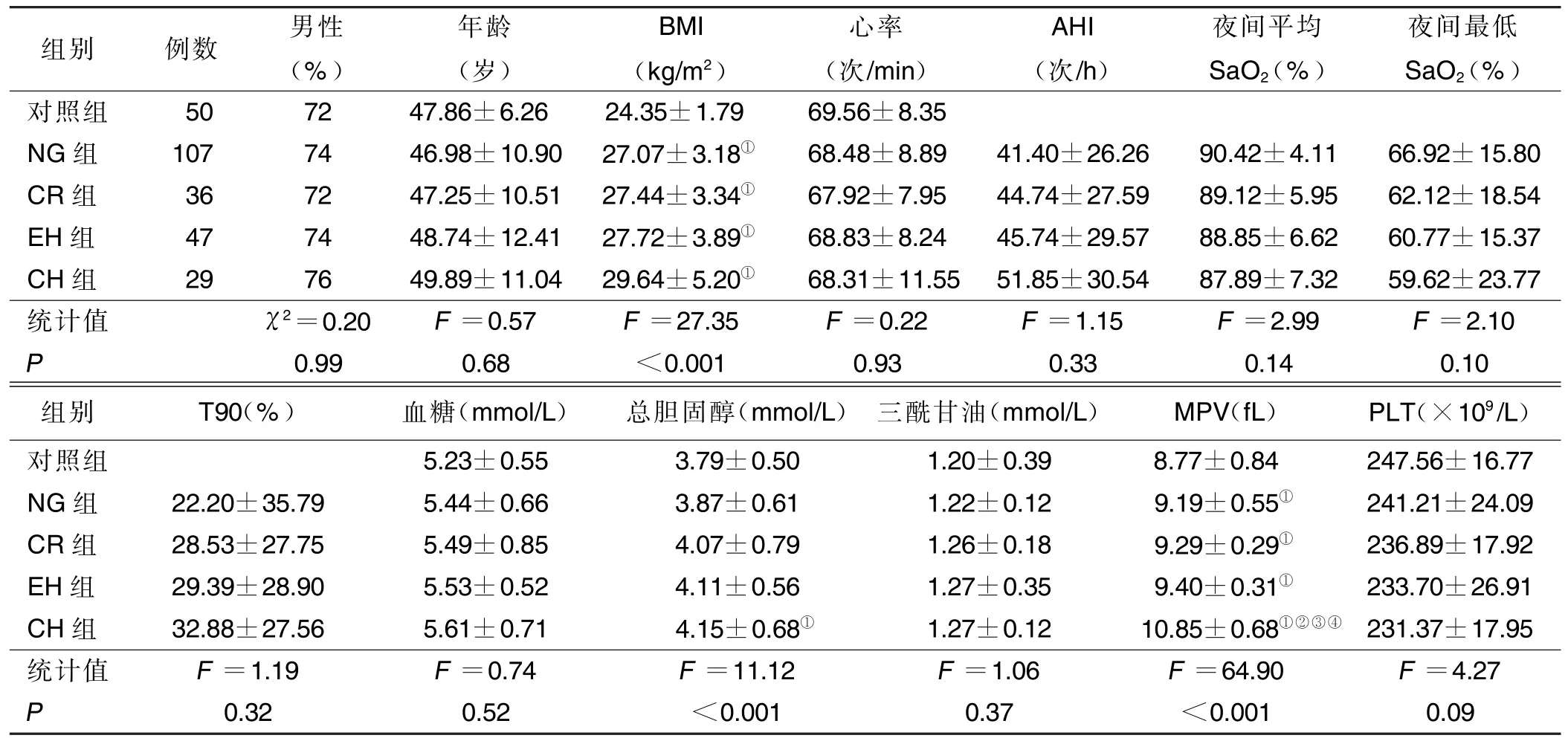
表1 各组一般资料、多导睡眠呼吸监测参数比较(±s)
与对照组比较,①P <0.05;与NG 组比较,②P <0.05;与CR 组比较,③P <0.05;与EH 组比较,④P <0.05。
组别 例数 男性(%)年龄(岁)BMI(kg/m2)心率(次/min)AHI(次/h)夜间平均SaO2(%)夜间最低SaO2(%)对照组 50 72 47.86±6.26 24.35±1.79 69.56±8.35 NG 组 107 74 46.98±10.90 27.07±3.18① 68.48±8.89 41.40±26.26 90.42±4.11 66.92±15.80 CR 组 36 72 47.25±10.51 27.44±3.34① 67.92±7.95 44.74±27.59 89.12±5.95 62.12±18.54 EH 组 47 74 48.74±12.41 27.72±3.89① 68.83±8.24 45.74±29.57 88.85±6.62 60.77±15.37 CH 组 29 76 49.89±11.04 29.64±5.20① 68.31±11.55 51.85±30.54 87.89±7.32 59.62±23.77统计值 χ2=0.20 F =0.57 F =27.35 F =0.22 F =1.15 F =2.99 F =2.10 P 0.99 0.68 <0.001 0.93 0.33 0.14 0.10组别 T90(%) 血糖(mmol/L) 总胆固醇(mmol/L) 三酰甘油(mmol/L) MPV(fL) PLT(×109/L)对照组 5.23±0.55 3.79±0.50 1.20±0.39 8.77±0.84 247.56±16.77 NG 组 22.20±35.79 5.44±0.66 3.87±0.61 1.22±0.12 9.19±0.55① 241.21±24.09 CR 组 28.53±27.75 5.49±0.85 4.07±0.79 1.26±0.18 9.29±0.29① 236.89±17.92 EH 组 29.39±28.90 5.53±0.52 4.11±0.56 1.27±0.35 9.40±0.31① 233.70±26.91 CH 组 32.88±27.56 5.61±0.71 4.15±0.68① 1.27±0.12 10.85±0.68①②③④ 231.37±17.95统计值 F =1.19 F =0.74 F =11.12 F =1.06 F =64.90 F =4.27 P 0.32 0.52 <0.001 0.37 <0.001 0.09
2.2 各组超声心动图参数及CIMT 比较 与对照组、NG 组相比,CR 组LVMI、RWT、PWTd 增高(P<0.05);与CR 组相比,EH 组LVMI 增 高,RWT 减 小(P<0.05);与EH 组相比,CH 组LVMI、RWT、PWTd 增高(P<0.05);与对照组、NG 组相比,CH 组LVEF 明显降低(P<0.05)。详见表2。与对照组相比,NG 组、CR 组、EH 组、CH组CIMT 增大(P<0.05);与NG 组、CR 组、EH 组相比,CH 组CIMT 增大(P<0.05)。详见表2 和图1。
表2 各组CIMT 及超声心动图参数比较(±s)
与对照组比较,①P <0.05;与NG 组比较,②P <0.05;与CR 组比较,③P <0.05;与EH 组比较,④P <0.05。
组别 例数 CIMT(mm) LVMI(g/m2) RWT PWTd(cm) LVEF(%)对照组 50 0.55±0.04 79.76±7.54 0.36±0.03 0.83±0.06 67.70±4.89 NG 组 107 0.60±0.04① 82.31±13.91 0.37±0.05 0.88±0.11 67.35±6.79 CR 组 36 0.62±0.05① 88.51±11.78①② 0.52±0.02①② 1.14±0.07①② 63.33±6.76 EH 组 47 0.64±0.08① 105.90±10.48①②③ 0.39±0.06③ 1.03±0.12 61.11±5.58 CH 组 29 0.75±0.06①②③④ 116.52±6.56①②③④ 0.52±0.02①②④ 1.25±0.06①②④ 59.17±2.96①②F 值 84.06 119.35 145.72 149.01 16.54 P <0.001 <0.001 <0.001 <0.001 <0.001

图1 各组颈动脉超声检查结果(↓↑之间为颈动脉内中膜)
2.3 Pearson 相关性分析及逐步线性回归分析Pearson 相关分析显示,CIMT 与年龄(r=0.406,P=0.029)、MPV(r=0.636,P<0.001)、AHI(r=0.571,P=0.001)、T90(r=0.417,P=0.024)、LVMI(r=0.456,P=0.013)呈正相关,与RWT(r=0.104,P=0.592)、夜间平均SaO2(r=-0.042,P=0.829)、夜间最低SaO2(r=-0.012,P=0.953)无明显相关性。对P<0.05的指标使用逐步线性回归分析,结果显示CIMT 与MPV(β=0.549,P<0.001)、AHI(β=0.469,P=0.001)具有相关性。
3 讨 论
本研究结果显示,与对照组比较,NG 组、CR 组、EH 组、CH 组CIMT、MPV 增大,以CH 组较显著,相关性分析及回归分析显示,CIMT与MPV、AHI相关(P<0.05)。
本研究结果显示,OSAS 各组较对照组CIMT 增厚。Akdag 等[13]对OSAS 病人动脉僵硬度的研究结果显示,OSAS 组CIMT 明显高于对照组。同样,Sarioglu等[12]研究亦显示,OSAS 组CIMT 值明显高于对照组。本研究将OSAS 病人按左室几何构型分组,发现CH组CIMT 较其他组明显增厚,且与AHI 相关。Sarioglu等[12]亦发现了二者之间存在相关性。Jaroch 等[14]对不同左室几何构型高血压病人颈动脉僵硬度进行研究,结果显示CIMT 值按NG、CR、EH、CH 组依次递增。本研究基于OSAS 病人,亦发现CIMT 在NG 组、CR 组、EH 组、CH 组逐渐递增。考虑可能机制是OSAS病人长期夜间反复低氧,导致氧化应激及交感神经系统过度兴奋,从而造成内皮损伤[15],而CIMT 是血管早期的改变。此外,OSAS 常合并高血压,引起心脏结构改变的同时亦伴随着动脉壁结构的改变[14],导致颈动脉局部脉压的增高,而局部脉压的增加也可能CIMT增大。
本研究结果还显示,OSAS 各组MPV 值较对照组增高。Karakaşm 等[16]对不伴有心血管疾病危险因素的OSAS 病人MPV 与疾病严重程度的关系进行研究,结果显示MPV 按对照组、轻度组、中度组、重度组顺序递增,其中重度OSAS 组MPV 明显高于对照组。Kanbay 等[17]研究OSAS 病人MPV 水平及其与心血管疾病的关系显示,中重度OSAS 组MPV 明显增高。另外,本研究在左室几何构型的基础上,发现CH 组MPV 明显增高。先前的研究提示,OSAS 病人血小板活化、聚集增加,可能机制是OSAS 病人交感神经系统过度兴奋、长期反复的夜间低氧导致凝血能力增强和血小板活化聚集,进而加剧动脉粥样硬化,提高了心血管疾病的风险[16-17]。同时还有研究表明,左室肥厚过程中血小板活化明显增加[18],而活化血小板中释放的因子增加了心肌细胞质量,并诱导成纤维细胞和平滑肌细胞增殖[19],二者之间的交互作用,最终导致了CH 组左室肥厚及MPV 水平明显增加,进一步提示CH 病人心血管疾病风险的增加。
此外,本研究在调整了年龄、T90、LVMI 等因素后,MPV 仍与CIMT 相关。Yarlioglues 等[20]收集80 例新诊断的成人高血压病人,调查其亚临床靶器官损害,如蛋白尿、左心室肥厚和颈动脉粥样硬化,发现MPV 与CIMT、左心室肥厚、肾脏损害呈正相关。Sarioglu等[12]研究显示OSAS 病人MPV 与CIMT 有相关性。表明在动脉粥样硬化的进展中血小板活化、聚集起着重要作用。研究证明,血小板活性与其大小有关,较大血小板的代谢更加活跃、活性更强,而MPV 则是最常用的血小板大小测量指标,MPV 越大,意味着动脉局部粥样硬化形成的风险就越大[5]。此外,动脉粥样硬化及斑块的发展依赖于内皮及血小板活化产物[4]。再者,MPV 与CIMT 之间的相关性亦表明MPV 可以较好地预测动脉粥样硬化。
综上所述,OSAS 病人CIMT 增厚,而MPV 可作为反映CIMT 的间接指标,为早期检测OSAS 病人亚临床动脉粥样硬化提供依据。
