Toll 样受体对急性缺血性脑卒中临床疗效和预后的预测价值
2021-03-25王美娥刘龙江路永刚
王美娥,刘龙江,路永刚
急性缺血性脑卒中(acute ischemic stroke,AIS)是引起死亡及致残的首要原因,美国每年约有795 万例新发或复发脑卒中病人[1],我国随着老龄化社会进程加快,脑卒中发病率不断上升,其中AIS 占70%,增加了社会和家庭的医疗负担[2]。发病早期进行静脉溶栓是挽救缺血半暗带、降低致残率和病死率的首选,但是受时间窗限制及病情严重程度不同,临床疗效和预后不尽相同。探讨与疗效和预后相关的关键生物标志物有助于识别高危人群,更好地指导临床治疗,改善病人预后。Toll 样受体(Toll like receptors,TLRs)是一种跨膜蛋白,可以识别外源性病原体相关分子模式或内源性应激或损伤相关分子模式,并启动炎症反应[3]。在TLRs 样受体中,TLR2 和TLR4 在脑缺血再灌注损伤的病理过程中起重要作用,其介导的核因子-κB(nuclear factor-kappa B,NF-κB)激活参与AIS 后继发性脑损伤[3]。TLR3 介导的TRIF(Toll/IL-1 receptor domain containing adaptor inducing IFN-β)信号通路参与了脑缺血预适应后炎症抑制过程[4]。TLR7、TLR8 是TLRs内源性受体,来源于小胶质细胞,均参与AIS 发病[5]。TLRs 是否能为AIS 临床疗效和预后评估提供有效信息尚待进一步探讨,本研究检测AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平,探讨其临床应用价值。
1 资料与方法
1.1 临床资料 选取2017 年6 月—2019 年6 月我院神经内科收治的105 例AIS 病人。纳入标准:①首次发病,经头颅CT 或磁共振成像(MRI)证实存在脑缺血灶,符合《中国急性缺血性脑卒中诊治指南2014》[6]中AIS 诊断标准;②发病后4 h 内入院;③接受静脉溶栓治疗。排除标准:①CT 或MRI 提示出血性病灶;②既往AIS 或脑出血病史、颅内巨大肿瘤等疾病;③近3 个月颅脑外伤史、颅内手术史病人。105 例AIS 病人中,男57 例,女48 例;年龄51~69(64.39±3.71)岁;体质指数(body mass index,BMI)23~27(24.01±2.69)kg/m2;发病至入院时间2~4(2.34±0.31)h;梗死面积:大梗死(直径>3.10 cm 并累及2 个脑解剖部位)36例,小梗死(直径1.15~3.10 cm)51 例,腔隙性梗死(直径<1.15 cm)18 例;神经功能缺损程度[7]:轻度[美国国立卫生研究院脑卒中量表(National Institute of Health Stoke Scale,NIHSS)评分≤6 分]21 例,中度(NIHSS 7~14 分)57 例,重度(NIHSS 评分≥15分)27 例。本研究获得我院伦理委员会批准,病人及其家属均知情同意并签署知情同意书。
1.2 血清TLRs 检测 所有病人入院24 h 采集空腹静脉血3~5 mL,置于TDZ4-WS 低速自动平衡离心机(长沙湘智离心机仪器有限公司),4 ℃3 000 r/min 离心15 min(离心半径10 cm),取血浆保存于-80 ℃超低温冰箱(Thermo Fisher 公司)。酶联免疫吸附试验检测血清TLR2、TLR3、TLR4、TLR7、TLR8 水平,仪器为意大利全自动酶免分析仪BIOBASE2000,试剂盒购自美国Epitope Diagnostics 公司。
1.3 治疗及疗效评估 所有病人入院后均给予吸氧、营养神经、改善脑循环、纠正电解质紊乱等基础治疗,以及重组人组织型纤溶酶原激活物(recombinant human tissue plasminogen activator,rt-PA)静脉溶栓治疗。
1.4 预后评价 治疗3 个月后,采用改良Rankin 量表(modified Rankin Scale,mRS)[8]评估病人临床转归。无功能受限和遗留症状计0 分;有症状,无明显功能障碍计1 分;轻度残疾,但生活能自理,计2 分;中度残疾计3 分;中重度残疾计4 分;重度残疾计5 分,死亡计6 分。0~2 分为预后良好,3 分及以上为预后不良。本组105 例病人治疗3 个月预后良好86 例,预后不良19 例。
1.5 疗效评价标准 治疗4 周后评价疗效,痊愈:NIHSS 评分减少91%~100%,残疾程度0 级;显效:NIHSS 评分减少46%~90%,残疾程度1~3 级;有效:NIHSS 评分减少18%~45%,临床症状有所好转;无效:NIHSS 评分减少<18%或增加>18%,甚至死亡[9]。将痊愈+显效+有效合并为有效。
1.6 统计学处理 采用SPSS 25.0 统计软件进行数据分析。计量资料经Kolmogorov-Smirnov 法进行拟合优度检验,符合正态分布以均数±标准差(±s)表示,多组间采用单因素方差分析,两组间比较采用独立样本t检验。采用Pearson 相关分析法分析TLRs 与梗死面积、NIHSS 评分、mRS 评分的相关性。采用受试者工作特征曲线(receiver operator characteristics curve,ROC)分析TLRs 对AIS 病人疗效和预后的预测价值。所有统计均采用双侧检验,检验水准α=0.05。
2 结 果
2.1 不同性别、年龄AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较 不同年龄、性别病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较差异均无统计学意义(P>0.05)。详见表1。
表1 不同性别、年龄AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较( ±s) 单位:ng/mL
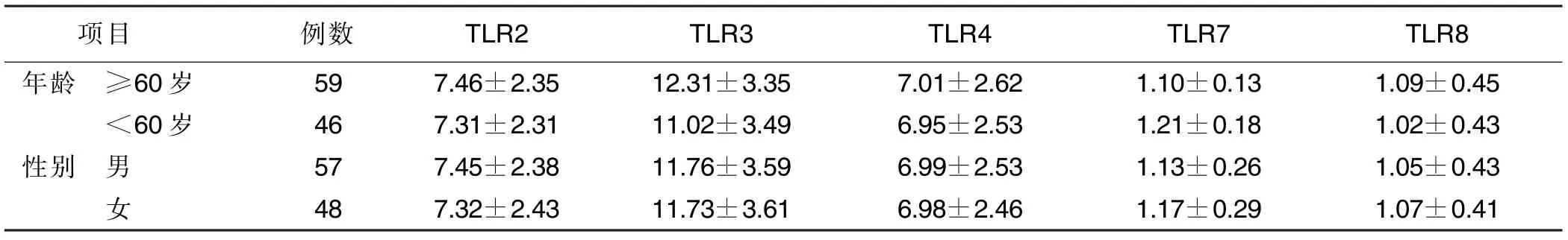
表1 不同性别、年龄AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较( ±s) 单位:ng/mL
项目 例数 TLR2 TLR3 TLR4 TLR7 TLR8年龄 ≥60 岁 59 7.46±2.35 12.31±3.35 7.01±2.62 1.10±0.13 1.09±0.45<60 岁 46 7.31±2.31 11.02±3.49 6.95±2.53 1.21±0.18 1.02±0.43性别 男 57 7.45±2.38 11.76±3.59 6.99±2.53 1.13±0.26 1.05±0.43女48 7.32±2.43 11.73±3.61 6.98±2.46 1.17±0.29 1.07±0.41
2.2 不同梗死面积AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较 AIS 大梗死病人血清TLR3、TLR7 水平低于小梗死和腔隙性梗死病人(P<0.05),TLR2 高于小梗死和腔隙性梗死病人(P<0.05);小梗死病人血清TLR3、TLR7 水平低于腔隙性梗死病人(P<0.05),TLR2 高于腔隙性梗死病人(P<0.05)。不同梗死面积病人TLR4、TLR8 比较差异均无统计学意义(P>0.05)。详见表2。
表2 不同梗死面积AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较(±s) 单位:ng/mL

表2 不同梗死面积AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较(±s) 单位:ng/mL
与腔隙性梗死比较,①P <0.05;与小梗死比较,②P <0.05。
梗死面积 例数 TLR2 TLR3 TLR4 TLR7 TLR8腔隙性梗死 18 4.13±1.53 15.16±4.52 6.71±2.35 2.45±0.43 1.03±0.41小梗死 51 7.32±2.16① 13.05±3.61① 6.94±2.43 1.13±0.34① 1.06±0.43大梗死 36 9.13±2.69①② 8.18±2.03①② 7.18±2.67 0.52±0.25①② 1.07±0.49
2.3 不同神经功能缺损程度AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水 平比较 重度病人血清TLR3、TLR7 水平低于中度和轻度病人(P<0.05),中度病人血清TLR3、TLR7 水平低于轻度病人(P<0.05);重度病人血清TLR2 水平高于中度和轻度病人(P<0.05),中度病人血清TLR2 水平高于轻度病人(P<0.05)。不同神经功能缺损程度病人TLR4、TLR8 比较差异均无统计学意义(P>0.05)。详见表3。
表3 不同神经功能缺损程度AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较(±s) 单位:ng/mL
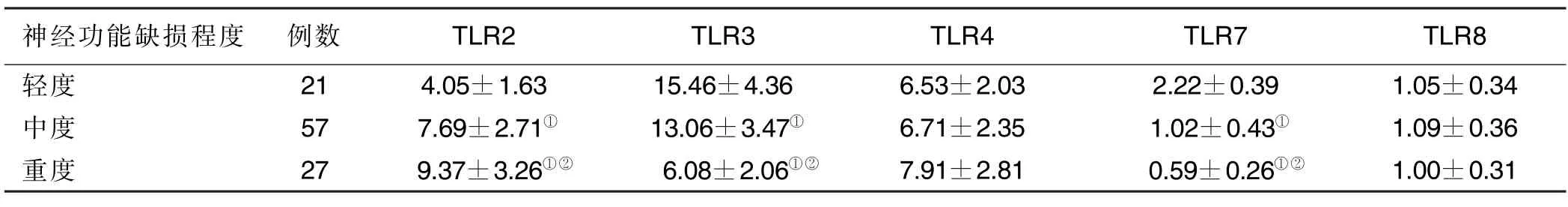
表3 不同神经功能缺损程度AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较(±s) 单位:ng/mL
与轻度比较,①P <0.05;与中度比较,②P <0.05。
神经功能缺损程度 例数 TLR2 TLR3 TLR4 TLR7 TLR8轻度 21 4.05±1.63 15.46±4.36 6.53±2.03 2.22±0.39 1.05±0.34中度 57 7.69±2.71① 13.06±3.47① 6.71±2.35 1.02±0.43① 1.09±0.36重度 27 9.37±3.26①② 6.08±2.06①② 7.91±2.81 0.59±0.26①② 1.00±0.31
2.4 不同疗效结果AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较 105 例AIS 病人治疗有效80例,无效25 例。有效病人血清TLR3 水平高于无效病人(P<0.05),TLR2 水平低于无效病人(P<0.05)。有效与无效病人TLR4、TLR8、TLR7 比较差异均无统计学意义(P>0.05)。详见表4。
表4 不同疗效结果AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较(±s) 单位:ng/mL

表4 不同疗效结果AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较(±s) 单位:ng/mL
与无效比较,①P <0.05。
疗效 例数 TLR2 TLR3 TLR4 TLR7 TLR8有效 80 6.32±2.03① 13.35±4.13① 6.95±2.31 1.15±0.24 1.06±0.33无效 25 10.83±3.97 6.61±2.34 7.09±2.46 1.14±0.21 1.06±0.31
2.5 不同预后AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较 预后良好病人血清TLR3 水平高于预后不良病人(P<0.05),TLR2 水平低于预后不良病人(P<0.05)。预后良好与预后不良病人TLR4、TLR8、TLR7 比较差异均无统计学意义(P>0.05)。详见表5。
表5 不同预后AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较(±s) 单位:ng/mL

表5 不同预后AIS 病人血清TLR2、TLR3、TLR4、TLR7、TLR8 水平比较(±s) 单位:ng/mL
与不良比较,①P <0.05。
预后 例数 TLR2 TLR3 TLR4 TLR7 TLR8良好 86 6.53±2.11① 13.05±4.65① 6.85±2.16 1.16±0.25 1.03±0.28不良 19 11.32±3.84 5.84±2.31 7.58±2.34 1.09±0.21 1.19±0.35
2.6 TLRs 与AIS 病人梗死面积、NIHSS 评分、mRS评分的相关性 TLR2 与梗死面积、NIHSS 评分呈正相关(P<0.05),与mRS 评分呈负相关(P<0.05);TLR3 与梗死面积、NIHSS 评分呈负相关(P<0.05),与mRS 评分呈正相关(P<0.05);TLR7 与梗死面积、NIHSS 评分呈负相关(P<0.05),与mRS 评分无明显相关(P>0.05);TLR4、TLR8 与梗死面积、NIHSS 评分、mRS 评分均无明显相关性(P>0.05)。详见表6。
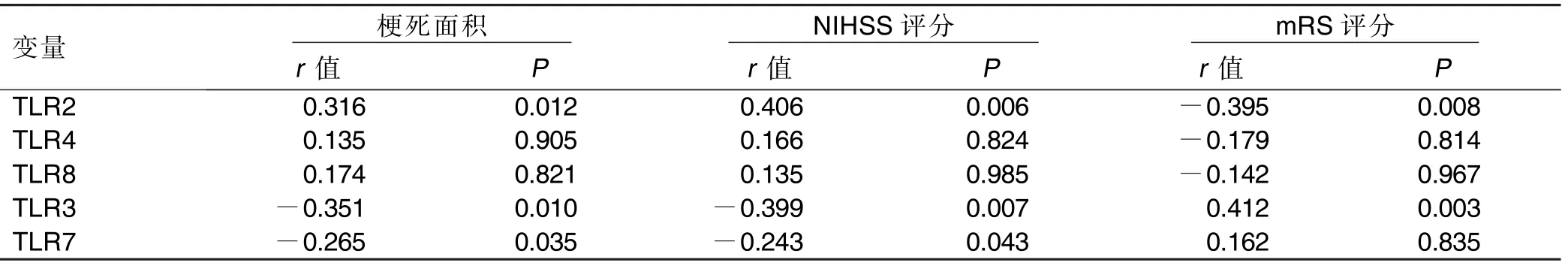
表6 AIS 病人与TLRs 梗死面积、NIHSS 评分、mRS 评分的相关性
2.7 TLR2、TLR3 预测AIS 的临床疗效分析 ROC 分析结果显示,TLR2、TLR3 预测AIS 临床治疗有效的曲线下面积(area under the curve,AUC)分别为0.664[95%CI(0.541,0.787),P=0.014]、0.820[95%CI(0.722,0.919),P<0.001],详见图1、图2。TLR2、TLR3 预测AIS 临床治疗有效的最佳截断值(cut-off)、灵敏度、特异度、阳性预测值、阴性预测值详见表7。
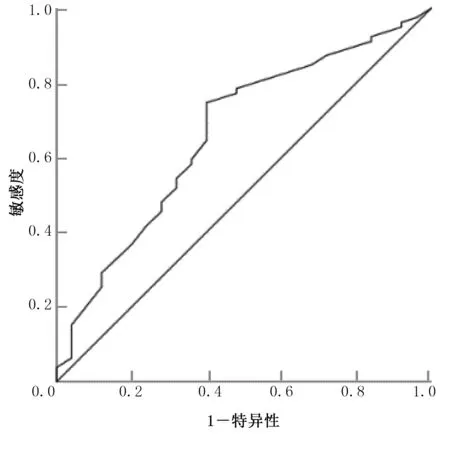
图1 TLR2 预测AIS 临床疗效的ROC 曲线图
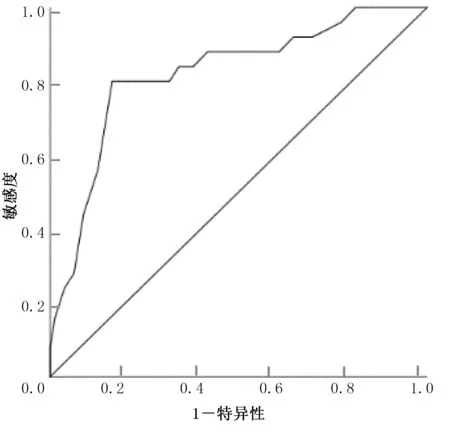
图2 TLR3 预测AIS 临床疗效的ROC 曲线图
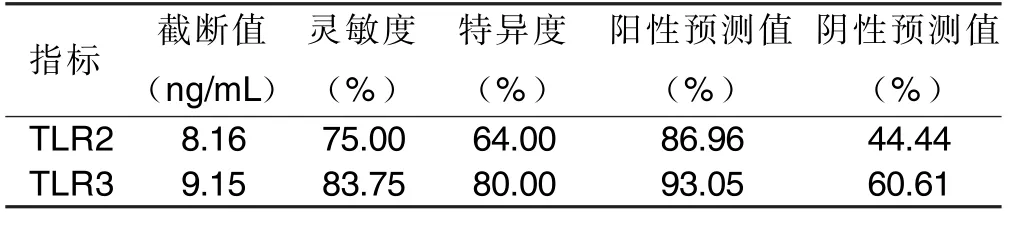
表7 TLR2、TLR3 预测AIS 临床疗效的效能
2.8 TLR2、TLR3 预测AIS 预后的价值分析 研究结果显示,ROC 分析TLR2、TLR3 预测AIS 预后的AUC分别为0.788[95%CI(0.680,0.896),P<0.001]、0.787[95%CI(0.654,0.921),P<0.001],详见图3、图4。TLR2、TLR3 预测AIS 预后的截断值、灵敏度、特异度、阳性预测值、阴性预测值详见表8。
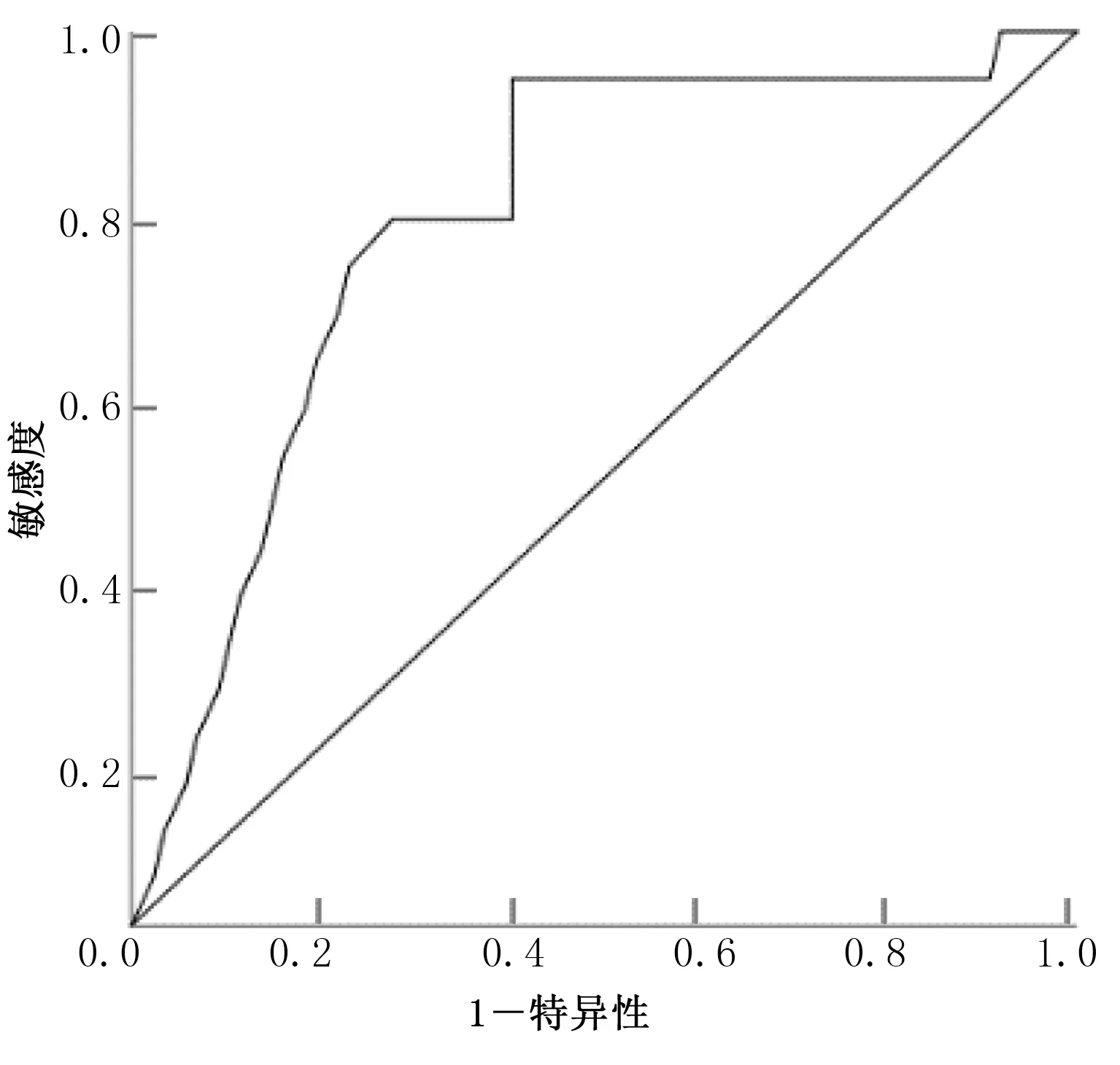
图3 TLR2 预测AIS 预后的ROC 曲线图
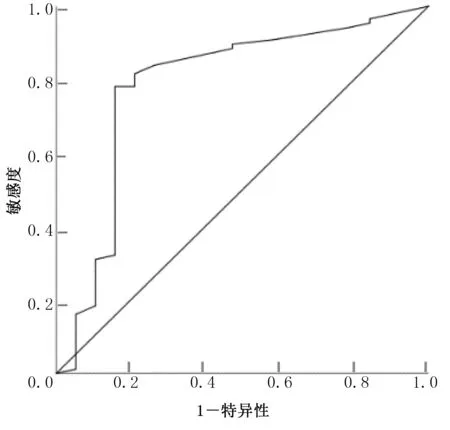
图4 TLR3 预测AIS 预后的ROC 曲线图

表8 TLR2、TLR3 预测AIS 预后的效能
3 讨 论
脑组织缺血可导致炎性反应,引起继发性脑损伤,先天免疫在脑缺血损伤中起着重要作用,目前TLRs在脑梗死病人中作用的研究相对较少,其临床应用价值尚待开发。TLRs 可识别外源性病原菌或感染,在免疫反应中可被内源性损伤信号激活,触发炎症反应或细胞凋亡[10]。TLRs 通过髓样分化因子88(myeloid differentiation factor 88,MyD88)信号传导途径激活,介导白介素-1 受体相关激酶磷酸化,肿瘤坏死因子受体相关因子6 识别,激活NF-κB 信号通路,增加促炎基因转录、表达,导致肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和白细胞介素6(IL-6)等炎性因子释放,加重炎症反应。AIS 发生后损伤脑组织或神经细胞释放热休克蛋白、S100 蛋白等内源性分子,被特定TLRs 识别并结合,进而诱导单核细胞或T 细胞活化,激活炎性反应,加重脑组织损伤[11]。因此,推测TLRs可能对AIS 临床病情评估和预后预测提供有价值信息。
TLR2 是目前临床研究相对较多的TLRs 受体,其在胶质细胞、神经元和内皮细胞中均有广泛的表达,参与机体炎症反应和免疫应答。脑组织缺血缺氧后,TLR2 与炎症通路辅助受体结合,加速促炎因子释放,加剧脑缺血损伤[12]。TLR2-MyD88 信号通路可激活丝裂原活化蛋白激酶,诱导基质金属蛋白酶-9 表达上调,加剧脑血管屏障损伤[13]。本研究发现,治疗有效的AIS 病人血清TLR2 水平低于无效的AIS 病人,TLR2 与NIHSS 评分呈正相关,可能与治疗后梗死区域脑供血恢复,缺血缺氧状态改善,氧化应激和炎症反应降低有关。小鼠大脑中动脉闭塞模型注射TLR2 抗体可抑制脑缺血后白细胞的聚集以及小胶质细胞的迁移,挽救受损神经元[14],说明TLR2 过度表达可加重脑缺血再灌注脑损伤。TLR2 与AIS 预后的关系尚不明确。本研究结果显示,预后良好病人血清TLR2 水平低于预后不良病人,相关性TLR2 与mRS 评分呈负相关,Brea 等[15]同样发现AIS 发病12 h 内全血TLR2 mRNA 表达与不良结局相关,提示TLR2 表达异常升高是导致AIS 不良结局的主要原因之一。有研究指出TLR2 在脑梗死发病机制中发挥保护作用,TLR2 表达有助于梗死区域侧支循环开放以及新生血管生成[16],TLR2 在预后良好AIS 病人中呈高度表达[17]。但是更多研究显示抑制TLR2 表达及其信号通路可降低脑卒中后炎症反应和脑组织损伤活性,缩小脑梗死面积,降低急性病死率,减轻脑水肿,维持血-脑屏障功能[18-19]。
TLR3 是唯一通过TLRs-MyD88 途径介导抗炎作用的模式识别受体,主要在胶质细胞中表达,不直接参与TLRs 通路激活导致的炎症反应。短暂性局灶性脑缺血后,小胶质细胞/巨噬细胞TLR3 及其下游细胞因子IL-6 明显降低,TLR3 激活可能促进缺血后神经元的存活[20]。脑梗死后死亡神经细胞释放内源性分子,与TLR3 结合募集调节蛋白,激活干扰素调节因子3,产生β干扰素、α干扰素等抗炎因子[21],进而抑制颅内白细胞浸润以及外周血B 淋巴细胞增殖,发挥降低炎性损伤,保护脑神经的作用[22-23]。本研究结果显示,TLR3 与AIS 病人梗死面积、NIHSS 评分呈负相关,与mRS 评分呈正相关,提示TLR3 在AIS 发病机制中发挥保护作用,TLR3 表达缺失与神经缺损加重和不良预后有关。邓玲娜等[24]研究显示TLR3 表达与脑梗死良好结局有关,TLR3 在脑缺血损伤中起修复作用。近期报道显示TLR3 配体poly-IC 预处理可减少大鼠局灶性脑缺血后反应性星形胶质细胞增殖,促进神经功能恢复[25]。
TLR4 是脑卒中促炎级联反应起始因子,其下游因子信号通路可介导炎症反应,导致梗死灶面积增加和缺血再灌注损伤[26]。本研究发现,大梗死、重度神经功能缺损AIS 病人TLR4 水平较高,但不同梗死面积、神经功能缺损AIS 病人TLR4 水平比较差异均无统计学意义,TLR4 与AIS 临床疗效和预后亦无明显相关性,提示TLR4 可能对AIS 疗效和预后评估尚无临床价值。TLR7 与梗死面积和NIHSS 评分存在一定关联,但与mRS 评分较弱,可能与样本量小、统计结果偏倚有关。
本研究ROC 曲线分析显示,TLR2、TLR3 对AIS临床疗效和预后评估均有一定价值,提示TLR2 升高、TLR3 降低预示着AIS 病人疗效、预后较差,临床对于此类病人应优化治疗方案,加强病情检测,以最大限度改善病人预后。同时提示TLR2、TLR3 可作为AIS 治疗的潜在靶点。总之,TLRs 与AIS 病人临床疗效和预后有关,血清TLR2、TLR3 水平可作为临床疗效评估和预后预测的辅助生物学指标。
