藻—溞系统对凡纳滨对虾养殖水体调控效果的研究
2021-03-25原居林练青平郭爱环顾志敏
刘 梅,原居林,倪 蒙,练青平,郭爱环,顾志敏
(浙江省淡水水产研究所,农业农村部淡水渔业健康养殖重点实验室,浙江省淡水水产遗传育种重点实验室,浙江 湖州 313001)
在凡纳滨对虾(Litopenaeusvannamei)养殖过程中,作为养殖水体的初级生产者,有益藻相的稳定不仅与水质的好坏息息相关,还能有效提高养殖对虾的免疫抗病能力,作为生物饵料,其对于维持养殖的健康持续发展至关重要[1-3]。刘梅等[4]发现,蛋白核小球藻(Chlorellapyrenoidosa)和隐藻(Cryptomonasobovata)对凡纳滨对虾养殖尾水中的亚硝态氮具有较好的去除效果,且隐藻去除效果较持久;铜绿微囊藻(Microcystisaeruginosa)和衣藻(Chlamydomonassp.)具有较好的硝态氮去除效果;衣藻对氨氮具有较快且持久的去除率,去除率可达100%。刘盼等[5]发现,蛋白核小球藻在高质量浓度的硝态氮和氨氮中扩繁速度更快,而斜生栅藻(Scenedesmusobliquus)在低质量浓度的硝态氮和氨氮中更易繁殖。因此,近些年,通过接种有益藻种,培养优势种是目前对虾养殖过程中常用的水环境调控措施之一[6-7]。
生产中养殖水体常处于富营养化状态,接种有益藻种,其成为优势种后,极易过度繁殖,影响水体透明度,易发生“倒藻”,水环境稳定性差,引起虾类应激反应等[8-9]。因此,如何有效地控制对虾高密度养殖过程中的良好水质,并保持有益藻相稳定,是目前对虾养殖面临的主要挑战之一。在池塘生态系统中,浮游植物的生长不仅受到光照、水温、营养盐等环境因子的影响,而且宜受到生物因素的控制[10-11]。因此,通过生物操纵即利用浮游动物牧食浮游植物来控制其密度,而养殖对象进一步摄食浮游动物,从而维持藻相长久稳定具有一定可行性,相关研究已有报道[12-14]。大型溞(Daphniamagna)是养殖池塘最常见的大型浮游动物之一,其生长繁殖力强,优势种时间长,对浮游植物具有较高的牧食压力,可以改善水质,被认为是进行生物操纵的关键种[15-16]。但迄今为止,仍缺乏关于藻—溞组合系统对凡纳滨对虾养殖水体净化效果及相互生长影响的系统研究。
鉴于此,笔者选取前期筛选的蛋白核小球藻、衣藻和隐藻作为试验微藻,选取大型溞作为浮游动物,设计和研究不同藻—溞微生态系统对凡纳滨对虾养殖水体的净化作用及这些藻类和大型溞的生长特征,以期建立一套稳定凡纳滨对虾养殖池塘中有益藻相的调控技术,为凡纳滨对虾的健康养殖提供参考。
1 材料与方法
1.1 试验材料
试验藻种:3株藻种分别为绿藻门中的蛋白核小球藻(FACHB-5)、衣藻(FACHB-715)和隐藻门中的隐藻(FACHB-1301),均购于中国科学院水生生物研究所藻种库(武汉)。试验前,将保存的藻种转移到250 mL三角烧瓶(内有100 mL液体培养基)中,进行扩大和驯化培养:用蓝绿(BG-11)培养液培养蛋白核小球藻,亚硒酸(SE)培养液培养衣藻,AF-6培养液培养隐藻。每3 d转接1次,共转接2~3次,当达到同步生长时,即可作为试验藻种液,镜检初始密度约1.0×108个/mL。
试验大型溞:取自凡纳滨对虾养殖塘,实验室内进行纯化培养,试验前在20 ℃、光照度3000 lx和光暗比14L∶10D下驯化。试验中使用同一母体繁殖3代以上2 d左右的成熟大型溞。
试验水样:取自宁波慈溪滩涂养殖场,为养殖第92天时的养殖水体,盐度为5,经高压灭菌后用于本试验,其水质指标见表1。
1.2 试验设计
试验组共设10组,分别为蛋白核小球藻组(C1)、蛋白核小球藻+大型溞组(C2)、衣藻组(C3)、衣藻+大型溞组(C4)、隐藻组(C5)、隐藻+大型溞组(C6)、蛋白核小球藻+衣藻组(C7)、蛋白核小球藻+衣藻+大型溞组(C8)、衣藻+隐藻组(C9)、衣藻+隐藻+大型溞组(C10),每个处理组设3个平行。取5000 mL灭菌后的对虾养殖尾水于5000 mL的经过高压灭菌的烧杯中,烧杯瓶口覆盖保鲜膜以防止水分流失,同时保鲜膜中间开一约1 cm的小口,以保持水面与大气相通。为了达到一致的每种藻类初始密度5×105个/mL,分别接种初始密度为1×108个/mL各藻种原始藻液25 mL于养殖尾水中,大型溞投放密度为1个/L,即含有大型溞的处理组投放5个。
1.3 培养条件及水质测定
烧杯置于温度25 ℃、光照度3000 lx和光暗比14L∶10D的光照培养箱内培养。培养期间,光照条件下每隔3 h人工摇动一次。每间隔3 d的10:00测定溶液的pH、溶解氧,所有样品测定完毕,取50 mL水样检测总氮、氨氮、硝态氮、亚硝态氮、总磷、叶绿素a等水质指标。pH和溶解氧水平采用哈希HQ40D便携式溶解氧/pH测定仪测定;硝态氮含量采用酚二磺酸分光光度法测定,氨氮含量测定采用纳氏试剂分光光度法测定,亚硝态氮含量采用N-(1-萘基)-乙二胺分光光度法测定,所用紫外分光光度计为UV-2802型。
氮、磷的去除率(R,%)按下式计算:
R=(ρ0-ρt)/ρ0×100%
式中,ρ0和ρt分别为初始氮磷质量浓度(mg/L)和培养td后的质量浓度(mg/L)。
1.4 微藻和大型溞生长监测
藻密度通过取一定量的藻种在显微镜下用血球计数板计数,并按一定的稀释倍数逐级进行稀释,得到相应藻细胞密度,再将所得到的系列藻液用UV-2802分光光度计测定680 nm波长下藻类光密度值,得到藻密度—光密度值标准曲线。结果表明,藻细胞密度与藻光密度值具有很好的线性关系,r2均达到0.91以上,可较为准确测定藻密度,测定藻密度后并计算相对生长率(K)。大型溞采用肉眼计数法测定。
K=(lnNt-lnN0)/t×100%
式中,N0为培养初始藻细胞密度(个/mL),Nt为经过t时间后培养液中的藻细胞密度(个/mL),t为培养时间(d)。
1.5 数据统计分析
根据观察结果编制生命表,净生殖率(R0)、平均世代周期(T,d)、内禀增长率(rm)按下式计算:
∑T=∑xlxRx/∑lxRx
R0=∑lxRx
rm=lnR0/T
式中,x为日龄(d);lx为x龄的存活率(%);Rx为x龄的生殖率(%)。
结果以平均值±标准差表示,采用SPSS 18.0软件进行方差分析,其中P<0.05表示差异显著,采用Microsoft Excel 2010和Origin 9.0绘图。其中差异显著性与否用小写字母标注,字母相同表示差异不显著(P>0.05),字母不同则表示差异显著(P<0.05)。
2 结 果
2.1 不同组合系统微藻和大型溞的生长特征
不同组合系统中3种微藻的生长见图1。在20 d的培养期中,相对平均生长速率由高至低依次为:蛋白核小球藻>衣藻>隐藻。在培养的第8天时,除蛋白核小球藻+大型溞组合外,其他各组合系统的相对生长速率达到最高,显著大于其后各时间段(P<0.05),在第8天后,各处理组平均生长速率迅速下降,至培养结束时均小于10%。另外,加入大型溞组合的各微藻其相对生长速率在前8 d均大于未加入大型溞的组合,而第8天后则基本小于未加入大型溞的组合。而加入两种微藻的组合的相对生长速率基本上小于单一藻的处理组。

图1 不同处理组微藻在凡纳滨对虾养殖水中的生长性能Fig.1 Growth performance of different microalgae in water of Pacific white shrimp L.vannamei cultureC1.蛋白核小球藻;C2.蛋白核小球藻+大型溞;C3.衣藻;C4.衣藻+大型溞;C5.隐藻;C6.隐藻+大型溞;C7.蛋白核小球藻+衣藻;C8.蛋白核小球藻+衣藻+大型溞;C9.衣藻+隐藻;C10.衣藻+隐藻+大型溞;下同.C1.C.pyrenoidosa;C2.C.pyrenoidosa+D.magna;C3.Chlamydomonas sp.;C4.Chlamydomonas sp.+D.magna;C5.C.obovata;C6.C.obovata+D.magna;C7.C.pyrenoidosa+Chlamydomonas sp.;C8.C.pyrenoidosa + Chlamydomonas sp.+D.magna;C9.Chlamydomonas sp.+C.obovata;C10.Chlamydomonas sp.+ C.obovata+D.magna;et sequentia.
大型溞的生长特征见表2。各组大型溞的相对生长速率为蛋白核小球藻+大型溞>衣藻+大型溞>蛋白核小球藻+衣藻+大型溞>隐藻+衣藻+大型溞>隐藻+大型溞,平均世代周期依次为蛋白核小球藻+大型溞<蛋白核小球藻+衣藻+大型溞<衣藻+大型溞<隐藻+衣藻+大型溞<隐藻+大型溞,而内禀增长率则是小球藻+大型溞组合最大,达到0.152,其次为衣藻+大型溞,其值为0.144,最低值是隐藻+大型溞,仅为0.102。

表2 不同组合系统下大型溞的生活史特征参数Tab.2 Characteristic parameters of life cycle of water fleas D.magna in different combined systems
2.2 不同组合系统大型溞和微藻的摄食关系
试验前8 d,蛋白核小球藻、隐藻和衣藻细胞密度均低于各自添加了大型溞的处理组的细胞密度(图2),主要是前期大型溞繁殖数目较少,均小于28个(表3),对藻类的摄食能力有限,同时由于大型溞在试验水体中不断地游动或产生一些化合物,一定程度上减轻了藻类的沉积,促进了藻类的繁殖,而在第8天后藻类的快速增殖,导致细胞密度显著增加(P<0.05),以及藻—溞处理组由于大型溞的快速繁殖,增强了其摄食能力,导致藻细胞密度低于藻处理组。另外,同相对生长速率变化规律一致,单一藻处理组的细胞密度均高于混合藻处理组,说明在同一水体中不同藻之间存在竞争效应。

表3 藻—溞组合系统中大型溞个数统计Tab.3 The number of water fleas D.magna in the microalga-daphnia system
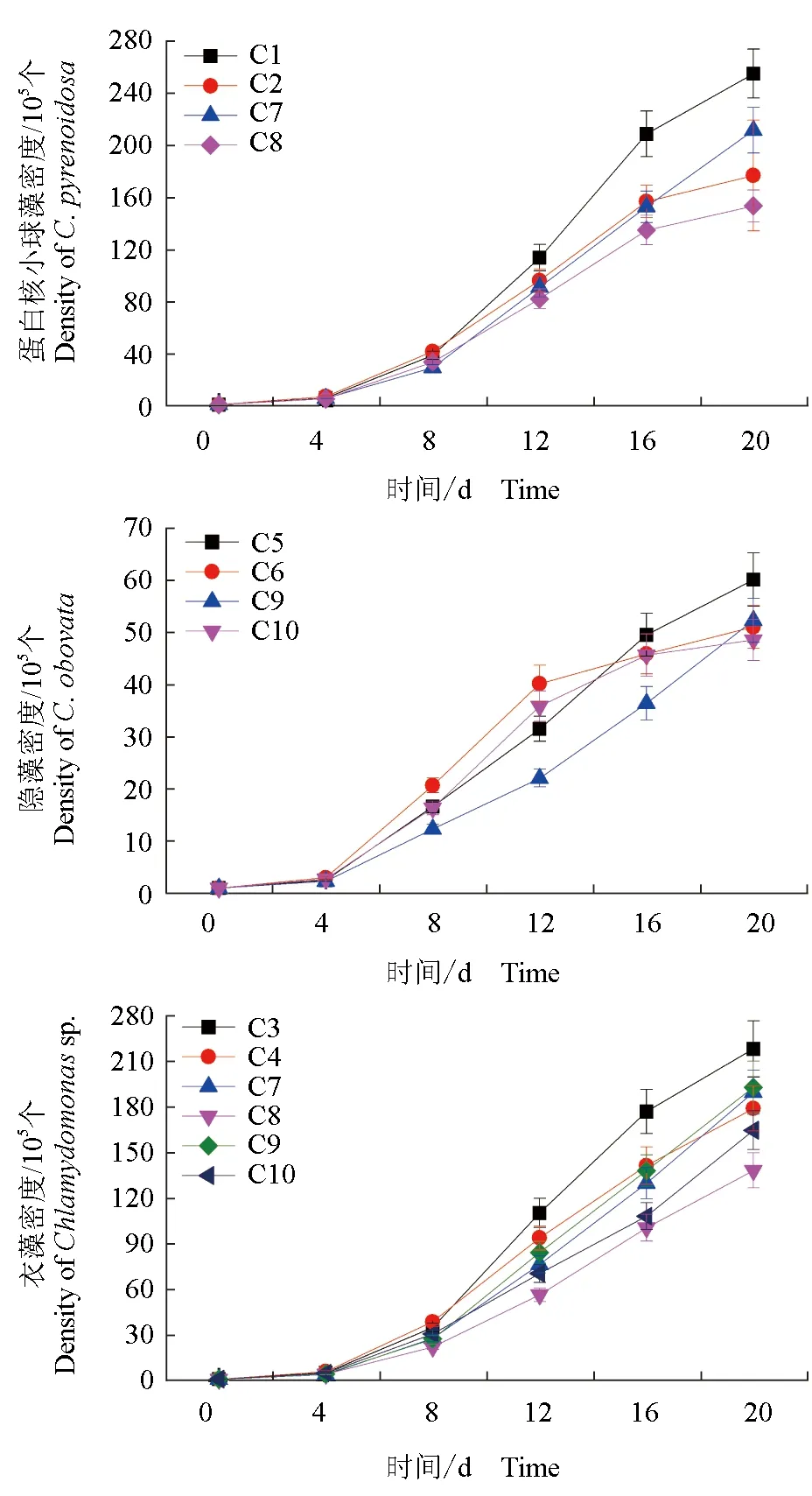
图2 各处理组中藻细胞密度变化特征Fig.2 The changes in microalga cell density in each treatment group
各处理组中,大型溞的数量存在一定差异,其中加入蛋白核小球藻组的大型溞数量最高,至试验结束时达到88个,其次是衣藻,至试验结束时达到80个,隐藻最差,至试验结束时仅有59个,说明大型溞更喜摄食小球藻,其次是衣藻。尤其是单一藻液培养的大型溞数量大于混合藻液,主要是由于混合藻液中小球藻和衣藻的细胞密度低于单一藻液,一定程度上影响了大型溞的繁殖。
2.3 不同组合系统养殖水体pH和溶解氧水平的变化情况


图3 不同微藻在凡纳滨对虾养殖水体中pH和溶解氧水平的变化情况Fig.3 The changes in pH and DO levels for different microalgae strains in water of Pacific white shrimp L.vannamei culture
试验期间,各组溶解氧水平显著增加,均达到过饱和状态,主要是由于藻类的快速繁殖,在光合作用下释放氧气,增加了养殖水体中溶解氧质量浓度,改善水环境。小球藻、小球藻+衣藻组增加最为明显,由初始6.01 mg/L分别快速增至24.12 mg/L和23.25 mg/L;其次为小球藻+大型溞组和小球藻+衣藻+大型溞组分别增至21.12 mg/L和20.54 mg/L;而隐藻和隐藻+大型溞组增加最为缓慢,试验结束时分别增至14.81 mg/L和14.63 mg/L,主要是隐藻增殖率最慢,藻细胞密度较低,光合作用相对较低。
2.4 不同组合系统养殖水体硝态氮、氨氮和亚硝氮含量的变化情况
各组对凡纳滨对虾养殖水体中硝态氮、氨氮和亚硝态氮的去除效果见图4。
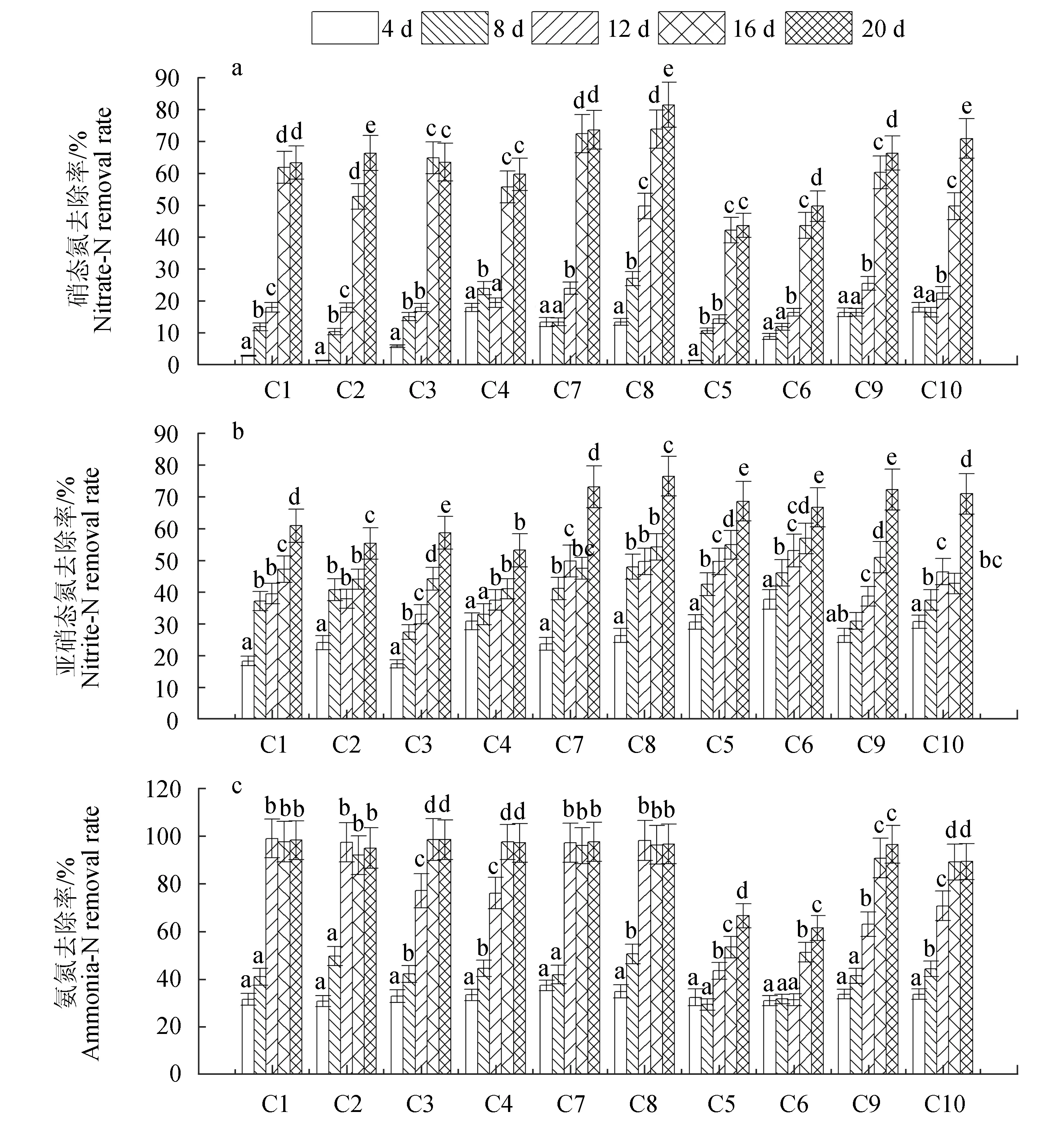
图4 不同处理组对养殖尾水硝态氮(a)、亚硝态氮(b)及氨氮(c)去除效果分析Fig.4 The removal rates of nitrate (a),nitrite(b) and ammonia(c) nitrogens in microalga-daphnia systems
各组亚硝态氮的去除效果不同,培养的第8天,硝态氮的去除效果仅达10%,至培养的第12天,去除率约达20%,培养第16天时则显著增加,至试验结束时,除隐藻和隐藻+大型溞组对硝态氮的平均去除率分别为44%和50%外,其他处理组均达到60%以上,其中混合藻对硝态氮的净化效果较好,小球藻+衣藻+大型溞、小球藻+衣藻、衣藻+隐藻+大型溞和衣藻+隐藻组分别为82%、74%、71%和67%;值得注意的是,加入大型溞的处理组比未加入的处理效果要好,说明藻—溞组合系统具有较好的硝态氮去除效果,尤其是小球藻+衣藻+大型溞组。
混合藻液对亚硝态氮去除效果优于单一藻处理组,而加入大型溞的去除率要低于未加入的对照组,但差异不显著,与硝态氮去除效果相反。培养前16 d,各处理组对亚硝态氮的去除率增加较为缓慢,而至试验结束时均显著增加(P<0.05),其中小球藻+衣藻+大型溞组、小球藻+衣藻组吸收净化效果最好,分别达到77%和73%,其次则为含有隐藻的处理组,顺序依次为隐藻+衣藻、隐藻+衣藻+大型溞、隐藻和隐藻+大型溞组,去除率分别为72%、71%、69%和67%;而小球藻+大型溞组和衣藻+大型溞组净化效果较差,分别为56%和53%。结果说明隐藻具有相对较好的亚硝态氮去除效果。
各处理组对氨氮的吸收效果差距较大,在培养的第8天,所有处理组的净化效果均不理想,其中小球藻+衣藻处理效果最好,为51%;至第12天,含有小球藻的组合系统几乎完全吸收氨氮,去除率显著增加(P<0.05),超过97%,其中小球藻+衣藻+大型溞组去除率为99%,其后基本保持不变,而含有衣藻的组合(衣藻、衣藻+大型溞、衣藻+隐藻和衣藻+隐藻+大型溞)去除率为63%~77%,至第16天时,则去除率快速增至89%以上,而隐藻和隐藻+大型溞组的去除效果最差,至试验结束时仅达到67%和62%,显著低于其他处理组(P<0.05)。说明加入适量大型溞并未显著影响藻类对养殖水体氨氮的净化。
3 讨 论
3.1 不同组合系统对微藻生长性能的影响
同一养殖环境下,不同微藻生长特征存在较大差异,主要是由于不同微藻所需的最佳生长温度、光照、营养盐等环境因素不同引起的[11,17-18],如硅藻适宜较低水温(14~18 ℃)和氮磷比10∶1,绿藻则适宜相对较高温度(20~25 ℃)和氮磷比16∶1[19]。本试验中,培养温度为25 ℃和氮磷比为18∶1,较适宜绿藻的生长繁殖,因此,蛋白核小球藻和衣藻具有相对较高的生长速率。不同微藻共培养时,两者的藻细胞密度均低于单一藻处理组,但总细胞密度要高于单一藻,主要是由于在有限的资源条件下,两种微藻对营养盐及空间等存在竞争作用,这已被众多研究者证实[20]。而藻—溞共培养时,培养初期大型溞密度较低,低密度的藻类增殖较快,而试验后期由于大型溞摄食作用,高密度的藻类存在较高的牧食压力,有效避免了“倒藻”的发生。主要是由于试验初期大型溞的扰动作用一定程度上促进了藻类的繁殖,提高了氮的去除率,而当藻类大量繁殖时,大型溞这种促进作用逐渐减弱。这与杨洋等[21]发现的大型溞加入密度较小的藻液中,浮游植物的密度没有下降反而上升结果一致;张曼等[22]学者亦提出随着藻密度增加,大型溞繁殖率加快,其抑藻净水的效果在后期更显著。因此,在实际生产中,在对虾养殖水体中接种浓缩蛋白核小球藻的同时,应及时接种大型溞,以预防小球藻的过度繁殖,维持养殖水体水环境的稳定性,提高对虾产量。
3.2 不同组合系统对大型溞生长特征的影响
藻—溞之间的影响是相互的,同样大型溞对藻类的摄食具有选择性,不同藻类因其适口性、形状、藻粒径大小和营养成分等因素均可显著影响大型溞的生长繁殖[23]。蛋白核小球藻是单胞藻,呈球形或近球形,其粒径为3~8 μm,细胞壁较薄且具有高蛋白特点,营养价值较高,非常适合大型溞的滤食,是大型溞的优良适口饵料;衣藻是单胞藻,其粒径约5~16 μm,细胞壁较厚,其蛋白含量低于小球藻;而隐藻粒径一般大于20 μm,不利于大型溞的摄食,这与本试验结果蛋白核小球藻+大型溞组具有最高生长速率,其次是衣藻+大型溞及隐藻+大型溞组生长最差的结果较一致。鉴于此,可定期接种蛋白核小球藻以促进大型溞的生长繁殖,提高池塘生态系统的生物多样性,保持养殖环境的长久稳定,同时为凡纳滨对虾提供天然生物饵料,增强免疫力,减少病害的发生。
另外,本试验中蛋白核小球藻+衣藻+大型溞处理组中大型溞并未比衣藻+大型溞、蛋白核小球藻+大型溞处理组的生长繁殖快,说明单一藻比混合藻更适合大型溞的生长繁殖。这可能是由于混合藻液中藻细胞密度过大,细胞出现聚集现象,一定程度上影响了大型溞的运动及滤食能力。史文等[13]也发现,梅尼小环藻(Cyclotellameneghinana)和斜生栅藻在密度较高时均会出现团聚现象,显著影响大型溞的生长繁殖。
3.3 不同组合系统对养殖水体水环境的影响
单一藻液净化效果比较中,小球藻对养殖水体可溶性氮的吸收效果最好,其次是衣藻,隐藻最差,这与其相对生长速率相一致,即藻类繁殖越快,吸收利用营养物质就越多;也说明该凡纳滨对虾养殖水体比较适合绿藻的生长繁殖,这与许多研究结果较一致[7,24]。加入大型溞的处理组比未加入的处理组具有较好的硝态氮去除效果,尤其是小球藻+衣藻+大型溞组,主要是由于试验初期大型溞的扰动促进了藻类的繁殖,提高了对硝态氮的利用率,随着大型溞繁殖数量的增多,对藻类摄食压力增加,有效控制藻类过度繁殖而衰亡,避免营养物质重新释放到水体中。
不同藻类对养殖水体不同形态氮的利用不同。培养前4 d,所有组合系统优先吸收利用氨氮,至12 d后氨氮几乎被完全吸收,然后才开始大量吸收硝态氮,最后才开始利用亚硝态氮,这与前期试验发现优先利用硝态氮结果不一致[4],这可能主要是由于本次养殖水体中氨氮初始质量浓度(1.5 mg/L)在藻类吸收利用的理想范围内,藻类可以直接以氨氮作为合成氨基酸的底物,而硝态氮和亚硝态氮则要通过一系列酶先还原成亚硝态氮再还原成氨氮方能被利用。
本试验结果表明,隐藻去除亚硝态氮的效果较好,对氨氮和硝态氮的去除效果较差,而小球藻和衣藻对3种形态的氮均具有较好的去除效果,这与众多研究结果一致。如陈春云等[25]发现,蛋白核小球藻对养殖尾水的氨氮去除率达80%以上。尤其是小球藻+衣藻处理组,尽管由于竞争机制各自藻细胞密度低于单一藻液,但总藻细胞密度仍高于单一藻液,因此能够吸收利用更多的氮,主要是由于藻类利用光合作用不断吸收水体中的各种形态的氮,满足自身生长营养需求[5]。
4 结 论
(1)藻—溞组合系统具有较好的水质净化调控效果,且各微藻及大型溞均可正常生长,其中蛋白核小球藻最有利于大型溞的生长繁殖,至培养后期,大型溞的牧食压力能够阻止藻密度过密,从而能够长久维持有益藻相的稳定。
(2)在本试验研究条件下,接种蛋白核小球藻、衣藻以及大型溞最适于养殖水环境调控,维持藻相稳定。
