超声辅助离子液体分散液液微萃取/高效液相色谱法测定新型抗艾药ACC007
2021-03-25龚爱琴金党琴
龚爱琴,金党琴
(扬州工业职业技术学院 化学工程学院,江苏 扬州 225127)
艾滋病又名获得性免疫缺陷综合征,是由人免疫缺陷病毒感染导致的一种致死性较高的疾病。目前国际上治疗艾滋病的药物有6类30多种,分别为核苷类逆转录酶、非核苷类逆转录酶、蛋白酶、整合酶、融合酶和细胞内β趋化因子受体(CCR5)抑制剂[1]。ACC007属于第三代口服非核苷类逆转录酶抑制剂,中文名为3-{[3-乙基-2,6-二氧-5-(丙基-2-基)-1,2,3,6-四氢嘧啶-4-基]羰基}-5-甲基苯腈。作为一类抗艾滋病新药,ACC007具有优良的抗病毒活性和安全性,在2017年获得国家“十三五”重大新药创制科技重大专项[2]。 药品质量直接关系到用药者健康和生命安全,药物从研发到临床必须进行质量监控,包括对药物制剂进行质量检验及对生物体液中的药物浓度进行监测,最常见的是对血清中药物浓度进行监测以了解药动学特征[3]。目前关于ACC007含量的测定方法报道很少。黄洁琼[4]采用液相色谱-串联质谱(LC-MS/MS)法测定复方制剂和比格犬血浆中的ACC007,但液质联用仪价格较高,一般实验室难以普及。当分析基体比较复杂、物质含量较低的样品时,常需结合使用分离富集技术。近年来分离富集技术向着简单化、微型化、有机试剂消耗最小化方向发展,其中液相微萃取技术显示了较高的样品萃取能力和良好的富集效果[5-7]。疏水性离子液体具有在水中溶解度小、挥发性低、毒性低、环境友好等特点,逐渐取代传统的有机溶剂而作为萃取剂使用。当使用离子液体作为萃取剂时,由于离子液体黏度较大,常需使用分散剂(甲醇[8]、乙腈[9]、丙酮[10-11]等)以改善离子液体在样品溶液中的分散效果,提高萃取率,但会增大有机试剂消耗量。而使用超声对溶液进行萃取时,溶液中会形成亚微米尺寸的液滴,增大互不相溶的两相间接触面,加速物质转移,甚至无需分散剂也可获得很高的萃取率,从而减少有机溶剂的使用[12-13]。
本文首次采用超声辅助离子液体分散液液微萃取/高效液相色谱(HPLC)法测定人血清及药片中的ACC007。实验结果表明,在超声的作用下无需分散剂即可获得较高的萃取率(>94.0%)。该方法减少了有机溶剂的使用,简单、环保,可为ACC007的药动学和药物研究提供参考。
1 实验部分
1.1 仪器与试剂
Ultimate 3000高效液相色谱仪(美国戴安公司),配紫外检测器;KQ3200超声波清洗器(江苏昆山超声仪器有限公司);L2-4K台式低速离心机(湖南可成仪器设备有限公司);FE28 pH计(瑞士梅特勒-托利多)。
ACC007标准物质(含量99.7%)与药片(标示量75.0 mg/片)均由江苏艾迪制药有限公司提供。
离子液体1-辛基-3-甲基咪唑六氟磷酸盐[C8mimPF6]、1-己基-3-甲基咪唑六氟磷酸盐[C6mimPF6]、1-丁基-3-甲基咪唑六氟磷酸盐[C4mimPF6]购于上海笛柏生物科技有限公司。乙醇、甲醇、冰乙酸、乙酸钠购于国药集团化学试剂有限公司,甲醇为色谱纯,其他均为分析纯。实验用水为高纯水。
1.2 溶液配制
0.10 mg/mL ACC007标准溶液:称取0.10 g ACC007标准物质置于烧杯中,用适量乙醇溶解后,转入容量瓶中并用乙醇定容至100 mL,质量浓度为1.0 mg/mL,置于暗处保存。使用前取适量用乙醇稀释至0.10 mg/mL。
pH 4.5的缓冲溶液:称取5.0 g三水合乙酸钠,用水溶解后,加入6.3 mL冰乙酸,用水稀释至500 mL,于酸度计上调至pH 4.5。
1.3 实验方法
1.3.1 样品制备ACC007药片:取5片准确称重,研磨均匀,精密称取约1片质量的药品粉末,用乙醇溶解定容至100 mL,过0.45 μm滤膜,取0.1 mL续滤液萃取测定。
血清样品:取健康志愿者的血清1.0 mL,加入1.0 mL 1.0 mg/mL的ACC007标准溶液和8.0 mL乙腈,以1 200 r/min离心15 min[14],取0.5 mL上清液萃取分析。
1.3.2 萃取过程在10 mL离心管中,依次加入适量的ACC007标准溶液或样品溶液、2.0 mL缓冲溶液、80 μL 离子液体[C8mimPF6],用水稀释至刻度线,摇匀。超声10 min后取出,于5 ℃冷却15 min,以2 500 r/min 离心5 min,溶液分层,下层即为离子液体萃取相。将萃取相用乙醇稀释至1.0 mL,待测。
1.3.3 HPLC法测定色谱柱:Dionex C18(4.60 mm×250 mm,5 μm);流动相为甲醇∶水(90∶10),流速为1.0 mL/min;检测波长为260 nm;柱温为25 ℃;进样量为10 μL。

图1 未萃取药物(a)、萃取试剂空白(b)与萃取后药物(c)的吸收曲线

图2 离子液体种类对ACC007萃取率的影响
2 结果与讨论
2.1 检测波长的选择
实验分别测定了未萃取药物、萃取试剂空白、萃取后药物在200~350 nm的吸收曲线,结果见图1。由图可知:药物有2个吸收峰(图1a);萃取试剂空白在药物第2个吸收峰处(260 nm)无吸收(图1b);药物经萃取后第1个吸收峰消失(图1c),这可能是以萃取试剂空白作参比,而空白产生的吸收比样品强所致。由于萃取试剂空白在第2个吸收峰无吸收,对测定无干扰,实验选择检测波长为260 nm。
2.2 萃取条件的优化
2.2.1 萃取剂的选择离子液体的水溶性、粘度、萃取能力等会影响萃取率,当离子液体阴离子部分固定不变时,这些特性与离子液体的阳离子部分有关。[C4mimPF6]、[C6mimPF6]和[C8mimPF6]3种疏水性离子液体在水中的溶解度分别为18.8、7.5、2.0 μg/L[15],因此分别考察了200 μL [C4mimPF6]、150 μL [C6mimPF6]、60 μL [C8mimPF6]在不使用分散剂的情况下对ACC007萃取率的影响(图2)。萃取率计算如下:萃取率=CexVex×100%/(C0V0),式中Cex、C0分别为萃取相和萃取溶液中ACC007的质量浓度(μg/mL),Vex、V0分别为萃取相和萃取溶液的体积(mL)。由图2可知,少量的[C8mimPF6]即可达到较高的萃取效果,故后续研究采用[C8mimPF6]作为萃取剂。
实验同时考察了[C8mimPF6]用量的影响,结果发现ACC007的萃取率随着离子液体用量的增加而增大,[C8mimPF6]用量为70 μL时达到最大萃取率(94.7%),之后萃取率随离子液体用量的增加基本不变。为便于操作,最终选择离子液体[C8mimPF6]的用量为80 μL。
2.2.2 溶液pH值的选择考察了溶液pH值在3.0~6.0范围内对ACC007萃取率的影响,结果显示,当溶液pH为4.5时萃取率达到最大值(95.0%),此后萃取率随着pH值的增大而降低。可能是因为ACC007发生了酮式和烯醇式结构的转变,其在水中的溶解度随着pH值增加而增大,导致萃取率下降。实验中控制萃取溶液pH值为4.5。
2.2.3 萃取时间的选择超声辅助离子液体分散液液微萃取是一种平衡萃取,超声波有利于疏水性离子液体形成微小液滴分散于水相中,从而加速萃取物的转移。固定超声频率为40 kHz,实验考察了超声时间(2、5、7、10、15、20 min)对萃取率的影响,结果表明ACC007的萃取率随着超声时间的增加而增大,当超声时间为10 min时萃取率达到最大值(95.4%),之后随超声时间的增加萃取率基本不变。实验选择超声时间为10 min。
2.2.4 冷却时间与离心时间的选择超声时溶液温度升高会增大离子液体的溶解度,冷却可降低其在水中的溶解度而有利于相分离。在5 ℃冷却温度下,实验考察了冷却时间对ACC007萃取率的影响,发现冷却时间超过10 min时即可相分离完全,ACC007的萃取率在94.0%以上。为保证分相完全,实验选择冷却时间为15 min。
冷却后立即离心,在转速2 500 r/min条件下,考察了离心时间对ACC007萃取率的影响,发现离心时间为5 min时即可相分离完全,因此实验选择离心时间为5 min。
2.2.5 离子强度的选择通过加入不同量的1 mol/L NaCl考察了离子强度对萃取率的影响,结果发现在10 mL萃取体系中,当NaCl的加入量超过0.9 mL(离子强度约为0.09 mol/L)时ACC007的萃取率会明显下降。实验使用的缓冲溶液浓度为0.2 mol/L,计算得离子强度为0.04 mol/L,可满足离子强度的要求。
2.2.6 溶液体积的选择考察了溶液体积对ACC007萃取率的影响,发现溶液体积超过15 mL后萃取率下降明显,原因可能是溶液体积增大使得离子液体在水中的溶解量增大,萃取能力降低所致。本研究控制溶液体积为10 mL,萃取后为降低离子液体黏度的影响,将萃取相用乙醇稀释至1.0 mL后测定。

图3 经萃取后ACC007的色谱图
2.3 分析应用
2.3.1 专属性实验图3显示了空白药片(曲线1)、空白血清(曲线2)、ACC007标准溶液(曲线3)、ACC007药片(曲线4)、加标血清(曲线5)经萃取后的色谱图。由图可知,ACC007的出峰时间为3.6 min,空白药片与空白血清在该处均无色谱峰,表明空白药片和空白血清中共存组分对测定无干扰。
2.3.2 线性关系与检出限通过student's检验法比较工作曲线与标准曲线的斜率,考察了样品基体对测定的影响。标准曲线通过萃取和分析ACC007标准溶液而得,工作曲线则通过萃取和分析加标空白药片和血清而得。在优化条件下,以峰面积对ACC007的质量浓度绘制曲线。结果表明,在P<0.05时标准曲线斜率与工作曲线斜率无明显差异,因此实际样品分析时均采用标准曲线法。由表1 可知,ACC007的线性范围为0.20~10.0 μg/mL,在空白药片和血清中的检出限(S/N=3)分别为0.062、0.068 μg/mL。
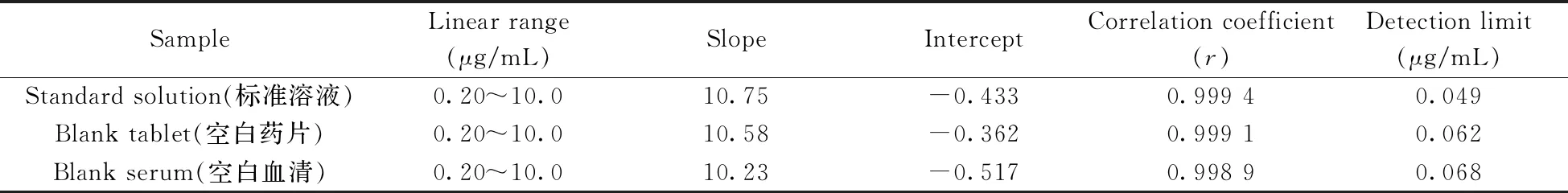
表1 不同样品中ACC007的线性参数及检出限
2.3.3 重现性分别配制质量浓度为2.0、5.0、10.0 μg/mL的样品溶液,按照本方法萃取后测定峰面积,每个浓度平行测定6次,ACC007峰面积的相对标准偏差(RSD)为2.8%~4.3%,表明方法的重现性较好。
2.3.4 样品测定与回收率采用本方法测定了药片与血清中ACC007的质量浓度(见表2),将测定结果换算成原始量为:73.8 mg/片(药片),98.6 μg/mL(血清)。而ACC007药片的标示量为75.0 mg/片,加标血清中ACC007的质量浓度为100.0 μg/mL。结果显示,测定值与标示值无显著性差异。
在2.0、5.0、10.0 μg/mL加标水平下,对上述药片和血清样品进行加标回收实验,ACC007的回收率为90.5%~103%,RSD为2.9%~5.1%(见表2),表明方法的准确性和重复性较好,可以满足样品的测定要求。

表2 样品测定及回收率实验结果(n=3)
3 结 论
本文建立了超声辅助离子液体分散液液微萃取/HPLC测定血清和药片中ACC007含量的分析方法。该方法无需使用分散剂,萃取率可达94.0%以上,减少了有机溶剂的使用和环境污染,降低了实验成本;超声作用提高了萃取效率。准确度、精密度、线性范围、检出限等实验结果表明,该方法可用于血清和药物的分析,为ACC007的药动学和药物研究提供了分析技术支持。
