基于金粒子修饰二硫化钼纳米复合材料的电化学发光免疫传感器的构建及其应用研究
2021-03-25孙莹莹吴晓惠
孙莹莹,吴晓惠
(辽宁中医药大学 医学检验学院,辽宁 沈阳 110847)
前列腺癌作为一种严重的泌尿系统癌症之一,是最常见的男性恶性肿瘤,对男性的健康状况危害极大。自从1980年Papsidero课题组[1]首次阐明了前列腺特异性抗原(Prostate specific antigen,PSA)与前列腺癌的相关性,PSA就作为检测前列腺病症的最佳标记物,长期用于男性前列腺癌的早期诊断。目前临床上常用于PSA检测的方法有酶联免疫吸附测定法(ELISA)、色谱法和放射性免疫分析(RIA)法等[2-3]。然而,这些方法不仅操作复杂,还存在辐射伤害和环境污染等问题。因此,构建一种快速、灵敏、准确且无污染的分析方法用于检测病人体内的PSA成为人们努力的方向。
电化学发光(Electrochemiluminescence,ECL)是化学发光与电化学相结合的产物[4-6]。这种分析方法具有背景信号低、灵敏度高、自动化程度高、无污染等优点,被广泛应用于生物分析、医药检测、环境和食品检测等领域[7-9]。电化学发光免疫分析是将电化学发光检测和免疫分析相结合的免疫标记分析技术,通过利用电化学发光试剂来标记抗原或抗体后,进行相应的免疫反应和理化步骤,记录反应前后电化学发光信号的差值,并对待测物的浓度进行分析。这种方法不仅具有免疫分析技术的高特异性,而且具有电化学发光技术的高灵敏度、低背景、无辐射污染等特点,被广泛用于检测与各种疾病相关的蛋白质及核酸[10-11]。然而,在实际临床检测中,目标待测物的浓度往往很低,甚至达到痕量级别,为了提高传感器的灵敏度,引入信号放大技术是实现痕量物质定量检测的重要手段[12]。
信号放大技术是一种增强信号强度的技术。对于电化学发光检测,一般从两个方面实现信号放大:①单位空间内增加信号标签的数量;②在电化学发光过程中提高单个信号标签的发光效率。纳米材料因其具有较大的比表面积、良好的电子传递能力以及优秀的生物相容性,常作为一种信号放大的手段用于提高传感器的灵敏度。如韩静等[13]利用QDs-PAMAM-Pd/Au 纳米材料作为生物探针,以GNRs/GO 作为基底构建了电化学发光免疫传感器检测苏丹红I号。因GNRs/GO具有超大的比表面积,可增加包被抗原的负载量,从而有效地放大ECL信号;Wang等[14]制备了一种基于鲁米诺发光体系的非标记型电化学发光生物传感器检测大肠杆菌。利用AgBr负载的N掺杂的3D石墨烯对鲁米诺发光体系进行催化,增加了鲁米诺发光效率,最后达到信号放大效果。该方法对大肠杆菌的检测范围为0.5~500 cfu/mL,检出限为0.17 cfu/mL。
二硫化钼(MoS2)是一种性能优异的过渡金属二硫化物,由于其具有较大的比表面积、较高的催化活性和良好的光学性能,在能量转换、储存、催化、传感等领域得到了广泛的应用[15-17]。然而,MoS2作为一种典型的半导体,其导电能力不够理想,且水溶性较差,因此MoS2的改性和功能化对其在电化学领域的应用十分重要。已有文献表明,将碳纳米材料掺杂在MoS2结构中,可有效提高复合材料的导电能力和水溶性。因此,本课题组利用石墨烯和碳纳米管作为支撑骨架,采用水热法制备出具有三维花状结构的MoS2/GO/o-MWNTs 纳米复合材料,并采用原位还原法将金纳米粒子修饰在其花瓣状结构上。所得Au@(MoS2/GO/o-MWNTs)纳米复合材料(AMGMs)不仅克服了单一MoS2导电性差、易聚集的缺点,其生物相容性也有所提高[18]。
本文利用已合成的AMGMs 纳米复合材料作为固定化基底,结合“三明治”免疫夹心组装法构筑高灵敏的电化学发光免疫传感器,实现了血清中PSA的高灵敏检测。首先,以三维花状的AMGMs作为传感基底可提高抗体的负载量。其次,该纳米复合膜优良的导电性和生物相容性能够加速反应中电子传递的速率,同时最大程度地保持抗体活性,从而提高检测效率,实现信号放大。在优化实验条件下,电化学发光免疫传感器的ECL响应与PSA浓度的对数值呈正比,线性范围为0.1 pg/mL~50 ng/mL,检出限(S/N=3)为0.1 pg/mL。将该传感器应用于人血清样品中PSA的检测,所得抗原的加标回收率为98.2%~106%,说明该方法的准确性良好,具有极好的临床应用前景。
1 实验部分
1.1 仪器与试剂
场发射扫描电子显微镜(FESEM)图像在SHIMADZU SSX-550上测定。透射电子显微镜(TEM)图像在Hitachi H-7650上测定。电化学发光实验在MPI-E型电化学发光检测仪(西安瑞迈)上进行,光电倍增管高压为800 V,放大级数为3。电化学实验在CHI 660B电化学工作站(上海辰华)上进行。三电极系统:以修饰的玻碳电极(3 mm直径)为工作电极 ,铂丝为对电极,饱和甘汞电极(SCE)为参比电极。采用循环伏安法和电化学交流阻抗法研究传感器的组装过程,采用电化学发光法定量研究该传感器对PSA的响应信号。循环伏安实验在含1 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)的PBS溶液中进行。电化学交流阻抗实验以5 mmol/L的K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)为探针,在电位Eo=0.17 V下进行,频率范围为0.1~100 000 Hz,交流电压振幅为10 mV。
Anti-PSA Ab1(PSA抗体1)、生物素修饰的Anti-PSA Ab2-B(PSA抗体2)、PSA抗原、牛血清蛋白(BSA)购于上海生工生物工程公司;链霉亲和素(SA)和三丙胺(TPrA)购于美国Sigma公司;三联吡啶钌复合物(Ru complex,苏州Suna科技有限公司);多壁碳纳米管(MWNTs,纯度大于95%,深圳纳米港有限公司),氧化石墨烯(GO,南京吉仓纳米科技有限公司),钼酸钠(Na2MoO4·2H2O)、硫脲、氯金酸( HAuCl4)购自国药集团化学试剂有限公司;实验所用的人体血清由沈阳医学院附属中心医院提供。所有试剂均为分析纯且使用时未进一步纯化。实验用水为高纯水(电阻系数≥18.2 MΩ·cm,Milli-Q,美国Millipore公司),所用PBS缓冲液均为pH 7.4,浓度为0.1 mol/L。
1.2 Au@(MoS2/GO/o-MWNTs)纳米复合材料的制备
Au@(MoS2/GO/o-MWNTs)纳米复合材料(AMGMs)的合成参照本课题组之前的工作[18]。首先,将MWNTs进行酸化处理,得到氧化多壁碳纳米管(o-MWNTs)。将一定量的o-MWNTs和氧化石墨烯(GO)超声溶解于水中,随后加入钼酸钠和硫脲的混合溶液,搅拌1 h。将该溶液转移至水热合成反应釜中,并在210 ℃的电烘箱中放置24 h,取出自然冷却至室温,进行离心洗涤、冻干备用。为使金纳米粒子修饰在MoS2/GO/o-MWNTs表面,称取一定量MoS2/GO/o-MWNTs,超声溶解于水中后,快速加入0.5 mmol/L HAuCl4溶液,震荡混匀,静置30 min后得到Au@(MoS2/GO/o-MWNTs)纳米复合物。
1.3 Ru complex修饰链霉亲和素(SA-Ru)的制备
SA-Ru的合成制备参照Deiss[19]的方法稍作修改:首先,将1 mg链霉亲和素(SA)溶解在1 mL水中,取该溶液100 μL加入810 μL水和90 μL PBS(pH 7.4)混合均匀,随后加入Ru complex的DMSO溶液100 μL(质量浓度为1 g/mL),4 ℃下连续搅拌4 h。最后,将混合物转移至透析袋中(截流分子量为10 000,透析液为PBS)透析16 h,每隔3 h换透析液。透析结束后,取出溶液,放入4 ℃冰箱中保存备用。
1.4 电化学发光免疫传感器的组装
电化学发光免疫传感器的组装过程如图1所示。在预先处理干净的玻碳电极(GCE)表面滴涂10.0 μL AMGMs纳米复合物,室温自然干燥,使其形成一层均匀致密的薄膜。随后将10 μL Ab1(12.0 μg/mL)滴加至电极表面,冰箱内孵育过夜后,用PBS洗涤,并用BSA封闭液孵育1 h。37 ℃下,将不同浓度的PSA底液滴至上述修饰电极表面,恒温孵育1 h以捕获大量PSA。再次洗涤后,将10 μL Ab2-B(10.0 μg/mL)滴至上述电极表面,37 ℃下孵育1 h,以结合形成夹心结构。最后,在上述电极表面滴加SA-Ru 溶液,37 ℃孵育30 min,利用生物素与亲和素之间的特异性亲和作用,将SA-Ru组装至电极表面。采用循环伏安法和电化学交流阻抗法研究传感器的组装过程,采用电化学发光法检测不同PSA浓度下传感器的发光信号,从而实现PSA的定量检测。

图1 用于检测 PSA的电化学发光免疫传感器构建示意图
2 结果与讨论
2.1 电化学发光免疫传感器的制备与表征
采用FESEM和TEM对合成的三维花状Au@(MoS2/GO/o-MWNTs)纳米复合材料(AMGMs)的形貌进行了表征(图2A、2B)。可观察到AMGMs呈现三维花瓣状的球型结构,粒径范围为0.8~1.0 μm,在其花瓣上均匀分布有粒径约为5~10 nm的金纳米粒子。上述实验现象均表明AMGMs纳米复合材料已成功制备。随后,将AMGMs作为纳米基底固载Ab1,利用三明治免疫反应将修饰生物素的二抗(Ab2-B)组装至电极表面,最后利用生物素与亲和素之间的特异性作用,将修饰Ru complex的亲和素(SA-Ru)固定在电极表面。
采用电化学循环伏安法(CV)和交流阻抗法(EIS)对上述电化学发光免疫传感器的组装过程进行跟踪表征。如图2 C所示,裸GCE(曲线a)的CV曲线呈现出一对可逆的氧化还原峰,其峰电位差为0.08 V,是单纯的Fe2+/Fe3+在电极上转移电子所产生;当在其表面修饰AMGMs纳米复合材料后(曲线 b),这对氧化还原峰电流减弱,峰电位差增加,这是因为AMGMs在电极表面形成了一层光滑致密的薄膜,致使电极界面处的电子转移受到阻碍。当进一步向电极表面修饰Ab1、BSA、PSA、Ab2-B、SA-Ru后,电极的氧化还原峰电流强度逐渐下降,峰电位差逐渐增加,直至氧化还原峰消失(曲线 c、d、e、f、g),这是由于Ab1、BSA、PSA、Ab2-B和SA-Ru等均为非导电的蛋白质大分子,这种蛋白的封闭作用导致电极界面电子传递被阻碍。实验表明传感器已成功组装。

图2 AMGMs的FESEM(A)及TEM(B)图,电化学发光免疫传感器组装过程的CV(C)及EIS(D)图
电化学交流阻抗谱(EIS)也常被用作表征电极界面情况的手段之一[20],其图谱中的高频区半圆直径值为电极表面电荷转移电阻的大小,常用Ret表示。图2D为传感器在不同组装过程中的电化学阻抗谱图。对于无任何修饰的GCE,图谱显示出近似直线的图形(曲线a),说明电极表面几乎无阻碍电子传递的物质。当AMGMs在电极表面形成薄膜时,EIS半圆增加,Ret增大,说明纳米复合材料所形成的薄膜阻碍了电子在电极表面的转移(曲线b)。当Ab1 和BSA 组装至电极后,由于蛋白的加入导致电阻逐步增大(曲线c、d),而当PSA被Ab1所捕获和加入Ab2-B形成三明治结构后,电阻进一步增大(曲线e、f);最后引入SA-Ru,使阻抗再次增大(曲线g)。综合CV和EIS的检测结果,可看出每一步电极的修饰过程均是有效的,各物质均成功地修饰到了电极表面。
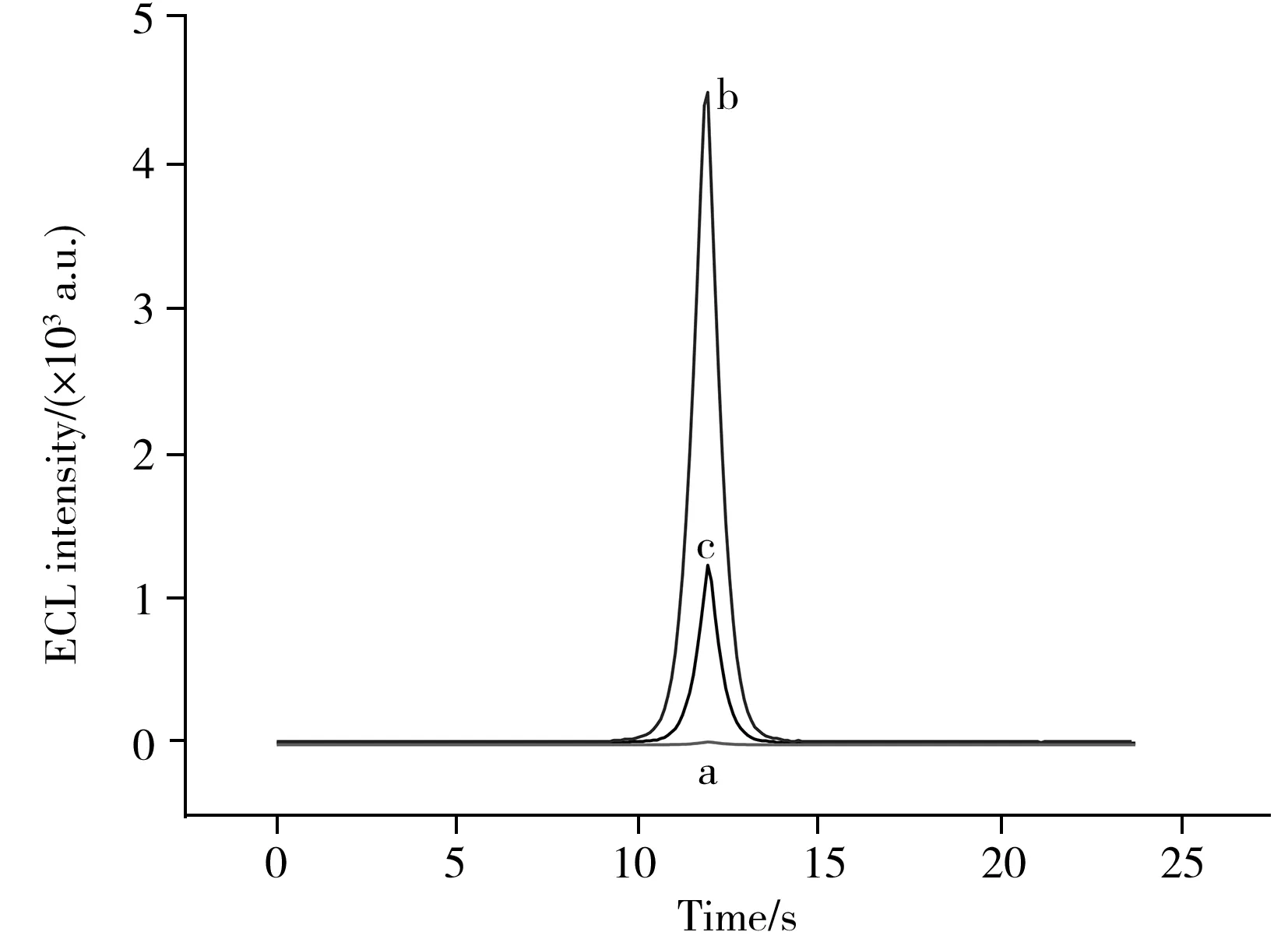
图3 SA-Ru/Ab2-B/BSA/Ab1/AMGMs/GCE(a),SA-Ru/Ab2-B/PSA/BSA/Ab1/AMGMs/GCE(b)及SA-Ru/Ab2-B/PSA/BSA/Ab1/GCE(c)在含有10 mmol/L TPrA 的PBS溶液中的ECL图
2.2 电化学发光免疫传感器的可行性分析
为了验证设计的电化学发光免疫传感器用于PSA检测的可行性,采用电化学发光法在PBS缓冲液中对传感器进行测定,结果如图3所示。当组装过程中未滴加PSA时,传感器未检出任何发光信号(曲线a),这是由于缺乏PSA时,三明治结构无法构建,从而导致Ab2-B和SA-Ru无法组装到电极表面,因此未检出Ru的发光信号。当组装过程中滴加了50 ng/mL PSA后,传感器检测到很强的ECL信号,且发光强度达4 483 a.u.(曲线c),这说明在PSA存在下,SA-Ru被成功地组装到电极表面,并产生强而稳定的电化学发光信号,充分证明通过检测电极上Ru的发光强度来确定PSA浓度是可行的。
为了证实AMGMs纳米复合材料在电化学发光免疫体系中的信号放大作用,本文进行了对比实验,结果如图3b所示。当将Ab1、BSA、PSA、Ab2-B和SA-Ru直接组装到裸玻碳电极上后,虽然可检出电化学发光信号,但信号非常弱,发光强度仅为1 280 a.u.,这说明以AMGMs作为固定化基底,不仅可增大电极的比表面积,使Ab1的负载量成倍增加,而且由于其优异的导电性和生物相容性,能够最大程度地保持抗体活性,增加电子转移速率,具有很强的信号放大作用。
2.3 实验条件的优化
为了有效地将所构建的电化学发光免疫传感器应用于PSA检测,本文对相关实验条件进行了优化。
抗体浓度是决定传感器性能的重要因素,因此,本实验分别对Ab1和Ab2-B的质量浓度进行优化。如图4A所示,ECL强度随着Ab1质量浓度的增加而增大,当Ab1质量浓度超过12.0 μg/mL 后,ECL强度达到最大,继续增大Ab1质量浓度,ECL则持续下降,这可能是由于电极表面区域限制了抗体的负载。此外,过饱和的负载量还会影响抗体的有效利用率,所以本实验选用质量浓度为12.0 μg/mL的Ab1进行后续实验。同理,抗体Ab2-B的质量浓度在5.0~10.0 μg/mL时,ECL呈上升趋势,且在10.0 μg/mL处,ECL出现最大点,之后开始下降。因此,本实验选择10.0 μg/mL作为Ab2-B的最佳浓度。
AMGMs在电极表面的滴涂量也是影响ECL免疫传感器性能的显著因素。图4B为AMGMs用量的优化曲线,可以看出当AMGMs体积从2.0 μL增加到10.0 μL时,ECL发光信号逐渐增加,当体积大于10.0 μL后,发光信号下降。这是由于AMGMs能够有效增加电极的比表面积,提高电子转移速率,但电极上过量的AMGMs会导致ECL背景信号的增加以及电子转移速率的降低。因此,实验最终选择10.0 μL AMGMs为最佳用量。
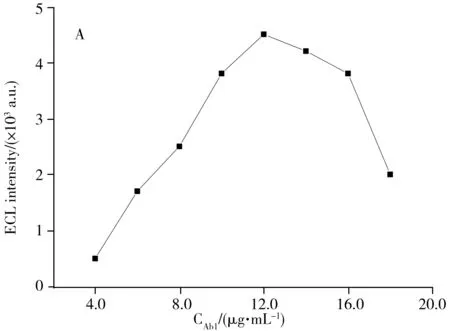
图4 实验条件的优化
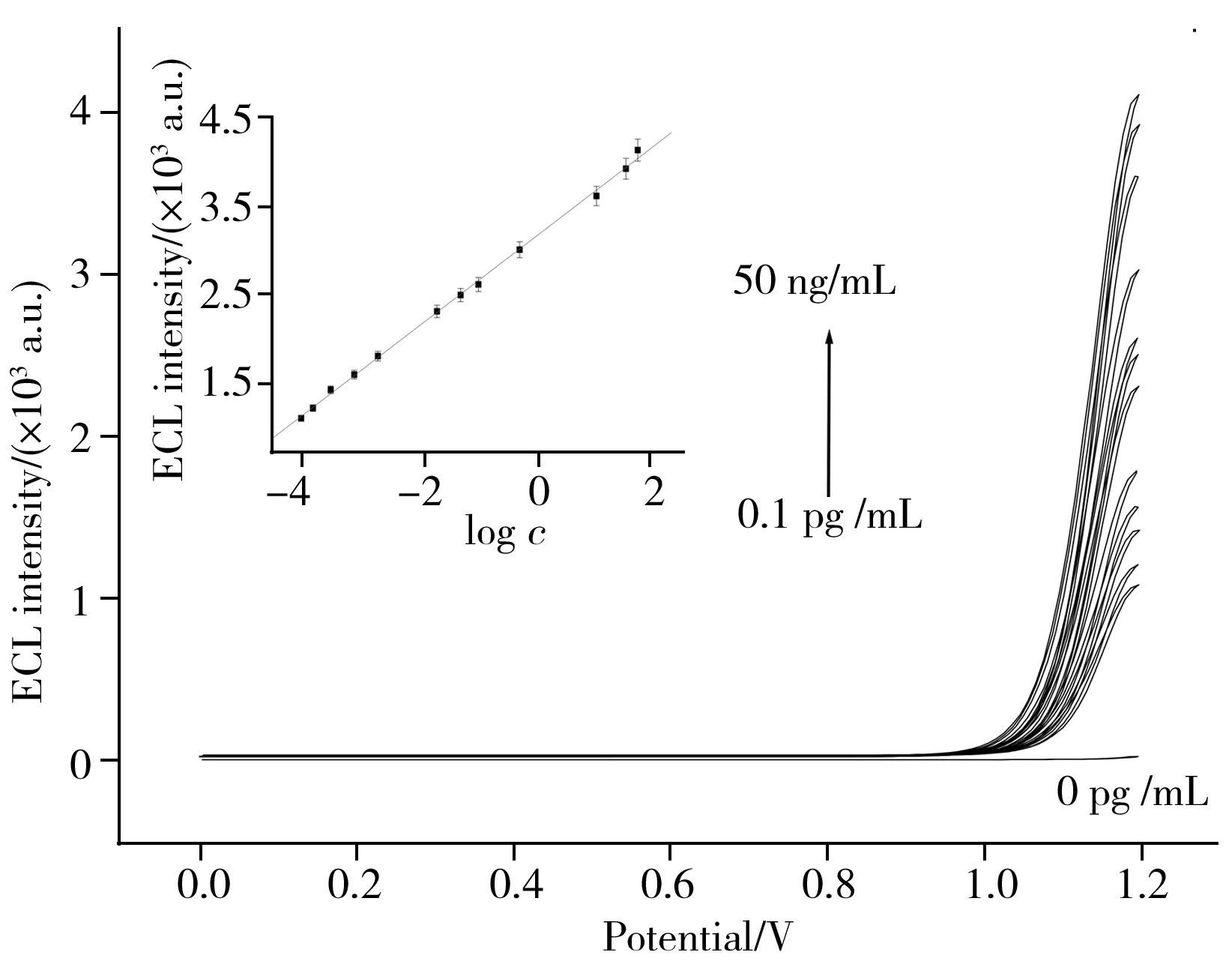
图5 不同质量浓度PSA的ECL响应曲线
2.4 电化学发光免疫传感器的性能分析
在上述优化条件下,利用所制备的电化学发光免疫传感器对不同质量浓度的PSA进行定量检测,结果如图5所示。随着PSA质量浓度的增大(从0.1 pg/mL 到50 ng/mL),ECL响应逐渐增大。在该质量浓度范围内,ECL的响应数值与logc呈良好的线性关系,线性拟合方程为IECL=507.63 logc+3 167.6,检出限(S/N=3)为0.1 pg/mL。上述结果表明,该电化学发光免疫传感器能够有效地实现PSA的灵敏检测。与国内外其它文献的报道结果相比,该法得到的检出限更低[21-23],在临床诊断与治疗中具有更大的实用性。
为了考察该免疫传感器对PSA的特异性,选取几种干扰因子如BSA、 EB病毒核抗原1(EBNA-1)和EB病毒衍生的潜伏膜蛋白1(LMP-1)对其进行干扰实验。在相同实验条件下,在检测体系中加入上述物质以考察传感器的抗干扰能力。实验发现,在上述干扰因子存在的情况下,检测结果几乎未改变,说明上述物质对PSA的干扰可忽略不计,表明该传感器具有较高的特异性。
为了考察该传感器的重现性,在相同条件下,对50 ng/mL的PSA进行连续多次检测。所测的批内和批间相对标准偏差(RSD)分别为3.2%和4.3%,显示该传感器具有良好的重现性。稳定性也是免疫传感器的一个重要指标。将制备好的传感器放置在PBS(pH 7.4)中,4 ℃保存,30 d后检测其 ECL信号。发现ECL强度仍可保留初始强度的90%,说明构建的传感器具备优异的稳定性。
2.5 实际样品的检测
为了检验该传感器在实际样品分析中的准确性与实用性,本实验采用制备好的传感器用于检测成年男性血清样本中的PSA浓度,并通过测定质量浓度分别为10、30、50 ng/mL PSA抗原的回收率来研究人血清样品中的PSA活性,每组至少检测3次。结果表明,PSA抗原的回收率为98.2%~106%,说明该方法对人血清样本中PSA抗原的检测具有良好的准确性,该方法具有较好的临床应用前景。
3 结 论
本文利用水热法和原位还原法合成出三维花状的Au@(MoS2/GO/o-MWNTs)纳米复合物(AMGMs),并将其作为一种理想的固定化基底,构筑了高灵敏的电化学发光免疫传感器,用于检测前列腺特异性抗原(PSA)。当底液中存在PSA时,修饰生物素的二抗(Ab2-B)可以通过三明治免疫反应组装到电极表面,随后,再利用生物素与亲和素之间的特异性作用,将修饰Ru complex的亲和素固定于电极上,通过测定Ru的电化学发光信号,定量检测底液中的PSA浓度。该传感体系不仅线性范围宽,检出限低,还具有结构简单、特异性好、无污染等优点。此外,通过改变特异性抗体,该体系可以扩展到检测其他疾病标志物,这意味着所构建的电化学发光免疫传感器在疾病的早期诊断和分析中将展现巨大的应用前景。
