原发性腹膜后平滑肌肉瘤临床病理分析
2021-03-25张竹青赵俊军
张竹青 赵俊军 李 平
大连医科大学附属中心医院病理科,辽宁省大连市 116033
原发性腹膜后肿瘤是起源于腹膜后间隙相对罕见的肿瘤,恶性肿瘤较良性肿瘤更为多见,约占全身恶性肿瘤的0.1%[1]。原发性腹膜后平滑肌肉瘤(Primary retroperitioneal leiomyosarcoma, PRLS)约占腹膜后软组织肿瘤的20%[2],因无特异性的临床表现和影像学特征,与发生于腹膜后的其他软组织肿瘤常难以鉴别,需依靠病理学检查才能明确诊断。本研究回顾性分析8例PRLS的临床病理特征并复习相关文献,以提高对该肿瘤的认识和诊治水平。
1 资料与方法
1.1 临床资料 收集2013年10月—2020年9月我院诊断为PRLS的8例患者的临床病理资料,其中男1例,女7例,年龄27~67岁,中位年龄51岁。
1.2 免疫组化染色方法 所用一抗CK(AE1/AE3)、Desmin、SMA、CD34、CD117、S100、DOG-1、HMB45及Ki-67试剂盒,均购自福州迈新生物技术开发有限公司。所有病例组织均经10%中性福尔马林固定、常规石蜡包埋、切片,行HE染色和免疫组化染色。免疫组化方法采用EnVision法于罗氏自动免疫组化检测仪进行。用已知的阳性切片作阳性对照,以PBS代替一抗作阴性对照。肿瘤细胞膜、细胞质或细胞核出现淡黄色或棕褐色颗粒判定为阳性细胞。
结果判定:CK(AE1/AE3)、Desmin、SMA和HMB45于细胞质出现淡黄色或棕褐色颗粒为阳性,CD34、CD117和DOG-1于细胞膜/细胞质出现淡黄色或棕褐色颗粒为阳性,S100于细胞核/细胞质出现淡黄色或棕褐色颗粒为阳性,Ki-67于细胞核出现淡黄色或棕褐色颗粒为阳性。所有病理切片均由2位高年资医师复阅,确认所有病例病理诊断准确无误,并进行随访了解患者生存情况。
2 结果
2.1 临床表现 2例患者表现为腹部疼痛不适,1例患者是无意发现腹部包块,5例患者为体检发现,其中1例伴下肢放射性疼痛。
2.2 病理检查 大体标本:8例肿瘤直径为2.5~15.0cm,中位数为8.7cm。肿瘤切面实性,灰白,少数灰黄伴有坏死,质地韧。镜检:8例肿瘤细胞形态均为梭形,细胞分化相对好或中等分化者呈平行束状排列,胞浆嗜伊红,细胞核居中,核两端雪茄样,细胞轻—中度异型,局部可见瘤巨细胞(图1a)。差分化的瘤细胞异型性和多形性明显,核大,深染,核分裂象易见,并可见病理性核分裂和多核瘤巨细胞,肿瘤细胞可向周围组织侵袭,其中1例可见肾被膜受累(图1b)。
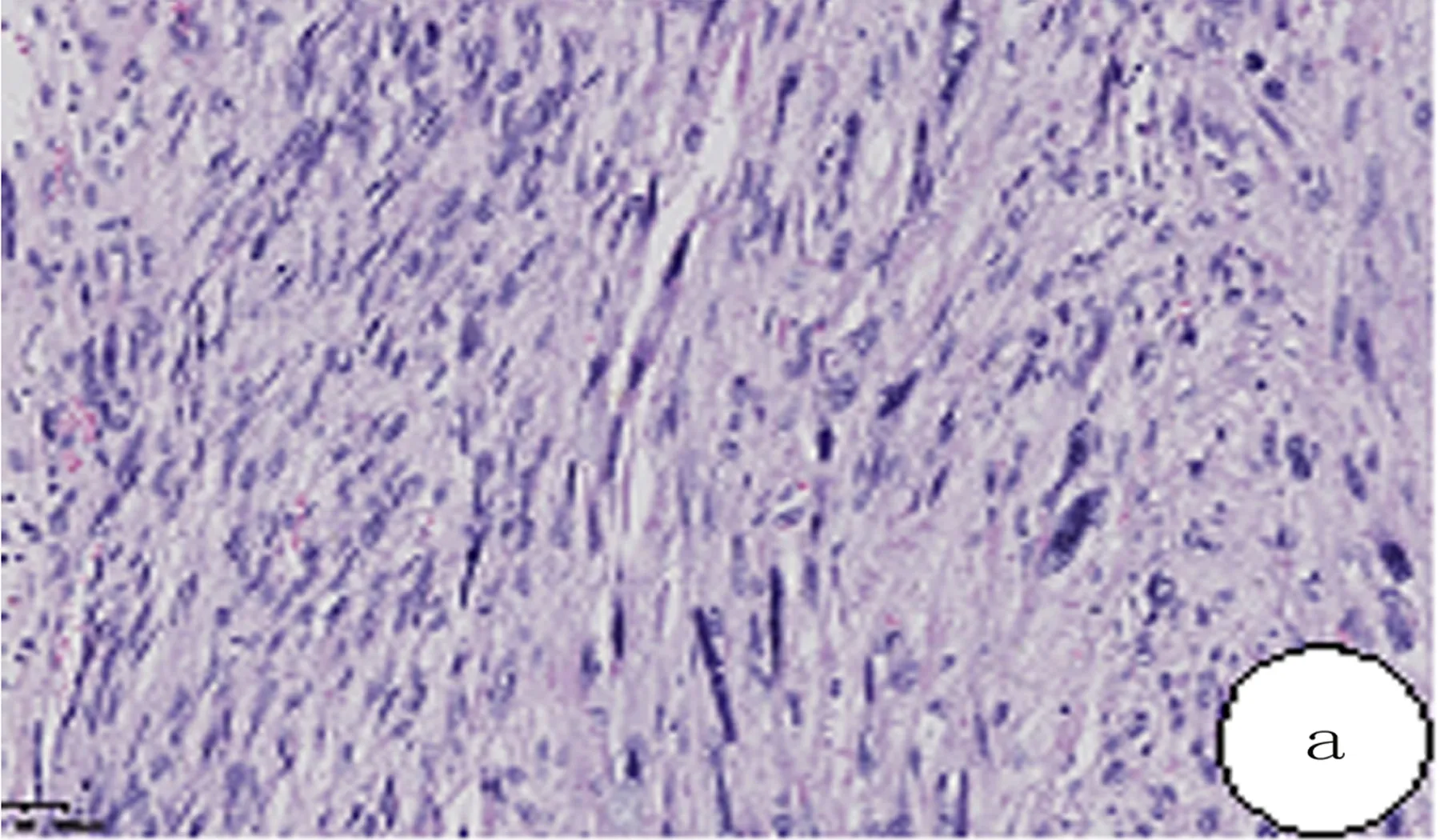

图1 腹膜后平滑肌肉瘤组织形态(HE)
免疫组化结果:Desim、SMA均为胞质阳性表达(8/8),DOG-1及S100表达均阴性(8/8),AE1/AE3表达阴性(7/8),CD34表达阴性(6/8),HMB45表达阴性(4/4),CD117灶阳(1/8)。见图2及表1。
2.3 治疗及随访 本组有7例经手术治疗,其中3例肿瘤完全切除,4例联合脏器切除:腹腔镜下肿瘤切除+右肾根治术1例,腹腔镜下肿瘤切除+左肾根治术2例,腹腔肿瘤切除及肝部分切除1例。4例术后复发转移:追加化疗+靶向治疗1例,化疗+放疗1例,单纯放疗1例。1例为穿刺标本,首诊即为肿瘤晚期伴全身多脏器转移,家属拒绝手术及放化疗等治疗。
电话随访时间截至2020年10月,本组7例获得术后随访,随访时间为3~48个月,中位随访时间为16个月,1例失访。其中2例术后复发、转移,复发时间7~8个月,分别于术后9个月、13个月因疾病进展死亡;1例为肿瘤晚期,全身多脏器转移,无手术适应证,拒绝放化疗,首诊3个月后死亡;1例伴肝、肺及腹腔转移,行腹腔肿瘤切除、肝部分切除及左肾静脉部分切除修补术,后规律化疗及靶向治疗,已随访48个月,疾病稳定;3例肿瘤完全切除,随访时间3~20个月,均无复发。见表2。
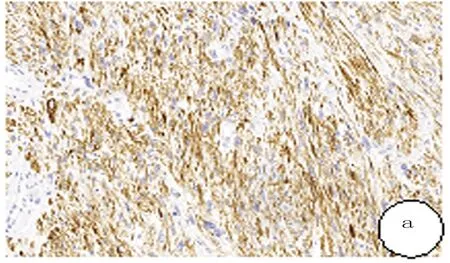
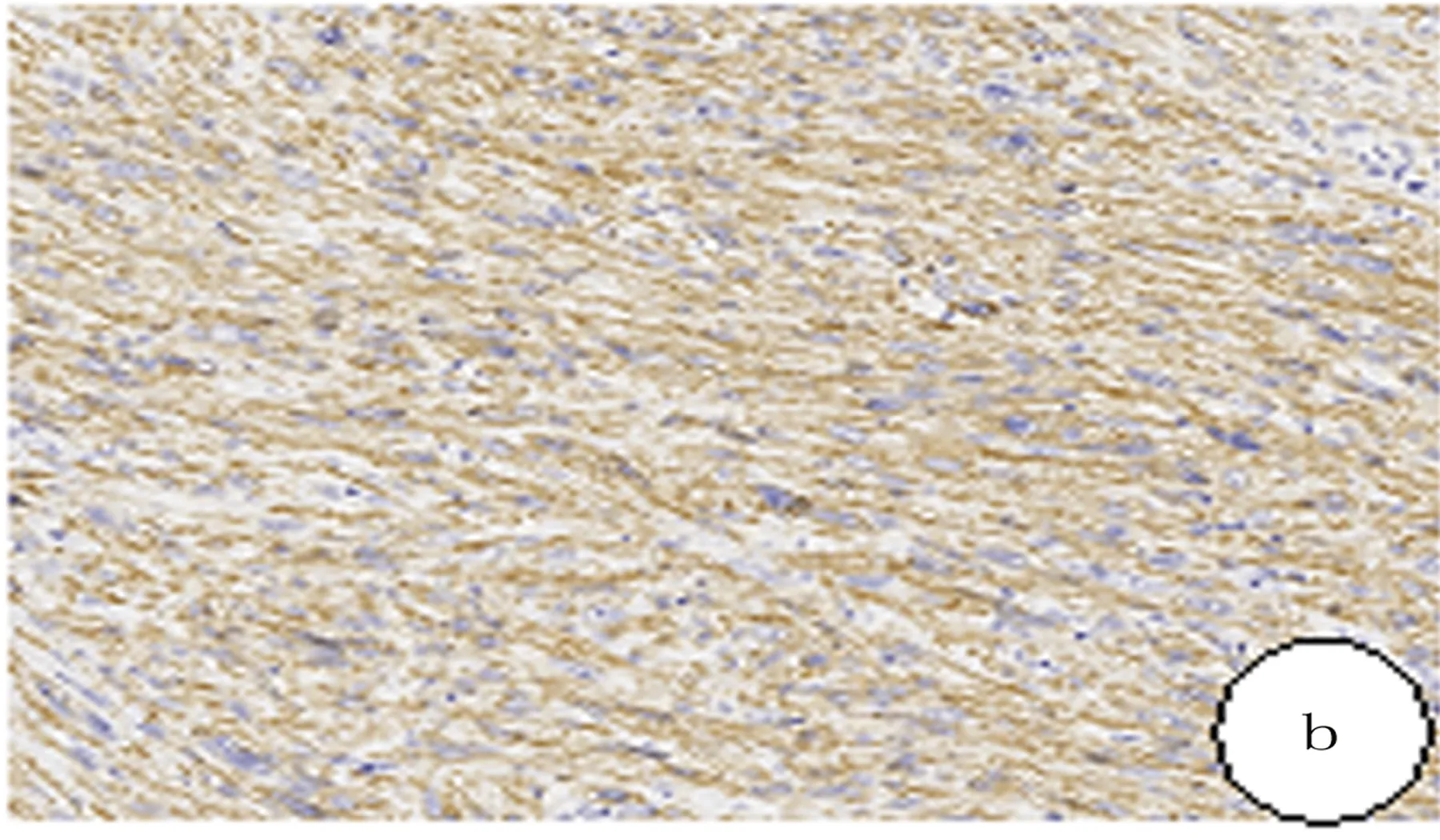
图2 腹膜后平滑肌肉瘤免疫组化检查结果
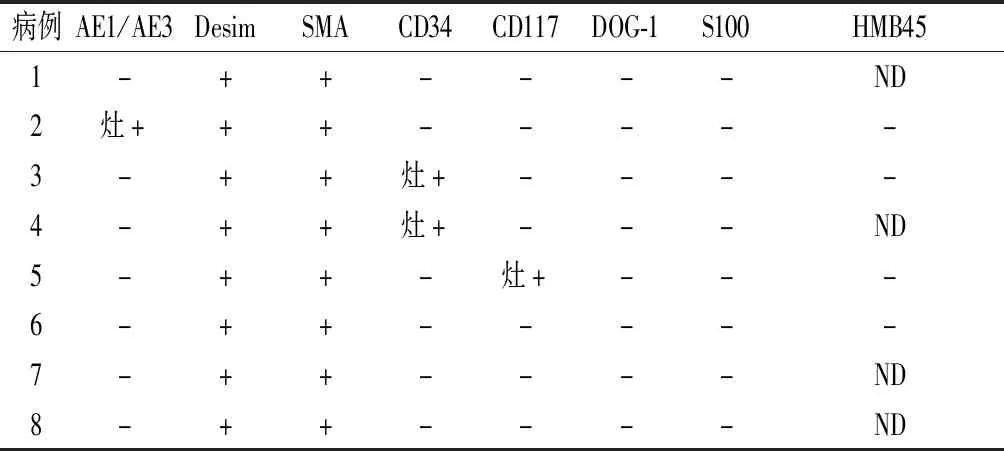
表1 8例腹膜后平滑肌肉瘤患者的免疫组化表型

表2 8例腹膜后平滑肌肉瘤患者临床资料及随访情况
3 讨论
原发性腹膜后肉瘤少见,占所有软组织肉瘤的12%~15%,PRLS是继脂肪肉瘤之后第二位常见的软组织肉瘤,多数起源于腹部静脉如下腔静脉、肾静脉等[3]。因发病部位隐匿,腹膜后潜在间隙大,早期不易发现,临床亦无特征性表现,只有当肿瘤生长对周围组织和脏器产生压迫或侵袭时,患者才会有腹部疼痛不适,或触及腹部包块。本组仅3例出现腹部不适疼痛(37.5%),而5例(62.5%)为体检发现,并无明显临床症状,因此常规体检十分重要。影像学检查是术前常用的筛查方法,CT和MRI可评价肿瘤大小、数目、边界以及与周围组织关系等起着十分重要的作用[4],但该肿瘤在影像学上很难与其他腹膜后肿瘤如胃肠道外间质瘤、恶性外周神经鞘膜瘤等相鉴别,最终诊断需依赖病理组织学检查。
PRLS大体形态表现为灰白结节状,切面呈漩涡状,可伴有出血、坏死,囊性变。通常体积较大,王关卉儿等[5]报道肿瘤直径>8cm占48.4%,本组8例中有5例直径≥8cm(62.5%),这也充分体现了腹膜后肿瘤的生长特性。镜下可见具有肌源性分化的梭形细胞呈束状排列,可出现不同程度的异型性,并可见瘤巨细胞和核分裂,通常核分裂像≥5个/50HPF。此外,肿瘤细胞也可出现形态学变异,如上皮样、横纹肌样及颗粒样变性[6]。免疫组化结果显示肿瘤细胞SMA、caldesmon和Desim弥漫强阳性,提示为平滑肌源性恶性肿瘤。少数病例也可表达AE1/AE3、CD34及S100。本组病例中有2例灶性表达CD34,1例灶性表达CD117,这与文献报道[7]相一致。
PRLS需与具有梭形细胞形态的肿瘤相鉴别:(1)去分化脂肪肉瘤:去分化成分可以为平滑肌肉瘤、横纹肌肉瘤、软骨肉瘤、骨肉瘤等,但同时含有分化性成分,即分化良好的脂肪肉瘤,经广泛取材较容易识别。(2)胃肠道外间质瘤:约20%发生于腹膜后,肿瘤细胞常呈梭形或短梭形,也呈束状或漩涡状排列,与平滑肌肉瘤相似,主要依靠免疫组化来鉴别,该肿瘤弥漫强表达CD117、DOG1,而不表达肌源性标记,且存在c-kit或PDGFR基因的突变[8]。(3)肾血管平滑肌脂肪瘤:可见梭形的平滑肌细胞,部分可以上皮样并伴有异型性,此外还有厚壁血管和不同比例的脂肪组织,肿瘤细胞可表达SMA、HMB45及S100[9]。(4)神经源性肿瘤:肿瘤细胞为长条束状的梭形细胞,常形成交替分布的细胞稀疏区和细胞丰富区,免疫组化表达神经源性标记S100。
PRLS目前最有效的治疗方法仍然是手术切除,完整切除肿瘤对降低术后复发风险至关重要[10],术前放疗的作用尚不清楚,目前正在进行临床试验研究。对完全切除不确定的患者可考虑新辅助化疗[11]。PRLS中有10%可局部复发,50%的患者5年内出现远处转移[3]。有研究显示辅助治疗系统的差异并不影响平滑肌肉瘤的局部复发率、远处转移率及总生存率[12-13]。本组有1例行腹腔肿瘤切除、肝部分切除及左肾静脉部分切除修补术,后规律化疗及靶向治疗,已随访48个月,疾病稳定。也有大宗病例数据显示,PRLS的5年局部复发率为21%,远处转移率为47%,对于术后复发再次手术患者3年生存率(72.6%)与未行手术者(58.1%)相比,具有显著性差异[14]。本组中有2例术后出现复发转移,虽经积极治疗,生存期均较短(平均11个月),考虑可能与病例数较少有关。另外,影响总体生存率的因素还包括:肿瘤的大小、分级、组织学亚型、多灶性和完整切除[10,15]。
综上所述,PRLS无特异性临床表现与影像学特征,需靠病理学检查明确诊断,手术治疗后复发转移率高,预后较差。
