湿润伤口灵对大鼠创面修复作用及对VEGF和TGF-β1的影响
2021-03-25汪锴张小舟李娟陈科力
汪锴 张小舟 李娟 陈科力






【摘要】 目的:探討湿润伤口灵对大鼠创面修复的影响及可能的机制。方法:选取30只大鼠,每只大鼠背部打3个孔来建立皮肤创伤模型,采用自体对照研究,3个孔分别设定为给药组(湿润伤口灵,n=30)、阳性对照组(重组牛碱性成纤维细胞生长因子凝胶,n=30)及模型组(生理盐水,n=30)。分别在建模用药后的第1、3、5、7、10、14天,观察各组大鼠创面愈合情况,同时取创面组织样本进行苏木精-伊红染色(hematoxylin-eosin staining,HE染色)观察病理变化,采用实时荧光定量聚合酶链式反应(RT-qPCR)和免疫组化法比较各组创面血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)的表达水平。结果:第3、5、7、10、14天,阳性对照组和给药组的创面愈合率均高于模型组(P<0.05);第7、10、14天,给药组创面愈合率均高于阳性对照组(P<0.05)。第14天,模型组创面形成肉芽组织,胶原纤维排列不规整,给药组创面明显形成肉芽组织,胶原纤维及大量汗腺细胞和导管增生、毛囊规整排列。给药组和阳性对照组VEGF与TGF-β1平均累计光密度值均高于模型组(P<0.05)。第3、7天,给药组和阳性对照组VEGF和TGF-β1的mRNA相对表达量均高于模型组(P<0.05)。第14天,给药组和阳性对照组VEGF和TGF-β1的mRNA相对表达量均低于模型组(P<0.05),且给药组和阳性对照组VEGF和TGF-β1的mRNA相对表达量,差异均无统计学意义(P>0.05)。结论:湿润伤口灵能通过促进大鼠创面中VEGF和TGF-β1的表达,显著加快大鼠创面组织的愈合。
【关键词】 湿润伤口灵 血管生长因子 转化生长因子-β1
Effects of Shirun Shangkou Ling on Wound Healing in Rats and Its Effect on VEGF and TGF-β1/WANG Kai, ZHANG Xiaozhou, LI Juan, CHEN Keli. //Medical Innovation of China, 2021, 18(34): 032-037
[Abstract] Objective: To explore the effects of Shirun Shangkou Ling on wound healing in rats and its possible mechanism. Method: Thirty rats were selected, and 3 holes were perforated on the back of each rat to establish skin trauma model. Autologous control study was conducted, and 3 holes were set as drug administration group (Shirun Shangkou Ling, n=30), positive control group (Recombinant Bovine Basic Fibroblast Growth Factor Gel, n=30) and model group (normal saline, n=30), respectively. Wound healing of rats in each group was observed at day 1, 3, 5, 7, 10, and 14 after modeling medication, respectively. Meanwhile, wound tissue samples were collected for hematoxylin-eosin staining (HE staining) to observe pathological changes. Vascular endothelial growth factor (VEGF) and transforming growth factor -β1 (TGF-β1) were compared in each group by real-time fluorescence quantitative polymerase chain reaction (RT-QPCR) and immunohistochemistry. Result: On days 3, 5, 7, 10 and 14, the wound healing rate in positive control group and administration group were higher than those in model group (P<0.05). On days 7, 10 and 14, the wound healing rate in the administration group were higher than those in the positive control group (P<0.05). On day 14, granulation tissue was formed on the wound surface of the model group, and collagen fibers were arranged irregularly, while granulation tissue was obviously formed on the wound surface of the administration group, and collagen fibers, a large number of sweat cells and ducts were hyperplasia, and hair follicles were arranged regularly. The average cumulative optical density of VEGF and TGF-β1 in the administration group and positive control group were higher than those in the model group (P<0.05). On days 3 and 7, the mRNA relative expression levels of VEGF and TGF-β1 in the administration group and positive control group were higher than those in the model group (P<0.05). On day 14, the mRNA relative expression levels of VEGF and TGF-β1 in the administration group and positive control group were lower than those in the model group (P<0.05), and there was no statistical significance in the mRNA relative expression levels of VEGF and TGF-β1 between the administration group and positive control group (P>0.05). Conclusion: Shirun Shangkou Ling can significantly accelerate the healing of rat wound tissues by promoting the secretion of VEGF and TGF-β1 in rat wounds.
[Key words] Shirun Shangkou Ling VEGF TGF-β1
First-author’s address: Xiaogan Hospital Affiliated to Wuhan University of Science Technology, Xiaogan 432000, China
doi:10.3969/j.issn.1674-4985.2021.34.008
随着人口老龄化的来临、抗生素的滥用、大量耐药菌种的出现,烫伤、烧伤、感染、糖尿病足、压疮等各种原因导致难愈性皮肤缺损患者日趋增多,如何快速有效的治愈此类患者、找到有效针对此类伤口的治疗手段有着巨大的社会效益和经济效益[1-2]。日前,国内外针对难愈性创面治疗的手段不断更新迭代,但仍对一部分难愈性创面无效。在日常工作中,本科自制配方研制的湿润伤口灵(专利号ZL201010278057.X)对治疗难愈性创面的患者有着良好的效果,且其制备方法简便快速,创面能够较常规换药提前愈合的天数、缩短住院时长,且愈合质量较常规手段显著提高,患者免受取皮植皮的痛苦,为难愈性伤口的良好愈合提供了一种新的有效治疗手段,减轻了患者经济负担和医师工作量[3]。
湿润伤口灵是由鹿角、龙骨、血竭、象皮、二花、生地、当归、冰片、小麻油等熬制而成,其主要原理是祛瘀生肌,其促进伤口愈合的作用机制尚未明确,因而,课题组申请了湖北省卫生健康委项目:湿润伤口灵对大鼠创面EGF、VEGF表达水平影响的实验研究。通过建立大鼠皮肤创伤模型,利用免疫组化法和RT-qPCR等方法,对大鼠皮肤创面愈合过程中VEGF和TGF-β1的分子生物学检测,从分子生物学水平探讨其促进创面愈合的内在作用机制,并与促进伤口愈合常用药重组人表皮细胞生长因子进行比较,从动物模型监测其疗效。
1 材料与方法
1.1 材料
1.1.1 實验动物 湖北省实验动物研究中心的无特定病原体级实验动物(SPF级动物),SD大鼠30只,6~8周龄,体重160~180 g,许可证号:[SCXK(鄂)2015-0018]。
1.1.2 药物与试剂 湿润伤口灵油剂:由鹿茸30 g、龙骨30 g、血竭30 g、象皮30 g、二花30 g、生地30 g、当归30 g及冰片50 g、小麻油1 000 g按重量配比准备原料,再将其用不锈钢锅微火加热至80 ℃左右,再用无菌纱布包裹前上所述材料、浸泡在小麻油中并不断翻动使其受热均匀熬制成铁锈色时停止加热、形成小麻油混合物,最后将冰片置入其内完全溶解后瓶装,制备完成。重组牛碱性成纤维细胞生长因子凝胶(生产厂家:珠海亿胜生物制药有限公司,批准文号:国药准字S20040001,规格:10 g)、戊巴比妥钠(生产厂家:Sigma公司,CAS编号:57-33-0,批号P5764-5G,规格:5 g)、VEGF和TGF-β1(博奥森生物技术有限公司)。FastQuant cDNA第一链合成试剂盒(KR106-2)及SuperReal PreMix荧光定量预混试剂(FP205-02)均于天根生化科技有限公司采购。RNA提取试剂盒(天根生化科技有限公司)、VEGF和TGF-β1的RT-PCR的引物(上海捷瑞生物工程有限公司)。石蜡切片免疫组化所使用的EDTA(pH8.0)抗原修复液、EDTA(pH9.0)抗原修复液、柠檬酸(pH6.0)抗原修复液、PBS缓冲液、3%双氧水、BSA、正常兔血清、苏木素染液、苏木素分化液、苏木素返蓝液、中性树胶均购自Servicebio公司。无水乙醇和二甲苯购自国药集团化学试剂有限公司。HE染色所使用的HE染液、分化液、返蓝液、组化试剂DAB显色剂购自Servicebio公司。
1.1.3 主要实验器械 一次性使用5 mL负压采血管(山东奥赛特医疗器械有限公司,型号:肝素钠);一次性使用1、5 mL无菌注射器带针(上海金塔医用器材有限公司);电子分析天平(XB220A);冷冻离心机(Centrifuge 5804 R);超声波清洗器(KQ 3200B);酶标仪(Synergy 2);PCR仪(Roche Light cycle 480Ⅱ);超微量紫外(Nanodrop 2000);移液枪(型号:Research plus);Water purifier实验室专用超纯水机及包埋机、冻台(JJ-12J、JB-P5、JB-L5);病理切片机(型号:RM2016);组织摊片机(型号:KD-P);日本尼康正置光学显微镜、成像系统(Nikon Eclipse E100、DS-U3);脱色摇床(TSY-B);涡旋混合器(MX-F);掌上离心机(D1008E)。
1.2 分组与干预后造模
1.2.1 大鼠皮肤创伤模型的建立与分组方法 选取30只大鼠,动物模型制备参考文献[3]中的方法,大鼠适应性喂养1周后,称重,剃除背部及其周围毛,用0.25%的戊巴比妥腹腔注射麻醉,将麻醉后的大鼠俯卧固定,生理盐水洗净擦干,局部消毒后,用直径0.6 cm的打孔器于背部正中两侧打3个孔,深达肌筋膜,破坏部分肌肉表面筋膜,表面以凡士林纱布覆盖。采用自体对照研究,3个孔分别设定为模型组,阳性对照组,给药组,每组30个孔。动物单笼饲养,防止大鼠撕咬、舔蹭,给予充分的喂养。
1.2.2 各组处理方法 给药组创面每天常规消毒后,给予浸润湿润烧伤灵的无菌纱布覆盖创面,1次/d;模型组给予浸润生理盐水的无菌纱布覆盖创面,1次/d;阳性对照组给予重组牛碱性成纤维细胞生长因子凝胶,1次/d。
1.3 观察指标
1.3.1 比较各组肉眼观察皮肤修复情况
1.3.2 比较各组创面病理切片观察情况及创面愈合率 末次给药2 h后取创口皮肤组织,分别在用药后的第1、3、5、7、10、14天用0.25%的戊巴比妥麻醉大鼠取样,用刀片切取各组创面皮肤组织,约0.05 cm3。至于-80 ℃的冰箱中备用,另取部分组织甲醛固定,用于组织学光镜观察。建模后第3、5、7、10、14天为各组大鼠创面拍摄图像,再用图像分析软件(Image J)自动计算面积,最后算出创面愈合率。
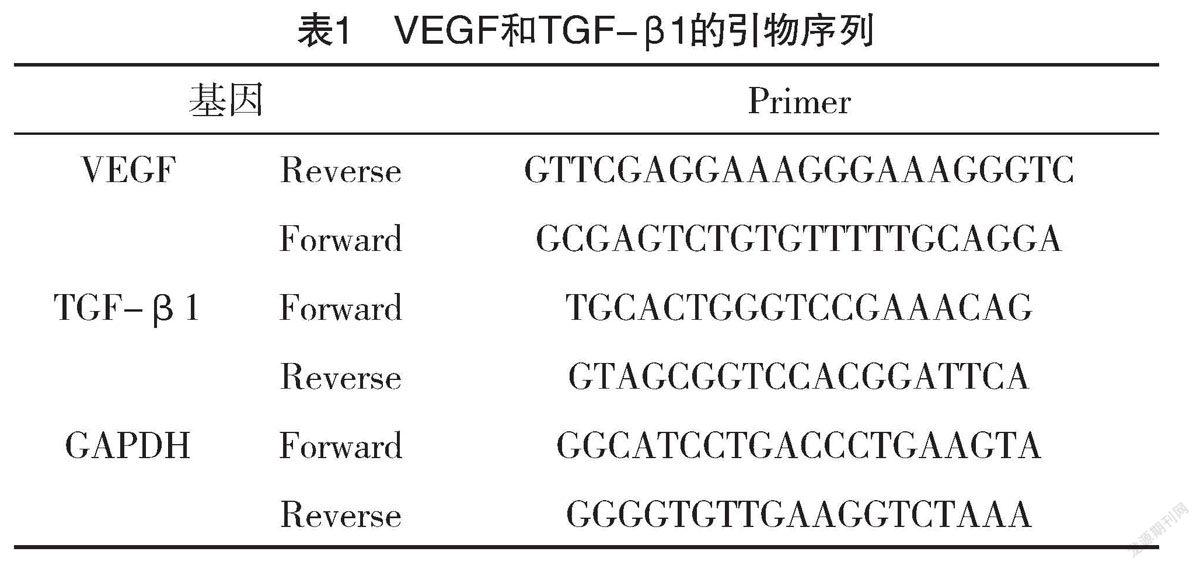
1.3.3 比较各组创面VEGF和TGF-β1的mRNA表达情况 取各组大鼠皮肤组织,用Trizol裂解后,按照RNA试剂盒提取方法提取总RNA将2 μg RNA逆转录合成cDNA稀释5倍备用,采用SYBR法进行实时荧光定量PCR,反应体系为10 μL,引物由Invitrogen上海公司合成,内参为GAPDH。使用2-ΔΔCt方法计算mRNA的相对表达水平。引物序列见表1。
1.3.4 比较各组创面VEGF和TGF-β1水平 采用免疫组化法进行检测。组织切片置于盛满柠檬酸抗原修复缓冲液(pH 6.0)的修复盒中于微波炉内进行抗原修复;后切片放入3%双氧水溶液,室温避光孵育25 min,将玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,5 min/次;在组化圈内滴加3% BSA均匀覆盖组织,室温封闭30 min;分别加入VEGF和TGF-β1、GAPDH的一抗(浓度
1︰1 000)4 ℃孵育过夜;脱色摇床上晃动洗涤3次孵化相应的二抗(浓度1︰8 000~1︰4 000)室温孵育50 min,DAB显色。待组织切片干燥后,使用光学显微镜进行观察和拍照,数据处理软件使用Image J,利用光密度(integrated optical density,IOD)为指标用以表示阳性表达量的多少,最后结果以用平均累计光密度表示。
1.4 统计学处理 采用SPSS 23软件对所得数据进行统计分析,数据拟行方差齐性检验,符合正态分布的计量资料用(x±s)表示,多组间数据比较行单因素方差分析(One-way ANOVA),以P<0.05为显著性差异,P<0.01为极显著差异。画图软件应用GraphPad Prism 8。
2 结果
2.1 各组大鼠肉眼观察皮肤修复情况比较 观察期间所有小鼠均没有发生个体死亡或切口感染的情况。建模当天各组创面周边皮肤和创面中组织均发红肿胀,有渗液。第3天仅模型组稍有红肿和渗液,周缘皮肤开始褶皱,阳性对照组和给药组周缘皮肤收缩明显,且创面覆盖新生薄皮。第5天,各组痂皮均开始形成,模型组创面周缘稍显缩小;给药组和阳性对照组创面周缘明显收缩,整个创面被较厚痂皮覆盖。第7天,三组创面均渐渐缩小,给药组有部分大鼠痂皮已脱落。第10天,三组创口附近毛发开始明显生成,给药组和阳性对照组创面明显缩小,模型组创面面积虽有所缩小,但创面面积明显大于阳性对照组和给药组。第14天,三组创面基本修复,被新生表皮覆盖,模型组仍可观察到小块暗红色瘢痕,阳性对照组可观察到微小暗红色瘢痕,而给药组创口已经全部覆盖毛发。见图1。
2.2 创面愈合过程中各组大鼠创面愈合率的比
较 第3、5、7、10、14天,阳性对照组和给药组的创面愈合率均高于模型组(P<0.05);第7、10、14天,给药组创面愈合率均高于阳性对照组(P<0.05)。见表2。
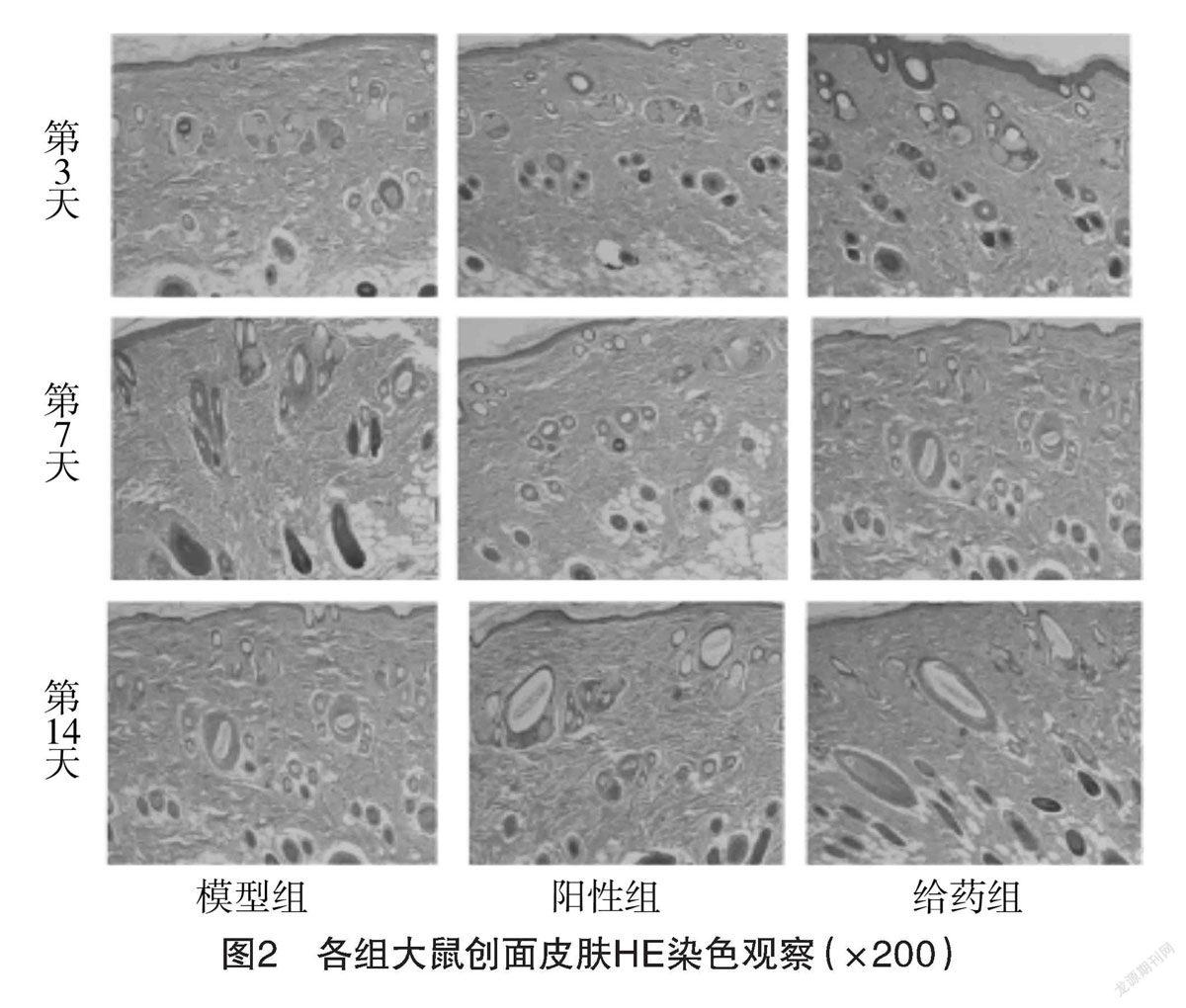
2.3 各组大鼠创面病理切片结果比较 HE染色结果显示,与模型组比较,建模第3天,模型组有炎症细胞浸润,新生毛细血管,汗腺细胞相对较少见,成纤维细胞排列紊乱;少量炎细胞浸润给药组和阳性对照组组,可见新生毛细血管、汗腺细胞、成纤维细胞、上皮细胞大量增生。第7天,模型组仍有炎症细胞浸润,上皮细胞增生明显,新生毛细血管和成纤维细胞数量较前几天增多,给药组和阳性对照组组可见大量成纤维细胞和新生毛细血管,密集汗腺细胞,导管内径增大。第14天,模型组创面形成肉芽组织,胶原纤维排列不规整,给药组创面明显形成肉芽组织,胶原纤维及大量汗腺细胞和导管增生、毛囊规整排列。见图2。
2.4 各组大鼠创面VEGF和TGF-β1水平比
较 第3天,模型组创面VEGF与TGF-β1均呈弱阳性表达,见图3。给药组和阳性对照组VEGF与TGF-β1平均累计光密度值均高于模型组,差异均有统计学意义(P<0.05)。见表3。
2.5 各组创面VEGF和TGF-β1的mRNA表达情况比较 第3、7天,给药组和阳性对照组VEGF和TGF-β1的mRNA相对表达量均高于模型组(P<0.01)。第14天,给药组和阳性对照组VEGF和TGF-β1的mRNA相对表达量均低于模型组(P<0.05),且给药组和阳性对照组VEGF和TGF-β1的mRNA相对表达量,差异均无统计学意义(P>0.05)。见图4、表4。
3 讨论
难愈性创面是指患者受伤时皮肤组织损伤严重,后期治疗过程中由于各种因素造成的伤口未愈合或无愈合倾向的创面,此类创面残留坏死组织多、局部促进组织修复的生长因子浓度低、局部血供差等特点[4-5],这是常规清创换药不能解决的,一直是临床治疗中较为棘手的问题。市面传统药物所用敷料由于材料特性和缺乏对创面组织的主动干预能力,只能起到保护作用[5-6]。与之相比,湿润伤口灵具有如下优点:(1)原料获取简单、制备程序简便、易于保存、操作易重复、且疗效确切;(2)包含祛瘀生肌、解毒清热、凉血活血、止血收敛及润滑的功效,将其涂于伤口即可止疼消炎、清除溃烂、解毒生肌,创面愈合快,痊愈后不留瘢痕;(3)治疗过程中不需任何设施,费用低廉,减少患者住院天数。
本研究通过建立大鼠皮肤创伤模型,在体内水平来探讨湿润伤口灵对伤口创面愈合的促进作用及机制。本实验采用大鼠背部打孔的方法,在同一大鼠上分别肉眼观察和创面HE染色检测模型组、给药组和阳性对照组的伤口修复情况,避免了动物的个体差异。结果显示:从造模第3天开始,给药组的伤口愈合率明显强于模型组;从第7天起,伤口愈合率显著优于阳性对照组,给药组促进伤口愈合速度和效果明显强于模型组和阳性组。
在慢性难愈性创面中,血小板源性生长因子(platelet-derived growth factor,PDGF)、成纤维细胞生长因子(fibroblast growth factor,FHF)、表皮生长因子(epidermal growth factor,EGF)及TGF-β1等多种生长因子含量均减少[7-10]。创伤愈合是一个复杂的生物学过程,包括出血与凝血、炎症渗出、血管和肉芽组织的形成、再上皮化、纤维化和瘢痕改建过程等,在这一系列的生物学过程中TGF-β1、VEGF等各种生长因子发挥着重要的作用[11-15]。急性损伤时,人体内前述生长因子含量尚能发挥正常功能而参与愈合过程,使皮肤屏障功能得以复建;随着愈合时间的延长,炎症细胞持续浸润伤口、蛋白环境的改变导致生长因子不断降解的因素,使生长因子不能在伤口处发挥应有的促进愈合的功能,从而不断延长伤口愈合过程[16-20]。通过RT-qPCR和免疫组化法,本研究结果显示,给药组在用湿润伤口灵干预后,和空白对照组相比较,给药组創面VEGF、TGF-β1含量明显高于模型组和阳性对照组,揭示湿润伤口灵可能是通过加速伤口VEGF、TGF-β1分泌来促进难愈性伤口的愈合,这与国内外大量研究证明创面组织中VEGF、TGF-β1等生长因子含量的增高有利于创伤愈合,反之则创伤愈合不良相一致[2,7-8]。
综上所述,湿润伤口灵能降低伤口炎细胞浸润,促进大鼠创面中VEGF和TGF-β1的分泌,显著加快大鼠创面的组织愈合,其促进伤口愈合的效果强于重组人表皮细胞生长因子,有望成为治疗难愈性伤口的候选药物,值得在临床工作中推广。
参考文献
[1]黄丽芳,许彦,唐乾利.压疮的中西医结合治疗进展[J].中国烧伤创疡杂志,2020,32(1):12-14,25.
[2]张小舟,宋其合,涂红梅,等.湿润伤口灵联合VSD治疗难愈性伤口临床效果[J].创伤与急危重病医学,2016,4(1):28-32.
[3]付小兵.建设规范化和标准化创面修复科在中国的实践[J].中华创伤杂志,2020,36(1):130-132.
[4] Yy A,Yy A,AMD B,et al.Neutralization of Bombina variegata peptide 8 suppresses retinal neovascularization in two different murine models:The oxygen-induced retinopathy model and the rhodopsin promoter/VEGF transgenic mouse model[J].Experimental Eye Research,2020,193:107993.
[5]蔡景美,周曼,代貴凤,等.慢性难愈性创面住院患者回顾性调查[J].中华烧伤杂志,2011,27(2):135-138.
[6]赵斌,褚庆玉,李筱,等.慢性难愈合创面治疗进展[J].河北医药,2020,42(20):3154-3158.
[7] Knezevic N N,Candido K D,Desai R,et al.Is Platelet-Rich plasma a future therapy in pain management[J].Med Clin North Am,2016,100(1):199-217.
[8] Goh M,Hwang Y,Tae G.Epidermal growth factor loaded heparin-based hydrogel sheet for skin wound healing[J].Carbohydrate Polymers,2016,147(20):251-260.
[9] Game F,Jeffcoate W,Tarnow L,et al.The LeucoPatch system in the management of hard-to-hard diabetic foot ulcers:study protocol for a randomised controlled trail[J].Trials,2017,18(1):1-8.
[10] Andasari V,Lü D,Swat M,et al.Computational model of wound healing:EGF secreted by fibroblasts promotes delayed re-epithelialization of epithelial keratinocytes[J].Integrative Biology,2018,10(3):448-455.
[11]张振,刁云鹏,王寿宇,等.中药五谷虫促进创面愈合及血管内皮生长因子表达的研究[J].中华中医药学刊,2013,31(4):761-763.
[12]郝剑,易成刚,陶谏,等.中药治疗慢性难愈性创面的研究进展[J].中国美容医学,2015,14(6):775-777.
[13]郑月月,石小霞,柳德学,等.芦荟多糖对糖尿病足溃疡大鼠创面愈合的影响[J].中国临床药理学杂志,2021,37(2):153-156.
[14] WANG F,DU L Q,GE S H.PTH/SDF-1αcotherapy induces CD90+CD34-stromal cells migration and promotes tissue regeneration in a rat periodontal defect model[J].Sci Rep,2016,6:30403.
[15] Das U,Behera S S,Pramanik K.Ethno-herbal-medico in wound repair:an incisive review[J].Phytother Res,2017,31(4):579-590.
[16] Mohamad N,Badrin S,Wan Abdullah W N H.A diabetic elderly man with finger ulcer[J].Korean J Fam Med,2018,39(2):126-129.
[17] Blume P,Wu S.Updating the diabetic foot treatment algorithm:recommendations on treatment using advanced medicine and therapies[J].Wounds,2018,30(2):29-35.
[18] Crafts T D,Jensen A R,Blocher-Smith E C,et al.Vascular endothelial growth factor:therapeutic possibilities and challenges for the treatment of ischemia[J].Cytokine,2015,71(2):385-393.
[19]马媛,张大鹏,王想.红枣色素通过调控miR-29b-3p/MST1表达对高糖诱导的小鼠足细胞损伤的影响及机制[J].热带医学杂志,2020,20(1):6-12,44.
[20]杨帆,杨宁,程天平,等.超声清创刀联合负压创面系统治疗糖尿病足溃疡效果及其机制[J].实用医学杂志,2018,34(8):1239-1243.
(收稿日期:2021-09-13)
基金项目:湖北省卫生健康委2019年度第一批联合基金立项项目(WJ2019H250)
①武汉科技大学附属孝感医院 湖北 孝感 432000
②湖北中医药大学
通信作者:张小舟
