CT引导下经皮125I放射性粒子植入术后肺癌针道种植转移的危险因素分析
2021-03-24王银银傅中明彭卫东俞万钧
王银银 傅中明 彭卫东 俞万钧

[摘要] 目的 探讨CT引导下经皮125I放射性粒子植入术后肺癌针道种植转移的危险因素。 方法 回顾性选取2015年1月至2020年4月在我院呼吸与危重症医学科接受CT引导下经皮125I放射性粒子植入术治疗的156例肺癌患者作为研究对象,收集并分析其临床资料。术后随访,统计所有发生针道种植转移的病例,计算针道种植转移的发生率,计算每例患者的平均穿刺深度,记录首次发现肿瘤针道种植转移的时间。通过病例对照研究,分别将位于胸膜下的肿瘤、低分化的肿瘤、平均穿刺深度、肿瘤直径作为暴露因素,探讨其与肿瘤针道种植转移的关系。 结果 34例患者病灶紧贴胸膜,34例患者病理示低分化癌,所有患者平均穿刺深度为(12.138±4.913)cm,其中63例患者平均穿刺深度<10 cm,28例患者病灶直径<2 cm。2例患者发生针道种植转移,病灶直径均>2 cm;病理结果显示2例均为低分化癌,发现针道种植转移的平均时间为(154.500±19.091)d;平均穿刺深度为(9.849±1.228)cm。125I粒子植入术后发生肿瘤针道种植转移患者与未发生转移患者肿瘤是否位于胸膜下、是否为低分化肿瘤、平均穿刺深度、肿瘤直径比较,差异无统计学意义(P>0.05)。 结论 经皮125I放射性粒子植入治疗后可能发生肿瘤针道种植转移,但发生率低,经过积极治疗后,不会成为患者的致死因素。
[关键词] 肺癌;125I粒子;针道;种植转移
[中图分类号] R730.5 [文献标识码] B [文章編号] 1673-9701(2021)03-0113-05
Analysis of the risk factors of lung cancer needle tract metastasis after CT guided percutaneous 125I particles implantation
WANG Yinyin FU Zhongming PENG Weidong YU Wanjun
Department of Respiratory and Critical Care Medicine, People′s Hospital Affiliated to Ningbo University, Ningbo Yinzhou People′s Hospital, Ningbo 315000, China
[Abstract] Objective To explore the risk factors of lung cancer needle tract metastasis after CT-guided percutaneous 125I particles implantation. Methods A total of 156 lung cancer patients who underwent CT-guided percutaneous 125I particles implantation in the Department of Respiratory and Critical Care Medicine in our hospital from January 2015 to April 2020 were selected as the research objects, and their clinical data were collected and analyzed. The patients were followed up after the operation. All cases of needle tract implant metastasis were counted. The probability of needle tract implant metastasis was calculated. The average puncture depth of each patient was calculated. The time when tumor needle tract implant metastasis was first discovered was recorded. Through case-control studies, the subpleural tumors, poorly differentiated tumors, average puncture depth, and tumor diameter were used as exposure factors to explore whether there was a relationship between them and tumor needle implant metastasis. Results 34 patients had lesions close to the pleura. 34 patients showed poorly differentiated cancer pathology. All patients had an average puncture depth of(12.138±4.913) cm, of which 63 patients had an average puncture depth of less than 10 cm, and 28 patients had lesions less than 2 cm in diameter. Two patients had needle tract implant metastasis. The diameter of the lesions was larger than 2 cm. The pathological results showed that both cases were poorly differentiated cancer. The average time to find needle tract implant metastasis was(154.500±19.091) days. The average puncture depth was(9.849±1.228)cm. There was no significant difference in tumor location, poorly differentiated tumor, average puncture depth and tumor diameter between patients with tumor needle implantation metastasis after 125I seed implantation and without metastasis after 125I seed implantation(P>0.05). Conclusion Needle tract implant metastasis of tumor may occur after percutaneous 125I particle implantation, but has a low incidence. After active treatment, it will not become a fatal factor for patients.
[Key words] Lung cancer; 125I particles; Needle tract; Implant metastasis
125I放射性粒子植入术是近年来发展起来的针对肿瘤放射治疗的重要手段[1-2],目前临床上主要依靠超声或CT引导穿刺针穿刺进入肿瘤组织内部植入125I放射性粒子,是一种新型近距离放射线治疗肿瘤的方法,其发出的γ射线具有近距离杀死肿瘤细胞的作用,作为一种高效的适形放疗,具有持续杀伤肿瘤细胞且对正常组织损伤较低的特点[3]。目前已广泛应用于前列腺癌、肺癌、甲状腺癌等的治疗[4-5]。目前国内一些学者对于125I放射性粒子植入治疗晚期肿瘤的安全性和有效性进行了不同程度的研究,对于一些穿刺并发症如穿刺针道肿瘤种植转移的相关报道较少。本研究回顾性选取2015年1月至2020年4月在宁波大学附属人民医院呼吸与危重症医学科行CT引导下经皮125I放射性粒子植入术治疗的晚期肺癌患者作为研究对象,收集并分析其临床资料,以探讨肿瘤针道种植转移的危险因素,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取2015年1月至2020年4月在宁波大学附属人民医院呼吸与危重癥医学科接受CT引导下125I放射性粒子植入术治疗的156例晚期肺癌患者作为研究对象,其中男128例,女28例,年龄48~85岁,平均(70.647±12.501)岁,收集并分析其临床资料。本研究经医院医学伦理委员会审批通过,且所有患者术前均签署125I放射性粒子植入治疗知情同意书。纳入标准[6-7]:经手术或穿刺活检病理确诊为肺癌者;经一线化疗后肺部仍有病灶或复发病灶者;因疾病原因或身体状态无法行肺切除手术者;拒绝外放疗者;肿瘤最大直径≤7 cm者;肺部肿瘤数量≤4个者;卡氏功能评分(Karnofsky performance status,KPS)>70分者;可耐受放射性粒子植入术者。排除标准[6-7]:大量胸水者;全身肿瘤广泛转移者;有出凝血障碍且难以纠正者;有心、肝、脑和肾等重要脏器严重病变者。所植入125I放射性粒子的放射活度为0.6~0.8 mCi,半衰期约为60 d。
1.2 方法
术前完善血常规、凝血功能、炎症指标、生化、心电图、肺功能等各项检查,排除感染、凝血功能障碍及伴有胸腔积液、心、肝、脑和肾等重要脏器严重病变的患者,术前在服用抗凝药物的患者提前停药,并予低分子肝素替代治疗,术前24 h内停用低分子肝素。术前完善胸部增强CT扫描并传送至应用治疗计划系统(Treatment plan system,TPS),由专职物理师根据TPS确定125I放射性粒子植入的数量、靶区分布及进针位置,设定处方剂量为120~160 Gy[8]。术中患者取合适体位,监测生命体征,备好胸腔穿刺包及抢救车,常规消毒铺巾、1%利多卡因局部麻醉,CT扫描定位选取穿刺点,按照TPS治疗计划布针、植入粒子,每个粒子间隔约1.0 cm,手术过程中行CT扫描确认粒子植入针位置,根据具体情况调整植入针位置及植入计划,由于肿瘤位置或与周围血管、气管关系等原因,最终植入粒子数与根据TPS治疗计划应植入粒子数不完全一致,记录每根穿刺针的穿刺深度,计算每例患者的平均穿刺深度。手术完成后穿刺局部消毒并按压穿刺点不少于10 min后予敷料包扎,返回病房前复查胸部CT明确有无出血、气胸等并发症,术后根据患者病情及术中情况决定是否给予止血、抗感染等治疗,术后次日再次复查胸部CT或胸片明确有无出血或气胸等并发症。
嘱所有患者术后定期复查胸部CT以明确粒子植入术后疾病的转归情况,随访至疾病进展或出现临床终末事件。评价患者复查的胸部CT图像,若胸部CT有以下影像学表现则表明发生了肿瘤针道种植转移:发生于肺实质穿刺针道内、脏壁层胸膜上或皮下软组织内的结节状或肿块状病变[9]。统计所有发生针道种植转移的病例,计算其发生率,计算每例患者的平均穿刺深度,记录首次发现肿瘤针道种植转移的时间。通过病例对照研究,分别将位于胸膜下的肿瘤、低分化的肿瘤、平均穿刺深度、肿瘤直径作为暴露因素,判断其与肿瘤针道种植转移间的关系。
1.3 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,计数资料用[n(%)]表示,采用Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 研究对象暴露因素分析
所有患者均根据术前TPS行多针多角度布针穿刺,其中34例患者病灶紧贴胸膜,34例患者病理示低分化癌,所有患者平均穿刺深度为(12.138±4.913)cm,其中63例患者平均穿刺深度<10 cm,28例患者病灶直径<2 cm。所有患者行125I放射性粒子植入治疗后短期(至少3周)均未联用化疗或常规放疗等其他抗肿瘤治疗。
2.2 针道种植转移患者影像学表现及暴露因素分析
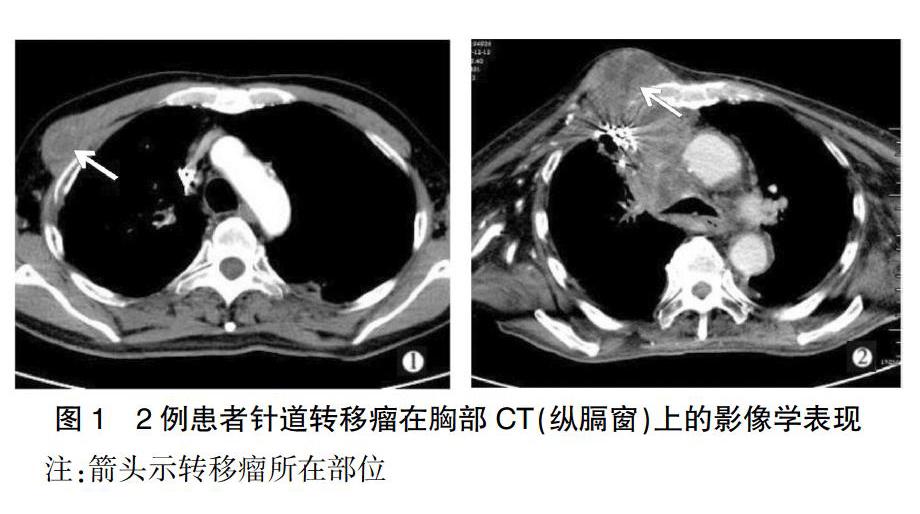
共2例(2/156,1.282%)患者发生肿瘤针道种植转移,1例患者转移瘤在胸部CT(纵膈窗)上,表现为沿原穿刺路径皮下肌肉层内的一类圆形小结节,另1例患者表现为沿原穿刺路径皮下软组织内的分叶状结节。见图l。2例患者均为男性,平均年龄为(72.000±12.727)岁,病灶均位于右肺,病灶直径均>2 cm,病理结果显示其中1例为低分化鳞癌,另1例为低分化非小细胞肺癌,具体类型免疫组化难以鉴别。肿瘤针道种植转移首次发现的平均时间为(154.500±19.091)d,平均穿刺深度为(9.849±1.228)cm。针对转移瘤的治疗:1例行外科手术切除,术后病理与原发病灶相同,1例患者因一般情况较差,病情重,家属放弃治疗。
2.3 是否发生肿瘤针道种植转移患者相关暴露因素比较
通过病例对照研究方法,分别将位于胸膜下的肿瘤、低分化的肿瘤、平均穿刺深度、肿瘤直径作为暴露因素,将所有病例按照是否位于胸膜下、是否低分化肿瘤、平均穿刺深度≥10 cm或<10 cm、肿瘤直径≥2 cm或<2 cm进行归类,统计各归类条件下发生肿瘤针道种植转移的例数,采用Fisher确切概率法,分析暴露因素与肿瘤针道种植转移的关系。结果显示,125I粒子植入术后发生肿瘤针道种植转移患者与未发生转移患者肿瘤是否位于胸膜下、是否为低分化肿瘤、平均穿刺深度、肿瘤直径比较,差异无统计学意义(P>0.05)。见表1。
3 讨论
肺癌是我国发病率和病死率最高的恶性肿瘤,且发病率呈逐年升高趋势,由于缺乏早期筛查,大部分患者就诊时已处于疾病中晚期,失去了手术机会[10]。125I放射性粒子植入术是一种创伤小且有效的近距离放射治疗方法,可以作为晚期肺癌或肺转移癌的一种有效治疗手段[11]。该治疗通过CT引导技术将125I放射性粒子根据术前TPS计划精确地植入到肿瘤内部,实现对肿瘤的精准灭活[6]。Dai等[12]经皮在CT引导下对56例局部晚期非小细胞肺癌患者行放射性粒子植入术,所有患者耐受良好,有2例患者发生气胸,肺组织压缩10%~15%,经吸氧治疗后2周内气胸愈合;8例患者有轻到中度发热,予对症处理后缓解。术后随访,局部病灶控制率达98.2%,术后1年、2年、3年生存率分别达41.1%、39.3%、19.6%,证明对于局部晚期的非小细胞肺癌CT引导下放射性粒子植入术是一种安全有效的治疗手段。王一青等[7]对105例晚期肺癌和肺转移癌行125I放射性粒子植入术治疗,其中晚期肺癌患者78例,肺转移癌患者27例,术后随访中位生存时间为395 d,术后1年生存率约为78.1%,术后2年生存率约为56.1%,术后主要并发症为气胸,发生率为5.7%,证实对于晚期肺癌和肺转移癌CT引导下125I放射性粒子植入术是一种有效的控制肺部局限病灶的方法,治疗并发症总体可控,临床应用安全性较高。
CT引导下经皮肺穿刺的并发症主要是与穿刺相关的并发症,包括发热、气胸、血胸、皮下气肿、空气栓塞、肿瘤针道转移等,而放射性125I粒子植入治疗的并发症除上述穿刺相关并发症外,还包括放疗相关并发症如皮肤、黏膜、肺损伤等[6]。其中肿瘤针道种植转移是肿瘤穿刺术的1项少见并发症[13]。关于肿瘤针道种植转移,理论上肿瘤包膜因穿刺受损,从而使肿瘤细胞有了漏出的通道,由于肿瘤细胞之间的附着力低,使得肿瘤细胞有自发散布的趋势,在植入针退出过程中肿瘤细胞随穿刺局部血流通过穿刺针道散布至胸膜腔或皮肤表面,发生肿瘤种植转移[14-15],Shah等[16]开展的1项系统性回顾研究证实在穿刺后0~33 d可在穿刺针道内发现肿瘤细胞。
关于肿瘤针道种植转移的发生率,各文献报道不一。Kosugi等[17]经皮在B超引导下穿刺372例肝癌和73例胰腺癌患者,肿瘤针道种植发生率分别为1.6%(6/372)和1.4%(1/73),从穿刺到发现肿瘤的平均时间为11.2个月(5~25个月);Chang等[18]报道对1182例行经皮穿刺的肝癌患者CT检查发现,肿瘤针道种植转移的发生率为0.76%(9/1182),从穿刺到发现肿瘤针道种植的平均时间为9个月(4~21个月)。理论上多种机制可导致肿瘤的针道种植转移[14-15],本研究中,肺癌患者经皮穿刺放射性粒子植入术后肿瘤针道种植转移的发生率为1.28%,与Kosugi等[17]的报道大体一致,高于Chang等[18]的报道,主要是由于粒子植入术时需要多针多角度穿刺,理论上肿瘤发生针道种植转移的概率比穿刺活检术高[19]。本研究结果显示,肿瘤针道种植转移的平均时间约为5个月[(平均(154.500±19.091)d],比上述文献报道时间短,主要是由于粒子植入术后,本研究为每例患者制订了严格的门诊随访计划,并有专人负责随访,尽量做到每例患者每月都能进行胸部CT复查,对于不能及时来院复查的患者进行电话随访,督促患者就近于当地医院复查,并告知随访人员复查结果。此举一方面便于及时掌握患者术后疾病的转归,另一方面有利于尽早发现肿瘤种植转移。目前国内外文献报道与肿瘤针道种植转移相关危险因素有肿瘤位于器官表面或被膜下、多针多角度穿刺、肿瘤血供丰富、分化差、肿瘤分期级别较高、大口径穿刺针、肿瘤直径>2 cm等[20]。本研究结果显示,125I粒子植入术后发生肿瘤针道种植转移患者与未发生转移患者肿瘤是否位于胸膜下、是否为低分化肿瘤、平均穿刺深度、肿瘤直径比较,差异无统计学意义(P>0.05)。但Wang等[21]开展的1项纳入5项临床研究包含1242例患者的Meta分析表示,病灶位于胸膜下是肺癌患者经皮肺穿刺活检后疾病发生胸膜复发的危险因素(OR:10.76,95%CI:2.92~39.70)。鉴于本研究总体样本量不够、手术过程达不到完全一致等条件限制,在今后的工作中需进一步探索有力依据。
肿瘤针道种植转移发生率虽低,但仍需引起重视,可通过以下措施预防:严格掌握手术适应证,规范操作步骤;减少不必要穿刺,通过优化治疗计划以最少数量的针道排布治療所需粒子;以无水酒精或化疗药物注射穿刺针道;化疗药物浸泡植入针;术后早期行化疗、内分泌治疗、放疗甚至穿刺后针道射频消融,以杀灭针道内残留肿瘤细胞[22-23]。Bai等[24]报道将明胶阿霉素附着在穿刺针鞘上,可有效预防经皮穿刺后小鼠模型的肿瘤针道种植转移。而针道种植瘤一旦发生,首先考虑将其连同周围组织广泛切除[25],其他治疗措施如局部放疗、射频消融等也可考虑,只要能将种植瘤完整切除就不影响患者预后,患者预后仅与原发肿瘤有关[26-27]。
经皮放射性粒子植入术使肿瘤细胞脱落进入穿刺针道可能会导致肿瘤针道种植转移,因此术前需制定良好的治疗计划,术中合理布针、熟练操作并采取相应预防措施,术后及时进行肿瘤的全身化疗或局部放疗以预防其发生,制订严格的随访计划,严密随访,做到早发现早治疗。
[參考文献]
[1] 王俊杰.精准时代的放射性粒子植入治疗[J].中华核医学与分子影像杂志,2018,38(1):1-3.
[2] 孔国强,高社干,任婧,等.腹腔热化疗联合静脉化疗治疗恶性腹水的临床观察[J].实用中西医结合临床,2018, 18(1):107-108.
[3] Huo X,Huo B,Wang H,et al.Implantation of computed tomographyguided Iodine-125 seeds in combination with chemotherapy for the treatment of stage III non-small cell lung cancer[J].J Contemp Brachytherapy,2017,9(6):527-534.
[4] Han T,Yang X,Xu Y,et al.Therapeutic value of 3-D printing templateassisted(125)I-seed implantation in the treatment of malignant liver tumors[J].Onco Targets Ther,2017,10(2):3277-3283.
[5] Li W,Zheng Y,Li Y,et al.Effectiveness of(125)I seed implantation in the treatment of non-small cell lung cancer during R2 resection[J].Oncol Lett,2017,14(6):6690-6700.
[6] 中华医学会放射肿瘤学分会,中国医师学会放射治疗专业委员会.CT引导放射性125I粒子组织间永久植入治疗肿瘤专家共识[J].中华医学杂志,2017,97(15):1132-1139.
[7] 王一青,朱林海,林旭,等.CT引导下I125粒子植入术对晚期肺癌及肺转移癌的治疗作用[J].中国肺癌杂志,2020,23(6):424-428.
[8] Zhang FJ,Wang JJ,Guo JH,et al.Chinese expert consensus workshop report:Guideline for permanent iodine-125 seed implantation of primary and metastatic lung tumors[J].Thoracic Cancer,2019,10(2):388-394.
[9] 毛晓楠,卢再呜,郭启勇,等.肝脏肿瘤经皮射频消融术后发生肿瘤针道转移的危险性分析[J].中国临床医学影像杂志,2009,20(5):342-344.
[10] Chen W,Sun K,Zheng R,et al. Cancer incidence and mortality in China,2014[J].Chin J Cancer Res,2018,30(1):1-12.
[11] Li J,Zhang LJ,Xie QG,et al.Comparison of clinical efficacy and complications of 125I seed brachytherapy and stereotactic body radiation therapy for recurrent pulmonary metastases from colorectal carcinoma[J].J Contemp Brachytherapy,2018,10(4):360-367.
[12] Dai FH,Wang JY,An HS,et al.Therapy of 125I particles implantation inhibited the local growth of advanced non-small cell lung cancer:A retrospective clinical study[J].Am J Transl Res,2019,11(6):3737-3749.
[13] Van Houdt WJ,Schrijver AM,Cohen-Hallaleh RB,et al.Needle tract seeding following core biopsies in retropefitoneal sarcoma[J].Eur J Surg Oncol,2017,43(9):1740-1745.
[14] Shyamala K,Girish HC,Murgod S.Risk of tumor cell seeding through biopsy and aspiration cytology[J].J Int Soc Prev Community Dent,2014,4(1):5-11.
[15] Robertson EG,Baxter G.Tumour seeding following percutaneous needle biopsy:The real story![J].Clin Radiol,2011,66(11):1007-1014.
[16] Shah KSV,Ethunandan M.Tumour seeding after fine-needle aspiration and core biopsy of the head and neck-a systematic review[J].Br J Oral Maxillofac Surg,2016,54(3):260-265.
[17] Kosugi C,Furuse J,Ishii H,et al.Needle tract implantation of hepatocellular carcinoma and pancreatic carcinoma after ultrasound-guided percutaneous puncture:Clinical and pathologic characteristics and the treatment of needle tract implantation[J].World J Surg,2004,28(1):29-32.
[18] Chang S,Kim SH,Lim HK,et al.Needle tract implantation after percutaneous interventional procedures in hepatoeellular carcinomas;Lessons learned from a 10-year experience[J].Korean J Radiol,2008,9(3):268-274.
[19] 郭立文,俞炎平,江海濤,等.I125粒子植入术后肿瘤针道种植转移的临床观察[J].介入放射学杂志,2018,27(9):870-872.
[20] Tyagi R,Dey P.Needle tract seeding:An avoidable complication[J].Diagn Cytopathol,2014,42(7):636-640.
[21] Wang T,Luo LL,Zhou QH.Risk of pleural recurrence in early stage lung cancer patients after percutaneous transthoracic needle biopsy:A Meta-analysis[J].Sci Rep,2017,16(7):42 762.
[22] Vieri S,Vanessa DC,Massimo F,et al.Isolated chest wall implantation of non-small cell lung cancer after fine-needle aspiration:A case report and review of the literature[J].Tumori,2012,98(5):126e-129e.
[23] Wiksell H,Schassburger KU,Janicijevic M,et al.Prevention of tumour cell dissemination in diagnostic needle procedures[J].Br J Cancer,2010,103(11):1706-1709.
[24] Bai RY,Staedtke V,Xia XW,et al.Prevention of tumor seeding during needle biopsy by chemotherapeutic-releasing gelatin sticks[J].Oncotarget,2017,8(16):25 955-25 962.
[25] Ahn DW,Shim JH,Yoon JH,et al.Treatment and clinical outcome of needle-track seeding from hepatocellular carcinoma[J].Korean J Hepatol,2011,17(2):106-112.
[26] Tarantino L,Francica G,Esposito F,et al.Seeding from hepatocellular carcinoma after percutaneous ablation:Color dopper ultrasound findings[J].Abdom Imaging,2006, 31(1),69-77.
[27] Kim JH,Kim YT,Kim HK,et al.Management for chest wall implantation of non-small cell lung cancer after fine-needle aspiration biopsy[J].Eur J Cardiothorac Surg,2003,23(5):828-832.
(收稿日期:2020-09-03)
