apelin抑制肺动脉平滑肌细胞增殖的分子机制研究
2021-03-24柯蕊肖雪和平张永红张伟刘原
柯蕊 肖雪 和平 张永红 张伟 刘原
【摘要】 目的:明確apelin对PASMC增殖的影响,并探讨相关的分子机制,为肺动脉高压新药的研发提供一定的理论和实验依据。方法:体外培养大鼠PASMC,采用TGF-β1刺激原代PASMC增殖,给予apelin干预,应用Western blot检测细胞中Smad2/3的磷酸化水平以及cyclin D1的蛋白水平,BrdU掺入法检测各组细胞增殖情况。结果:apelin干预组Smad2/3的磷酸化水平低于TGF-β1刺激组(P<0.05)。APJ siRNA转染组Smad2/3的磷酸化水平高于apelin干预组(P<0.05)。apelin干预组cyclin D1蛋白水平低于TGF-β1刺激组(P<0.05)。SB431542干预组cyclin D1蛋白水平高于apelin干预组(P<0.05)。apelin干预组PASMC增殖率低于TGF-β1刺激组(P<0.05)。APJ siRNA转染组、SB431542干预组及cyclin D1 siRNA转染组PASMC增殖率均高于apelin干预组(P<0.05)。结论:apelin可通过与其受体APJ结合,进而调节TGF-β1/Smad/cyclin D1轴抑制PASMC的增殖。apelin对PASMC增殖的抑制作用以及潜在机制为研发新的靶向药物提供了思路。
【关键词】 肺动脉平滑肌细胞 增殖 apelin TGF-β1
Molecular Mechanism of apelin Inhibiting Proliferation of Pulmonary Arterial Smooth Muscle Cells/KE Rui, XIAO Xue, HE Ping, ZHANG Yonghong, ZHANG Wei, LIU Yuan. //Medical Innovation of China, 2021, 18(16): 0-029
[Abstract] Objective: To clarify the effect of apelin on the proliferation of PASMC, and to explore the related molecular mechanism, and to provide a theoretical and experimental basis for the research and development of new drugs for pulmonary hypertension. Method: PASMC was cultured in vitro, and the proliferation of primary PASMC was stimulated by TGF-β1, and apelin intervention was given. The phosphorylation level of Smad2/3 and the protein level of cyclin D1 in the cells were detected by Western blot. BrdU incorporation method was used to detect cell proliferation in each group. Result: The phosphorylation level of Smad2/3 in apelin intervention group was lower than that in TGF-β1 stimulation group (P<0.05). Phosphorylation level of Smad2/3 in APJ siRNA transfection group was higher than that in apelin intervention group (P<0.05). The level of cyclin D1 protein in apelin intervention group was lower than that in TGF-β1 stimulation group (P<0.05). cyclin D1 protein level in SB431542 intervention group was higher than that in apelin intervention group (P<0.05). Proliferation rate of PASMC in apelin intervention group was lower than that in TGF-β1 stimulation group (P<0.05). The proliferation rate of PASMC in APJ siRNA transfection group, SB431542 intervention group and cyclin D1 siRNA transfection group were higher than that in apelin intervention group (P<0.05). Conclusion: apelin can regulate the TGF-β1/Smad/cyclin D1 axis to inhibit the proliferation of PASMC by binding to its receptor APJ. The inhibitory effect of apelin on the proliferation of PASMC and its potential mechanism provide an idea for the development of new targeted drugs.
[Key words] Pulmonary arterial smooth muscle cells Proliferation apelin TGF-β1
First-author’s address: The Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004, China
doi:10.3969/j.issn.1674-4985.2021.16.006
肺动脉高压(pulmonary hypertension,PH)是由多种因素引起的肺血管功能及结构性异常,导致肺血管阻力增加,引发肺动脉压力升高的临床综合征[1]。肺动脉高压的基本发病机制包括肺血管收缩、肺血管重塑以及原位微血栓形成,其中肺血管重塑为最主要的病理机制。目前研究认为,肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMC)增殖在肺血管重塑过程中起着关键性作用[2-3]。因此,深入探讨PASMC增殖的分子信号机制并寻找有效干预靶点,对防治肺动脉高压具有重要意义。
apelin是一种血管活性多肽,其受体为孤儿G蛋白耦联受体-血管紧张素受体AT-1相关的受体蛋白(APJ)。研究发现,apelin及其受体APJ在哺乳动物体内具有广泛的生物学效应,具有抗炎、抑制血管平滑肌细胞增殖、舒张血管、降低血压等作用,在防治血管增殖性疾病中具有重要的研究价值[4-5]。最近研究表明,在肺动脉高压患者的apelin水平较正常人减低[6];给予外源性apelin可抑制PASMC增殖,逆转肺动脉高压动物模型中肺血管重塑,延缓肺动脉高压的发生发展[7-8]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)是具有多向调节功能的生长因子,广泛参与调控细胞的增殖、分化、凋亡以及迁移等[9],且在肺动脉高压的发病中发挥重要作用[10-11]。在非PASMC的研究中发现,apelin可通过抑制TGF-β1信号通路抑制细胞的增殖[12-13]。然而,apelin是否通过抑制TGF-β1信号通路发挥抑制PASMC增殖的作用,目前尚未见报道。本研究将通过TGF-β1刺激原代PASMC增殖,探讨apelin是否抑制TGF-β1诱导的PASMC增殖,并探讨其中的分子机制,以期为防治肺血管重塑及肺动脉高压的策略提供新的靶点,现报道如下。
1 材料与方法
1.1 材料 SD大鼠由西安交通大学医学部实验动物中心提供;DMEM高糖培养基、胎牛血清(FBS)购自美国Gibco公司;TGF-β1购自美国Peprotech公司;apelin多肽购自北京博奥森公司;BrdU细胞增殖检测试剂盒购自中国上海麦约尔生物技术有限公司;Lipofectamine 2000购自美国Invitrogen公司;大鼠APJ siRNA、cyclin D1 siRNA购自中国上海吉玛制药技术有限公司;兔抗大鼠α-SM-actin单克隆抗购自英国Abcam公司;FITC标记的山羊抗兔IgG购自中国中杉金桥生物技术公司;兔抗大鼠p-Smad2/3、t-Smad2/3、cyclin D1单克隆抗体购自美国CST公司;兔抗大鼠GAPDH单克隆抗体、HRP标记抗兔二抗购自美国Sigma公司。
1.2 方法
1.2.1 原代大鼠PASMC的分离及培养 每次选取2只健康SD大鼠,体质量70~80 g,分离并采用组织贴块法培养PASMC,应用抗α-SM-actin免疫荧光染色鉴定其纯度,确保PASMC纯度≥90%。取第3~6代PASMC接种于含10% FBS-DMEM培养基,置于37 ℃,5% CO2培养箱中培养。PASMC分为以下七组:对照组不处理;TGF-β1刺激组加10 ng/mL TGF-β1刺激24 h;apelin干预组预先给予1 nmol/L apelin处理细胞30 min,再加入
10 ng/mL TGF-β1刺激24 h;control siRNA转染组在加入apelin前预先转染control siRNA 24 h,再给予apelin干预30 min及TGF-β1刺激24 h;APJ siRNA 转染组在加入apelin前预先转染APJ siRNA 24 h,再给予apelin干预30 min及TGF-β1刺激24 h;SB431542干预组在加入apelin前预先给予10 μmol/L SB431542作用1 h,再给予apelin干预30 min及TGF-β1刺激24 h;cyclin D1 siRNA轉染组在加入apelin前预先转染cyclin D1 siRNA 24 h,再给予apelin干预30 min及TGF-β1刺激24 h。
1.2.2 细胞转染 采用Lipofectamin 2000试剂盒,待细胞至60%融合,用不含血清的DMEM培养液分别稀释siRNA和Lipofectamin试剂,混合后室温培养20 min后加入细胞,继续培养48 h,提取细胞总蛋白,以免疫印迹方法检测基因沉默效果。
1.2.3 Western blot 细胞收集并使用裂解缓冲液提取细胞总蛋白,采用BCA法检测蛋白浓度。将蛋白定量后95 ℃煮沸10 min变性制样,取等量蛋白上样。运用SDS-PAGE聚丙烯酰胺琼脂糖凝胶电泳进行蛋白分离,浓缩胶中电压80 V,分离胶中电压120 V,直至溴酚蓝接近分离胶的底端停止电泳。含20%的甲醇转印液转印置(100 V,2 h)至PVDF膜上。缓冲液TBST涮洗,5%脱脂牛奶或5% BSA室温下封闭2 h,缓冲液TBST洗膜5 min×3,加入一抗4 ℃孵育过夜。缓冲液TBST洗膜5 min×3,辣根过氧化物酶标记山羊抗鼠、山羊抗兔二抗室温下孵育2 h,缓冲液TBST洗膜5 min×3,ECL显色,结果图像采集,灰度值测定。
1.2.4 BrdU掺入法检测细胞的增殖 应用BrdU试剂盒检测、评价肺动脉平滑肌细胞增殖。细胞培养于96孔细胞培养板,1%小牛血清培养饥饿细胞使其处于静止期,加入TGF-β1刺激细胞增殖。终止细胞培养前8 h加入BrdU继续培养,随后固定细胞、变性DNA、清洗细胞,加入BrdU抗体培养细胞,再次清洗细胞后加入辣根过氧化物酶标记的二抗培养,清洗细胞后加入TMB底物显色,加入反应终止液后用分光光度计测量细胞的吸光度,吸光度的强弱与插入细胞DNA中的BrdU量成正比,从而反映出DNA合成(细胞增殖程度)。
1.3 统计学处理 采用SPSS 13.0统计软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用独立样本t检验,多组见比较采用ANOVA。以P<0.05为差异有统计学意义。
2 结果
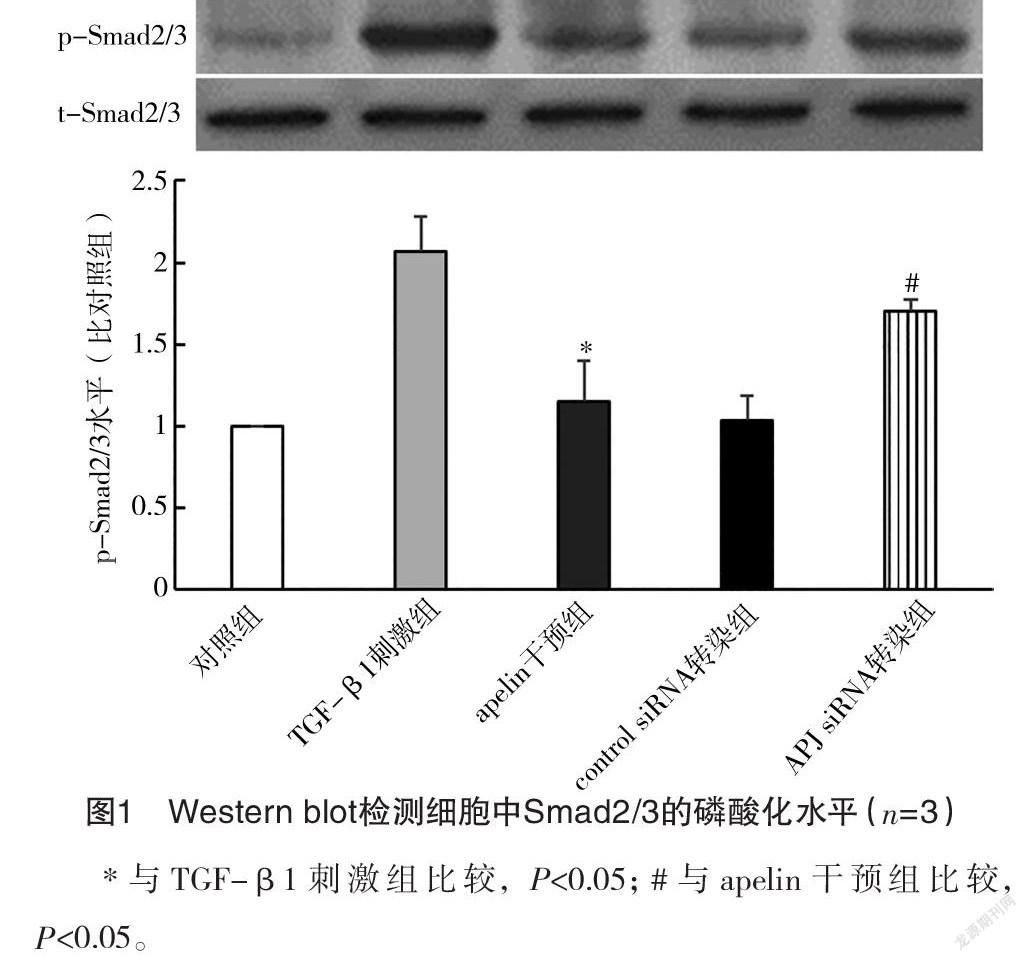
2.1 Western blot检测细胞中Smad2/3的磷酸化水平 TGF-β1刺激组Smad2/3的磷酸化水平为对照组的(2.07±0.21)倍,apelin干预组Smad2/3的磷酸化水平为对照组(1.15±0.24)倍,低于TGF-β1刺激组(P<0.05)。control siRNA组转染Smad2/3的磷酸化水平为对照组的(1.04±0.18)倍,与apelin干预组相比差异无统计学意义(P>0.05),而APJ siRNA转染组Smad2/3的磷酸化水平为对照组的(1.71±0.06)倍,高于apelin干预组(P<0.05),见图1。
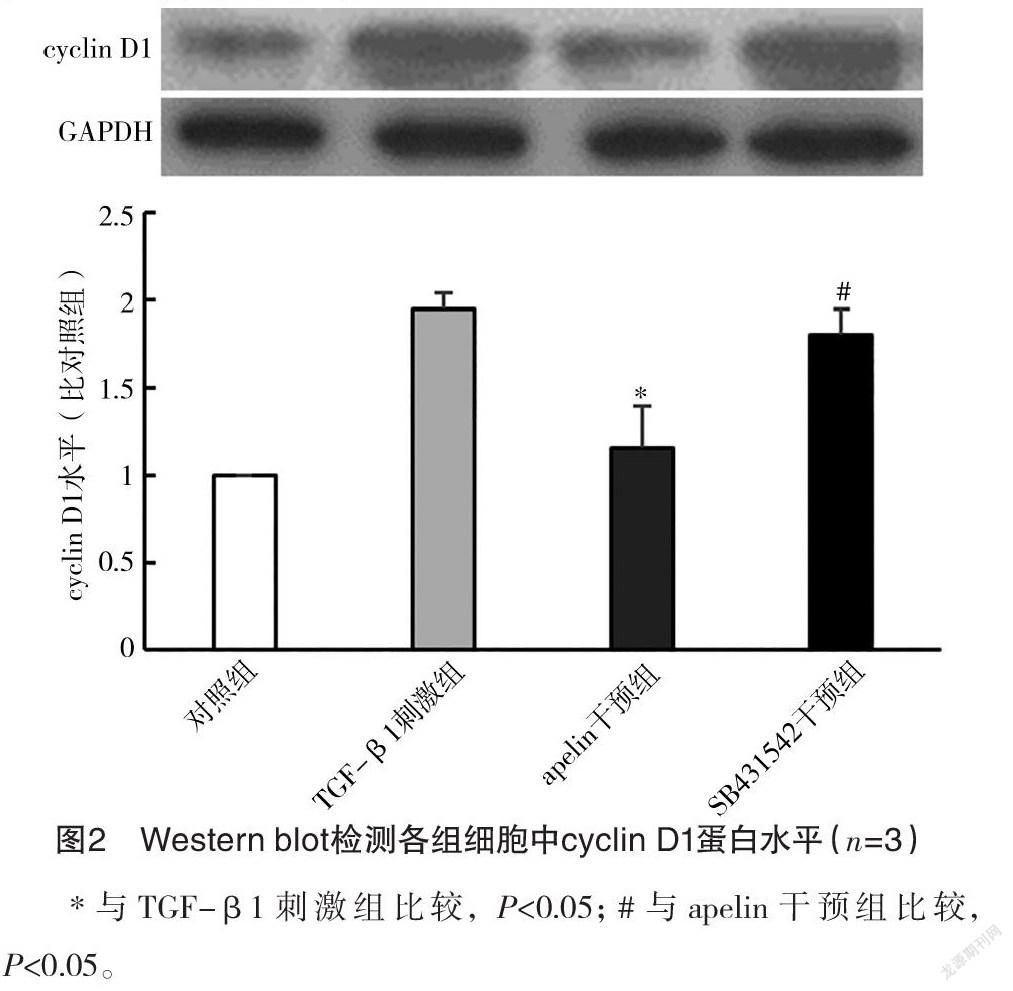
2.2 Western blot检测各组细胞中cyclin D1蛋白水平 TGF-β1刺激组cyclin D1蛋白水平为对照组的(1.94±0.09)倍,apelin干预组cyclin D1蛋白水平为对照组的(1.16±0.25)倍,低于TGF-β1刺激组(P<0.05)。SB431542干预组cyclin D1蛋白水平为对照组的(1.81±0.14)倍,高于apelin干预组(P<0.05),见图2。
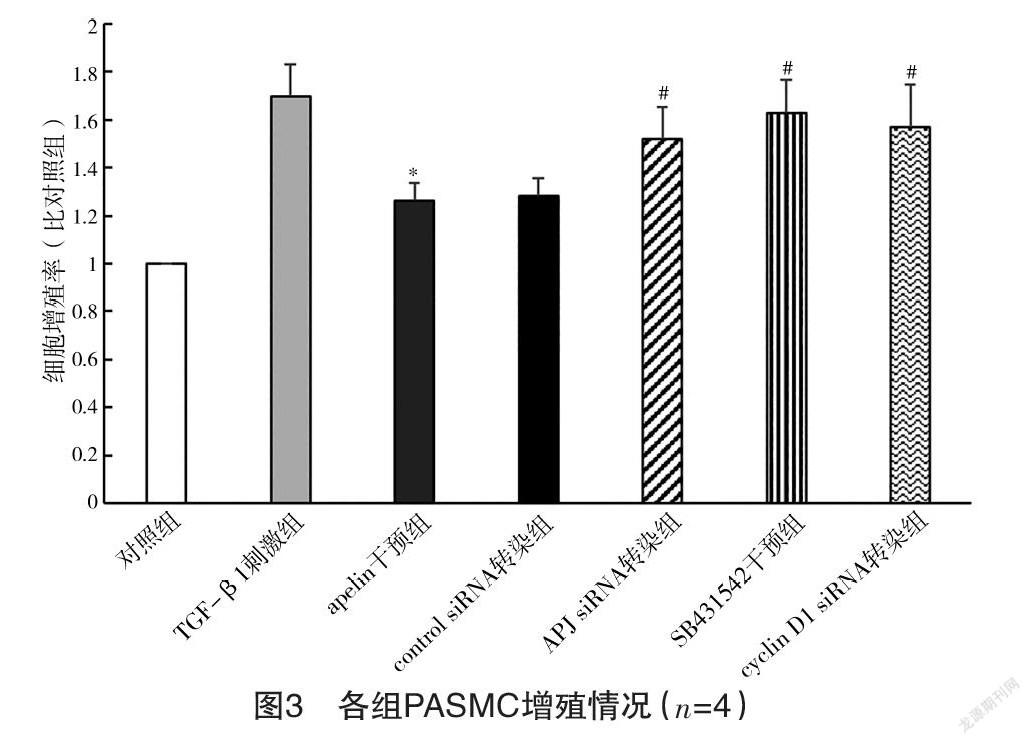
2.3 各组PASMC增殖情况 TGF-β1刺激组PASMC增殖率为对照组的(1.70±0.14)倍,apelin干预组PASMC增殖率为对照组的(1.26±0.07)倍,低于TGF-β1刺激组(P<0.05)。control siRNA转染组PASMC增殖率为对照组的(1.28±0.07)倍,与apelin干预组相比差异无统计学意义(P>0.05);APJ siRNA转染组PASMC增殖率为对照组的(1.52±0.13)倍,高于apelin干预组(P<0.05)。SB431542干预组PASMC增殖率为对照组的(1.63±0.14)倍,高于apelin干预组(P<0.05)。cyclin D1 siRNA转染组PASMC增殖率为对照组的(1.57±0.18)倍,高于apelin干预组(P<0.05)。见图3。
3 讨论
apelin是从牛胃组织中分离出来的一种血管活性多肽,其受体APJ具有7个跨膜单位,与G蛋白耦联。apelin及APJ广泛分布于哺乳动物的多种组织(脑、肺、心脏、血管等)中[14-15]。研究发现,apelin在肺动脉高压患者肺组织及血浆中表达减低,且有望成为肺动脉高压的一个生物标志物[6]。给予肺动脉高压动物外源性apelin可改善肺血管重塑,增强心肌收缩力,延缓肺动脉高压的发生发展[7-8]。
TGF-β1是具有多向调节功能的生长因子,属于TGF-β超家族,广泛参与调控细胞的增殖、分化、凋亡以及迁移等。TGF-β1与其受体结合后可诱导Smad2/3蛋白磷酸化,磷酸化的Smad2/3与Smad4结合形成转录复合物进入细胞核,通过激活细胞核内其他转录因子或抑制DNA转录,调控细胞增殖[16-18]。相关研究发现,在缺氧、野百合碱诱导的肺动脉高压动物模型TGF-β1/Smad信号通路活性明显增强。激活TGF-β1/Smad信号通路可以促进PASMC增殖;而抑制TGF-β1/Smad信号通路,可逆转肺血管重塑及肺动脉高压的形成[19-20]。
本研究发现,apelin可抑制TGF-β1下游Smad2/3活化,下调细胞周期蛋白cyclin D1的蛋白表达,并抑制PASMC的增殖。预先抑制其APJ受体可逆转apelin对Smad2/3活性、cyclin D1蛋白表达以及对PASMC增殖的影响,apelin及apelin介导的信号通路有望成为治疗肺动脉高压的新靶点。本研究发现,预先抑制Smad2/3亦可逆转apelin對cyclin D1蛋白表达以及PASMC增殖的影响;最后抑制cyclin D1可逆转apelin对PASMC增殖的影响。以上结果提示,apelin可通过与其受体APJ结合,进而调节TGF-β1/Smad/cyclin D1轴抑制PASMC的增殖。
肺动脉高压是一种常见的临床综合征,目前的治疗药物虽在一定程度上降低了患者的肺动脉阻力和压力,但这些药物常伴有较明显的不良反应,且治疗费用极为昂贵。近年来的研究表明,apelin可以降低多种肿瘤的发病率以及逆转血管增殖性疾病的血管重塑,在肿瘤及血管增殖性疾病中具有重要的研究价值[14-15]。
本研究证实了apelin对PASMC增殖的抑制作用以及潜在机制,为研发新的靶向药物提供了思路。apelin可能成为治疗肺动脉高压的潜在药物,然而外源性apelin治疗肺动脉高压的有效性、安全性及最佳治疗剂量等问题仍需进一步的试验来验证。
参考文献
[1]中华医学会呼吸病学分会肺栓塞与肺血管病学组,中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会,全国肺栓塞与肺血管病防治协作组,等.中国肺动脉高压诊断与治疗指南(2021版)[J].中华医学杂志,2021,101(1):11-51.
[2] Kim D,George M P.Pulmonary Hypertension[J].Med Clin North Am,2019,103(3):413-423.
[3] Mandras S A,Mehta H S,Vaidya A.Pulmonary Hypertension:A Brief Guide for Clinicians[J].Mayo Clin Proc,2020,95(9):1978-1988.
[4] Antushevich H,Wójcik M.Apelin in disease[J].Clin Chim Acta,2018,483:241-248.
[5] Liu W,Yan J,Pan W,et al.Apelin/Elabela-APJ:a novel therapeutic target in the cardiovascular system[J].Ann Transl Med,2020,8(5):243.
[6] Samareh Fekri M,Etminan A,Rashidnedjad A,et al.Serum Apelin Peptide Level in Hemodialysis Patients With Pulmonary Arterial Hypertension[J].Iran J Kidney Dis,2018,12(4):209-214.
[7] Yang P,Read C,Kuc R E,et al.A novel cyclic biased agonist of the apelin receptor,MM07,is disease modifying in the rat monocrotaline model of pulmonary arterial hypertension[J].Br J Pharmacol,2019,176(9):1206-1221.
[8]苟永英,刘东,李刚,等.外源性Apelin调节自噬对防治大鼠肺动脉高压形成的作用[J].四川大学学报(医学版),2020,51(2):193-199.
[9] Kajdaniuk D,Marek B,Borgiel-Marek H,et al.Transforming growth factorβ1(TGFβ1)in physiology and pathology[J].Endokrynol Pol,2013,64(5):384-396.
[10] Wang J,Feng W,Li F,et al.SphK1/S1P mediates TGF-β1-induced proliferation of pulmonary artery smooth muscle cells and its potential mechanisms[J].Pulm Circ,2019,9(1):2045894018816977.
[11] Guignabert C,Humbert M.Targeting transforming growth factor-βreceptors in pulmonary hypertension[J].Eur Respir J,2021,57(2):2002341.
[12]吴媛媛,孙秀珍,刘昀,等.Apelin抑制小鼠气道平滑肌细胞增殖的作用及机制[J].实用医学杂志,2019,35(2):177-180.
[13] Wang L Y,Diao Z L,Zheng J F,et al.Apelin attenuates TGF-β1-induced epithelial to mesenchymal transition via activation of PKC-εin human renal tubular epithelial cells[J].Peptides,2017,96:44-52.
[14] Yang Y,Lv S Y,Ye W,et al.Apelin/APJ system and cancer[J].Clin Chim Acta,2016,457:112-116.
[15] Luo X,Liu J,Zhou H,et al.Apelin/APJ system:A critical regulator of vascular smooth muscle cell[J].J Cell Physiol,2018,233(7):5180-5188.
[16] Xia W,Lo C M,Poon R Y C,et al.Smad inhibitor induces CSC differentiation for effective chemosensitization in cyclin D1-and TGF-β/Smad-regulated liver cancer stem cell-like cells[J].Oncotarget,2017,8(24):38811-38824.
[17] Zhao Y,Wang L,Wang Y,et al.Astragaloside IV inhibits cell proliferation in vulvar squamous cell carcinoma through the TGF-β/Smad signaling pathway[J].Dermatol Ther,2019,32(4):e12802.
[18] Hu H H,Chen D Q,Wang Y N,et al.New insights into TGF-β/Smad signaling in tissue fibrosis[J].Chem Biol Interact,2018,292:76-83.
[19] Yue Y,Li Y Q,Fu S,et al.Osthole inhibits cell proliferation by regulating the TGF-β1/Smad/p38 signaling pathways in pulmonary arterial smooth muscle cells[J].Biomed Pharmacother,2020,121:109640.
[20] Bellaye P S,Yanagihara T,Granton E,et al.Macitentan reduces progression of TGF-β1-induced pulmonary fibrosis and pulmonary hypertension[J].Eur Respir J,2018,52(2):1701857.
(收稿日期:2021-01-11) (本文編辑:田婧)
