氮形态组成对海洋浮游植物群落结构的影响与动力学研究❋
2021-03-23郜培怡李克强梁生康王修林
郜培怡,李克强,陈 衎,梁生康,王修林
(中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
自1970年代末,随着环莱州湾地区经济高速增长和产业结构等人类活动压力加大,陆源总氮(TN)等污染物入海排放数量逐渐增加,其组成也发生显著变化,导致莱州湾生态环境问题加重[1],包括氮营养盐超标严重[2]、溶解有机态氮(DON)浓度升高[3]、赤潮灾害仍居高位[4]、浮游植物群落结构失衡等[5],是引起海湾水母旺发、渔业资源严重衰竭等生态灾害的重要原因,对环湾经济社会高质量发展形成瓶颈制约[6]。
健康的海洋浮游植物群落结构对海洋生态系统的稳定和平衡具有重要作用,在近海主要受与人类活动有关的陆源营养盐排放的影响,其中,氮营养盐可能是主要的控制要素[7-8],对浮游植物优势种演替具有调控作用[9]。一般而言,浮游植物易于吸收铵氮(NH4-N),因其较硝氮(NO3-N)所需的能量更少[10],但是某些硅藻可能更优先吸收NO3-N[11],NO3-N有利于其繁殖与生长[12]。随着近岸海域DON浓度增加,甲藻或褐藻赤潮也呈现增加趋势,或与其对DON吸收有关[13-14]。不同海域浮游植物对氮的吸收过程存在一定的差异性,如法国南部索潟湖(Thau Lagoon)硅藻水华的爆发主要由NO3-N引起,而鞭毛藻(A.tamarense)水华则主要是由有机态营养盐引发[15],类似现象在拉脱维亚的里加湾(the Gulf of Riga)也有报道,发现在春季硅藻的相对丰度与外源新氮(如NO3-N)的输入相关,而在这之后N会以其他形式(如NH4-N、尿素和DON)循环再产生,即内源再生氮,可能会被鞭毛藻所利用,并且逐渐替代硅藻[16];切萨皮克湾(Chesapeake Bay)浮游植物在春季主要吸收外源新氮(如NO3-N),而在夏季和秋季则主要吸收内源再生氮[17],可能是由于溶解的游离氨基酸是藻类生长的重要组成部分[18],其微小原甲藻(Prorocentrumminimum)优先吸收DON而非NO3-N等无机氮(DIN)[19]。
浮游植物竞争性生长与死亡等生态学过程,与溶解态营养盐吸收、颗粒态降解和溶解有机态再矿化等营养盐动力学过程密切相关[20-21]。其中,营养盐吸收过程通常采用Michaelis-Menten方程表达[22],颗粒态降解和DON的矿化过程可采用一级降解动力学方程来描述[23];浮游植物生长过程可采用Slogistic方程拟合[24-25]。围绕近海营养盐动力学过程或浮游植物生态学过程,采用受控培养实验,利用单过程线性或非线性方法进行动力学方程拟合,已有广泛研究,并获得大量动力学参数[26]。然而,目前多过程的现场实验数据处理方法不够完善,特别是过程发生显著性识别、最佳动力学方程形式甄选、参数率定等连接松散甚至相脱节,不仅有可能误加、遗漏或混淆过程,而且有可能造成参数取值偏差过大[27-28]。单过程动力学往往缺少了不同组分和不同过程之间的联系,而对于多过程非线性动力学方程,从受控培养实验到数据处理方法均明显不足,尽管可采用生态动力学模型,但因模型构架的过程简化和系统综合等特征,对于单过程动力学规律处理略显粗糙[28-29]。
综上,不同形态氮对浮游植物群落结构的影响不同,相关的动力学过程机制也可能不同[9, 30],同时在不同海域其地域性特征差别显著。这样,本文针对莱州湾硅藻向甲藻潜在的种群演替问题,采用船基围隔生态系现场氮加富培养实验,综合应用非线性拟合以及蒙特卡洛灵敏度等方法对多过程实验数据进行处理,研究NO3-N、NH4-N、陆源有机氮和藻源有机氮对海洋浮游植物群落结构的影响。研究结果可为改善莱州湾浮游植物群落结构甚至对消除有毒有害甲藻赤潮等提供一定的科学依据。
1 材料与方法
1.1 研究区域
莱州湾是中国典型的半封闭性陆架海湾(见图1),位于山东半岛西北部、渤海南部,是渤海的三大海湾之一,周边有黄河、小清河、潍河和广利河等10余条河流注入[31],流域面积87 000 km2,其中小清河流域占莱州湾流域总面积的12.2%,以耕地为主,约占流域总面积的58.3%,其次是林地14.9%、建设用地11.4%(主要指城市和工业用地)和草地10.7%。与潍河、胶莱河等农业源为主的入海河流不同,小清河污染物来源较为综合,流域内总氮污染物主要来源于农业非点源、工业源和生活源[32]。小清河流域属温带季风气候,降水变率大,暴雨时小清河携带大量污染物进入莱州湾,成为莱州湾陆源污染物的重要来源[33],也是造成莱州湾湾底河口附近海域水质超标严重的原因,同时伴随着湾底逆时针潮流输送到莱州湾口[34]。
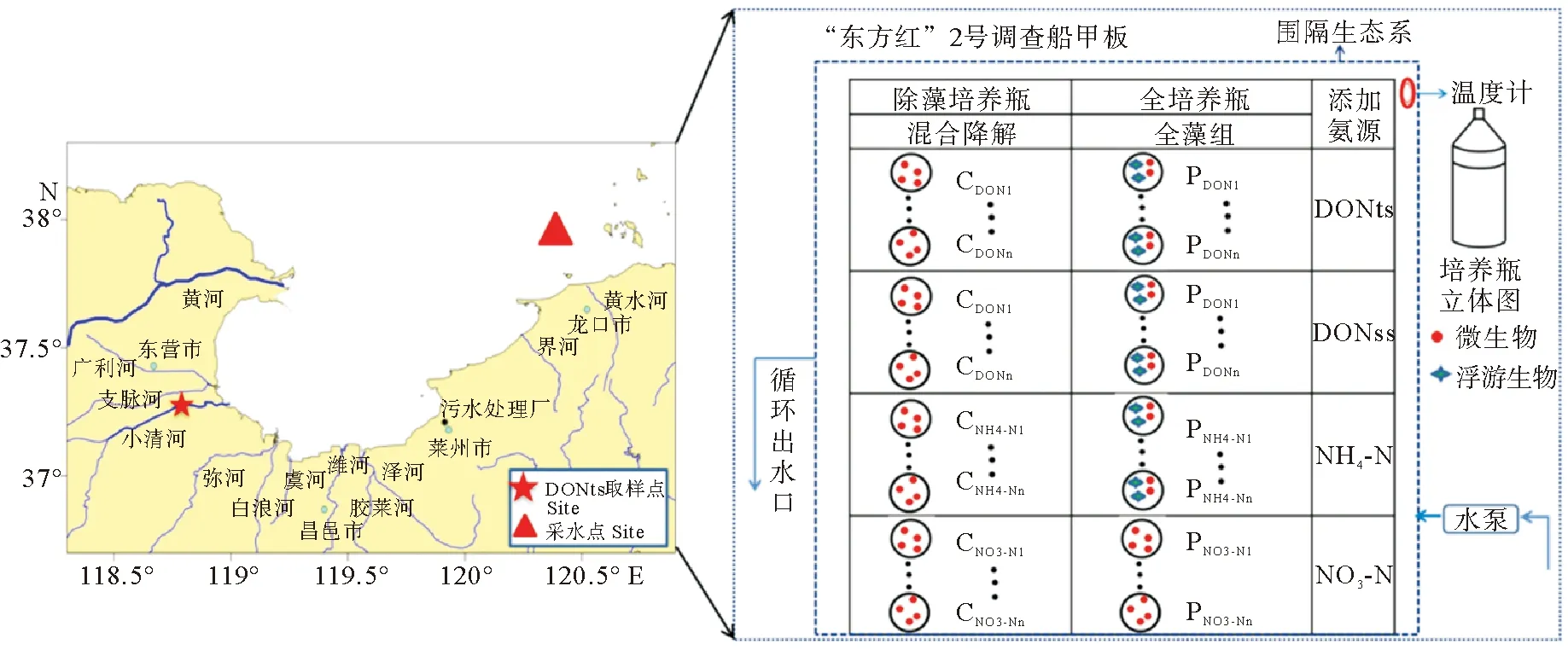
图1 莱州湾船基围隔培养实验采水点及装置
1.2 实验设计
1.2.1 实验设置与实验步骤 不同溶解态氮(DN)加富现场培养实验于2018年8月初(夏季),依托国家自然科学基金委黄渤海共享航次(航次编号:NORC2018-01),在中国海洋大学“东方红2号”科考船后甲板上进行。DN包括NO3-N,NH4-N和DON,其中DON分别选取小清河水样作为陆源DON(DONts)和中肋骨条藻(Skeletonemacostatum)培养过滤藻液作为藻源DON(DONss)。培养实验主要研究浮游植物生长过程和营养盐吸收、代谢和转化的生物地球化学过程和参数。其中,小清河水样中DON浓度为1 556.7 μmol/L,DIN浓度为943.3 μmol/L。陆源DON经800-1000 Da膜(Pall公司切向流)进行浓缩(浓缩比为1∶10),减少无机氮干扰,浓缩后DON浓度为2 385.3 μmol/L,DIN浓度为435.6 μmol/L。中肋骨条藻(S.costatum)培养过滤藻液中DON浓度为52.9 μmol/L,DIN浓度为1.1 μmol/L(未浓缩)。DON样品经0.22 μm 膜过滤处理备用。考虑到培养海水氮营养盐本底浓度要低,同时亦属陆源污染物输入能影响到的区域,培养海水和藻取自莱州湾湾口附近( 38°00′460″N,120°23′489″E),无机氮营养盐浓度约为1.5 μmol/L,数值模型模拟表明,该海域处于莱州湾陆源输入水质响应区范围[35]。取300 L海水过80~100目筛网,0.7 μm膜过滤后放置于大塑料箱,具体浓度值见表1。
16个20 L的培养瓶中瓶中分别加入15 L混匀的现场海水,控制初始藻密度一致,按表2添加营养盐,其中陆源有机氮DONts和藻源有机氮DONss按不同体积添加,保证培养海水体积为15 L。为使P、Si、C的浓度不受限制,在培养实验中添加KH2PO4、Na2SiO3·9H2O和NaHCO3,其他按照f/2微藻培养基[36]添加,分别按照N∶P值4∶1和 Si∶N值2∶1设置初始P和初始Si浓度,氮浓度根据莱州湾海上调查结果设定,DIN和DON的浓度分别约为50和 20 μmol/L。实验设置双样,同时设置藻空白营养盐加富对照培养实验,藻空白实验采用1.2 μm膜过滤处理,并分析DON19矿化过程的影响。培养周期为10 d,取样频次前期1次/天,后期频次逐渐减少,一般固定取样时间为上午9:00。

表1 培养海水营养盐和叶绿素(Chl-a)浓度

表2 现场培养实验方案
1.2.2 样品采集与样品分析方法 实验过程中注意保持好氧环境,取样前先测定水环境的温度和光强数据,然后搅拌实验瓶,使水体混合均匀后取样,水样用GF/F玻璃纤维滤膜(450 ℃灼烧5 h)过滤,滤液及滤膜于-20 ℃保存,带回实验室测量。浮游植物的丰度及藻种分析方法:取培养时间为第0天(初始生物量)和第8天(后期生物量)的50 mL样品,采用鲁哥试剂固定[37],带回实验室在倒置显微镜下鉴定并计数。SiO3-Si、PO4-P、NO3-N、NO2-N、NH4-N、总溶解氮(TDN)、颗粒氮(PN)和叶绿素(Chl-a)浓度根据《海洋调查规范》标准方法,五项营养盐采用自动营养盐分析仪(QuAAtro,Seal,Germany)测定,TDN通过TOC-TN总碳分析仪(Multi N/C3100,Jena,Germany)采用高温氧化方法测定[38]。DON为TDN与DIN的差值。叶绿素的含量采用90%的丙酮在低温4 ℃下萃取24 h,离心10 min后取上清液,然后用紫外分光光度法测定吸光度,按Jeffrey改进的方程式进行计算[38]。
1.3 数据处理方法
1.3.1 实验精密度分析 以双样实验结果的重现性作为实验的可信度,具体采用双样实验结果的相对标准偏差(RSD)评价,以RSD<15%为标准,置信水平α为0.05。实验精度船基现场实验结果显示,双样标准偏差RSD平均是(9.2±2.1)%。
1.3.2 过程发生显著性识别 伴随浮游植物生长,主要发生浮游植物营养盐吸收、DON释放过程,伴随浮游植物死亡,可能主要发生DPN降解、DON矿化等过程,与此同时还有各种转化过程发生。
对于实验变量浓度的变幅与实验精度显著性差异判别,采用Partial Mann-Kendall (PMK)检验方法[39],PMK检验法是基于MK检验的一种条件趋势检验方法,通过去除相关变量对响应变量的潜在趋势影响,来分析待检验的响应变量自身变化趋势的显著性,可以用于实验变量浓度的变化趋势与实验精度的显著性分析。本文采用TN/TDN状态变量作为相关变量,以去除其对响应变量的潜在趋势影响。
PMK和MK检验方法如下:
对于具有n个样本量的时间序列Xt{xi,i= 1, 2, …,n},构造统计量S:
当n>10,用下式计算正态分布的MK统计量:
而对于PMK统计量为:
式中Var(S)为方差,在给定的α置信水平上,如果|Z|≥Z1-α/2,则拒绝原假设,认为序列Xt存在显著的上升或下降趋势,Z的绝对值在大于等于1.28、1.64和2.32时,分别通过了置信度90%、95%、99%的显著性检验。若Z>0,表示呈上升趋势;若Z<0,表示呈下降趋势。PMK检验采用MS Excel©工具进行。
1.3.3 动力学方程 本文采用单组分单过程非线性拟合方法,来拟合莱州湾浮游植物吸收动力过程[40]。主要采用Origin 9和Matlab 2016软件分别对实验结果进行非线性拟合,采用SPSS19软件进行T检验来判别现场实验结果与不同方程形式之间的差异性,采用R2>0.90(P<0.1)衡量两者之间的吻合程度。
对于DON矿化过程,由于DON前期易降解组分消耗后,后期主要以难降解组分存在而变化不大,采用含有难降解组分(CRDON)的一级降解动力学方程[23]:

(1)
对于NH4-N硝化过程,采用一级降解动力学方程[59]:

(2)
式中:kDON_NH4代表DON矿化速率h-1;CRDON代表难降解组分μmol/L;kNH4_NO3代表氨氮硝化速率h-1。
海洋浮游植物生长和营养盐吸收动力学方程一般采用Monod方程,然而在封闭实验体系中,由于浮游植物的呼吸、代谢和死亡等衰亡过程,实测浮游植物浓度变化往往不完全符合Monod方程曲线,这样,如果同时考虑浮游植物生长和死亡过程,浮游植物浓度时间变化应为生长部分减去死亡部分。考虑到低浓度营养盐限制性作用[41],氮营养盐增加了最小吸收阈值参数,而对于多氮的吸收动力学,考虑了铵的吸收及其对硝酸盐吸收的抑制作用,同时为使浮游植物生长和营养盐吸收两个过程氮守恒,数学模型拟合时浮游植物采用PN计量。对于浮游植物生长和死亡过程通常可采用Logistic方程描述[42],这样,在氮吸收过程的同时,增加了叶绿素表征的浮游植物Logistic生长和死亡过程。
其中,针对在NO3-N和NH4-N组下的非线性微分方程为:

(3)
(4)
(5)

(6)
针对DON组下的非线性微分方程为:

(7)

(8)
(9)

(10)
式中:NO3-N,NH4-N,DIN,和DON代表不同氮营养盐的浓度(μmol/L);PN:以氮衡量的浮游植物生物量(μmol/L);kup:营养盐吸收速率(h-1);ksNO3、ksNH4、ksDIN,和ksDON:半饱和常数(μmol/L);NH4in:氨氮限制因子;DNmin(NO3min,NH4min,DINmin, DONmin)为氮的最小浓度阈值(μmol/L);kG:浮游植物生长速率(h-1);kD:浮游植物死亡速率(h-1);kde:碎屑的降解速率(h-1)。非线性拟合程序应用MATLAB (R2015b, MathWorksR)软件开发,算法采用ode45函数,根据最小二乘法拟合动力学参数。
1.3.4 参数灵敏度分析 通过参数灵敏度分析,根据动力学参数对状态变量的灵敏度大小,可识别影响浮游植物生态学过程的关键营养盐动力学过程。其中,针对浮游植物生长、死亡等生态学过程,其动力学参数的灵敏度,采用生物量(Chl-a)为状态变量,针对营养盐动力学过程,其动力学参数的灵敏度,采用浮游植物颗粒态氮(PPN)浓度为状态变量,具体采用状态变量的变异系数(CV)衡量灵敏度大小,应用公式11计算:
(11)
其中:SD为标准方差,取平均值的20%;MV为随机抽取100次的状态变量的平均值。CV>0.5为高灵敏性参数,0.5>CV>0.1为中灵敏性参数,CV<0.1为低灵敏性参数。参数灵敏度分析采用蒙特卡罗(Monte Carlo)法[43],应用ModelMaker4.0软件平台(Cherwell Scientific Ltd.)的Monte Carlo程序包[44]。
2 实验结果与数据处理
2.1 实验结果
2.1.1 浮游植物优势藻种变化 培养实验不同藻种占比结果显示(见表3):莱州湾船基实验培养前海水浮游植物包括了莱州湾典型优势藻种,如角毛藻属(Chaetoceros),丹麦细柱藻(Leptocylindrusdanicusm,3.1%)和刚毛根管藻(Rhizosoleniasetigera)和膝沟藻(Gonyaulax)等[45-46],优势种主要有硅藻门中5个属的5个藻种,分别是斯氏几内亚藻(Gossleriellastriata,52.8%),其次为条纹小环藻(Cyclotellastriata,10.8%),丹麦细柱藻(L.danicusm,3.1%),密连角毛藻(Chaetocerosdensus,2.2%)和刚毛根管藻(R.setigera,2.0%)。在添加不同营养盐的条件下,浮游植物优势藻种类型发生了改变,同一培养条件下双样重现性为85.7%,而不同培养条件差异显著,显示出浮游植物群落组成对营养盐响应的多样性和各向异性。在4组加富DN现场实验中,优势藻种共有硅藻门5个属的5个藻种和甲藻门的春膝沟藻(Gonyaulaxverior)1个藻种,平均优势度(Y)按密连角毛藻(C.densus,24.4%)、春膝沟藻(G.verior,16.3%)、丹麦细柱藻(L.danicusm,15.4%)、舟形藻(Naviculaspp.,15.1%)、条纹小环藻(C.striata,11.0%)和特殊双壁藻(Diploneisnootabilis,2.2%)依次递减(见表3)。具体讲,在加富陆源溶解有机氮(DONts)条件下,优势种群主要由密连角毛藻(57.4%)、条纹小环藻(28.3%)、丹麦细柱藻(4.9%)、斯氏几内亚藻(2.08%)等组成,他们分别隶属于硅藻门的4个属;在加富藻源溶解有机氮(DONss)条件下,优势种群主要由甲藻门的春膝沟藻(60.2%)以及硅藻门的密连角毛藻(20.5%)和条纹小环藻(2.0%)等组成;在加富NH4-N条件下,优势种群主要有甲藻门的春膝沟藻(5.0%)与硅藻门的3个属的3个藻种:丹麦细柱藻(56.6%)、条纹小环藻(15.6%)和密连角毛藻(2.8%)等组成;在加富NO3-N条件下,优势种群主要由舟形藻(60.4%)、密连角毛藻(16.7%)、特殊双壁藻(8.8%)等组成,他们隶属于硅藻门的3个属。这说明,对于莱州湾优势藻种组成,NO3-N、NH4-N和 DONts似乎有利于舟形藻、丹麦细柱藻和角毛藻等硅藻的生长,DONss似乎有利于春膝沟藻等甲藻生长,与Crandall和Tzilkowski研究结果[13-14]相吻合。综上所述,莱州湾浮游植物优势种与DN组成密切关联,与袁琪等报道的浮游植物种类与N/P含量密切相关相吻合[47]。应当指出,由于取样第8天处于浮游植物生长阶段的后期,不能代表浮游植物群落结构的最大优势度,仅能指示浮游植物群落结构的演替趋势。
2.1.2 叶绿素和营养盐浓度变化 除DONss加富实验组外,Chl-a浓度均约在第24 h进入指数生长期,到100 h达到平台期,维持30 h左右进入死亡期,符合S型变化规律(见图2)。而DONss加富实验组Chla浓度滞后48 h以后才进入指数生长期,到120 h达到平台期,维持20 h左右进入死亡期,这可能与DONss加富实验组的优势甲藻(春膝沟藻,60%)生长过程不同于其它实验组的优势硅藻的生长过程有关。在整个浮游植物生长期,颗粒有机氮(TPN)浓度的增长趋势与Chl-a浓度的变化趋势基本同步,但在死亡期差异显著,其中,DONss和NO3加富实验组TPN与Chl-a浓度变化基本一致,而DONts和NH4加富实验组TPN变化滞后于Chl-a浓度变化。溶解态氮营养盐中,添加的营养盐随时间变化基本上在浮游植物生长期下降,死亡期略有增加,但DONts加富实验组与DONss加富实验组氮吸收过程存在差异性。其中,DONts浓度变化不同于DONss,也不同于无机态氮的迅速下降,而是滞后48 h快速下降,与此同时DONts加富实验组NH4-N和NO3-N浓度在藻指数生长期则迅速下降,不同于DONss加富实验组的增加,NO2-N浓度处于相对活跃的状态。这说明,DONts加富实验组可能存在DON的矿化过程,并伴随NH4-N通过NO2-N氧化为NO3-N的硝化过程,而DONss加富实验组则主要是藻吸收过程。伴随藻死亡,特别是TPN浓度降低,实验过程中DON浓度升高,随之NO3-N浓度升高,有可能存在DON的释放、DPN的降解和硝化过程等。添加的PO4-P和SiO4-Si浓度变化与氮基本一致,在浮游植物生长期下降,死亡期略有升高,其中SiO4-Si对藻生长没有限制,而PO4-P在浮游植物生长的后期基本耗尽,有可能与氮营养盐共同限制了藻的生长(见图2)。

表3 不同加富N实验下的不同藻种占比


图2 营养盐加富培养实验叶绿素和营养盐浓度变化
DONts与DONss藻空白对照实验中,DONts与DONss浓度整体呈现先快速下降,而后在第96 h左右开始缓慢下降,DIN浓度则与之相反(见图3),其中DONts藻空白对照组中的氨氮以及亚硝氮浓度在24~72 h期间都出现了短暂的增加随后又开始下降,与DONss藻空白对照组的一致,说明DON矿化为氨氮之后,后续还发生了氨氮硝化为亚硝,并进一步氧化为硝氮等过程。NH4-N藻空白对照实验,伴随着氨氮浓度的降低,硝氮浓度整体呈现上升的趋势,并且在第9天左右达到最大值,NO2-N浓度呈现活跃状态,这说明发生了NH4-N通过NO2-N并进一步氧化为NO3-N的硝化过程(见图3)。NO3-N藻空白对照实验,硝氮浓度在前48 h呈现出缓慢下降的趋势,但在这之后随着氨氮浓度的下降,硝氮浓度又开始逐渐上升,并且在72 h之后开始平稳波动,整体的下降趋势不明显(见图3)。
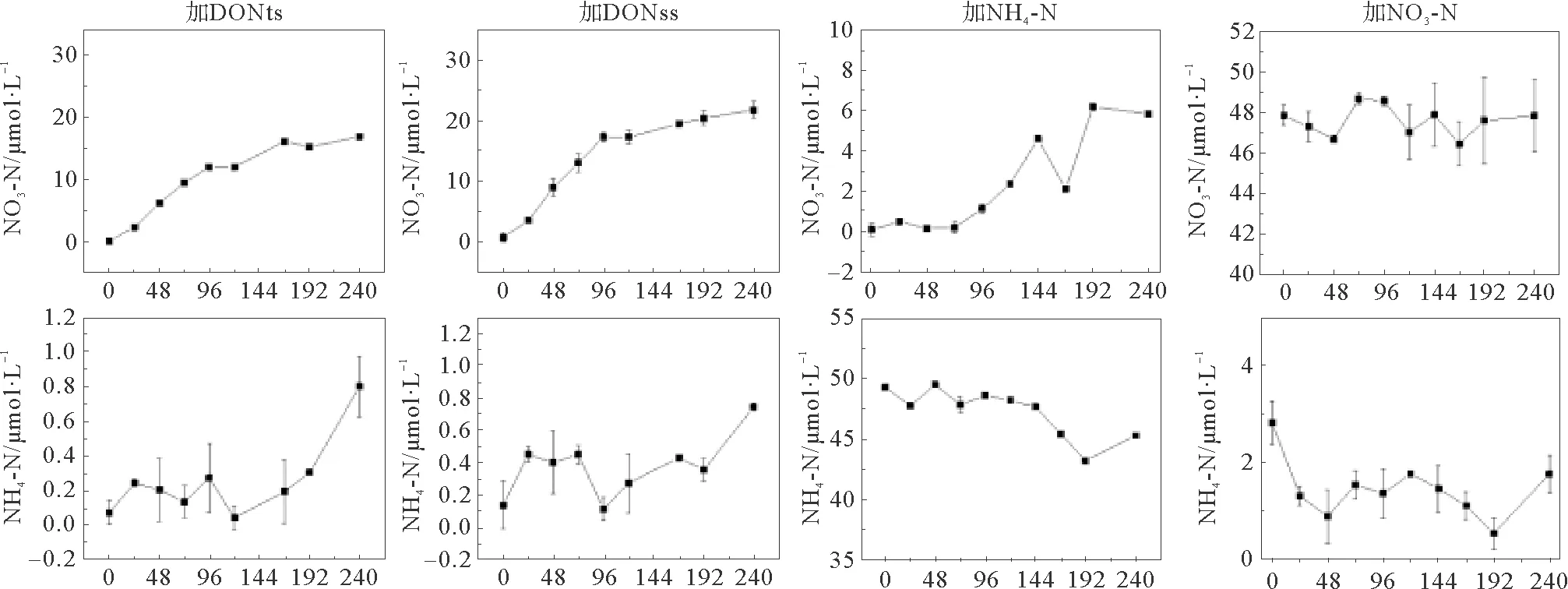
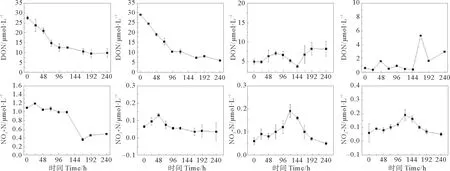
图3 藻空白对照培养实验DN浓度变化
2.2 动力学过程与参数
2.2.1 过程发生显著性识别 根据PMK检验结果(见图4),DONts,DONss,NH4与NO3组的生长过程的显著性分别为Z=2.06,1.98,2.29,2.33,都通过了95%的置信度检验,而四个添加组分中的死亡过程的显著性分别为Z=-1.35 -1.35,-1.98,-1.92,分别通过了90%的置信度检验与95%的置信度检验。而伴随浮游植物生长与死亡的营养盐转化过程中,溶解态氮(DN)吸收、DON的释放、和DPN的降解过程都比较显著(Z=1.38),平均通过了90%的置信度检验。对于四个添加组分的实验而言,不同过程的显著性有差异。在加富NO3-N组,DN的吸收主要以NO3-N的吸收为主(Z=-2.74,P<0.01);同样地,在加富NH4-N组,DONts组和DONss组分别以NH4的吸收(Z=-2.33,P<0.01)与DON的吸收过程为主(Z=-1.64,-1.82)。但是在DONss组对DON的吸收过程的显著性(Z=-1.82,P<0.05)大于DONts组的(Z=-1.64,P<0.05),说明两个实验组对DON的吸收存在差异。此外,DPN的降解过程也显著发生(Z=-1.49,-1.49,-1.92,-1.76),平均通过了95%的置信度检验。直转过程中,DONts矿化过程非常显著(Z=-2.87,P<0.01),而且DONts矿化过程大于DONss的矿化过程(Z=-1.55,P<0.1);NH4-N硝化也很显著(Z=-2.46,P<0.01),但是NO3-N反硝化过程不明显(Z=-0.45,P>0.1)。
2.2.2 动力学方程拟合 采用最小二乘法非线性拟合技术,应用Matlab软件,可得到在不同实验条件下海洋浮游植物生长和营养盐吸收动力学拟合曲线(见图5),其中,无机态营养盐组实验采用非线性微分方程式(3)至(6)来拟合,有机态营养盐组采用方程式(7)至(10)拟合,与实验数据存在较好的相关性,主要变量的模拟相似性系数(SI)均在0.8以上,相对标准偏差(RSD)均在20%以内(见图6),进而可得到相应参数(见表4)。其中,浮游植物生长速率常数按照NO3-N>DONts>DONss>NH4-N(P<0.05)变化,分别为0.053,0.030,0.029和0.028 h-1,而吸收速率按照NO3-N>NH4-N>DONss>DONts(P>0.05)变化,分别为0.049,0.021,0.020和0.012 h-1,同时单一氮源加富下的N半饱和常数按照DONss

(黑、红、蓝虚线分别代表z=1.28(a=0.1)、z=1.64(a=0.05)、z=2.32(a=0.01)。The black, red and blue dashed lines represent z=1.28 (a=0.1), z=1.64 (a=0.05) and z=2.32 (a=0.01), respectively.)

图5 浮游植物生长与吸收动力学拟合曲线

表4 浮游植物生长、死亡和养分吸收的动力学参数
对于藻空白对照实验,主要包括DON矿化和NH4-N硝化过程(见图7)。对于DONts和DONss的矿化速率无显著性差异(P>0.5),均为0.014 h-1(见表5)。但是难降解物质(RDON)分别为8.63和4.83 μmol/L。而的氨氮的硝化速率为0.009 h-1(见表5)。

图6 非线性拟合结果评价的泰勒图

表5 矿化以及氨氮硝化过程动力学参数
3 讨论
氮营养盐吸收动力学是浮游植物生长等生态学过程的关键过程,表现为不同氮形态加富培养实验中,均显示氮吸收速率常数对浮游植物颗粒氮浓度变化呈高灵敏度性(见图8),说明本研究的浮游植物生长和演替等生态学过程主要受营养盐吸收过程控制。进一步分析表明,DONss的半饱和常数(0.25 μmol/L)显著低于NH4-N(0.86 μmol/L)和NO3-N(0.91 μmol/L)的,而DONTS的半饱和常数(1.05 μmol/L)却较DIN的半饱和常数略高,表现为甲藻对DONss较强的亲和力,硅藻对DIN较强的亲和力[48-49]。事实上,DONTS加富培养实验组中,优势藻为密连角毛藻(C.densus),与NH4-N和NO3-N等DIN培养实验组的丹麦细柱藻(L.danicusm)和舟形藻(Naviculaspp.),在硅藻门类上一致,这也与硅藻更易于吸收无机态营养盐的一般认识一致[11-12,50-51],而DONss加富培养实验组中,优势藻为甲藻的春膝沟藻(G.verior),与甲藻能够吸收DON,并易于在DON为氮源下成为优势藻的认识一致[13,52-54]。然而,相关的机制仍有待深入研究,可能与浮游植物营养盐储存[55]、代谢和生理机能[56]有关。
在DON加富培养的两组实验中,由于DON可以作为浮游植物生长的氮库,DON的吸收和矿化速率都会对浮游植物生长有影响。其中,DONTS加富培养实验组,除去浮游植物生长和死亡速率常数对生物量高灵敏性外,DON吸收速率常数、矿化速率常数和DIN吸收半饱和常数均表现为对浮游植物颗粒氮浓度变化的高灵敏度性,硝化速率常数也较为灵敏(CV=0.48),而DON吸收半饱和常数却显示低灵敏度性(见图8),这说明陆域外来的生活源DON可能是通过矿化、硝化等动力学过程转化为NO3-N后,再被浮游植物吸收利用。这点与现场培养实验结果中,浮游植物指数生长期NO3-N和NH4-N浓度下降,NO2-N浓度保持较高水平,而DON浓度滞后2天才开始下降的现象一致,特别在动力学上,与DON矿化速率常数(28 ℃条件下同,0.014 h-1)大于DON浮游植物吸收速率常数(0.012 h-1)一致。研究表明,DON的矿化会促进以硅藻为主的浮游植物生长[57],本文DONTS加富培养实验组中,优势藻为密连角毛藻(C.densus)等硅藻群落,可能是由于DONTS通过矿化转化为DIN,促进了硅藻的生长而成为优势种[58]。而DONSS加富培养实验组,DON吸收速率常数、半饱和常数、硝化速率常数和颗粒态氮降解速率常数均表现为对浮游植物颗粒氮浓度变化的高灵敏度性(见图8),说明藻源DON可能主要通过直接吸收过程被浮游植物利用。这与现场培养实验结果中,浮游植物指数生长期DON浓度迅速下降,而DIN(NO3-N、NO2-N和NH4-N)浓度基本不变等现象一致,特别是在动力学上,与DON浮游植物吸收速率常数(0.020 h-1)大于DON矿化速率常数(0.014 h-1)也基本一致。DONss的氮源来自中肋骨条藻(S.costatum)培养液,可能是由于其生长过程中释放的游离(DFAA)和溶解氨基酸(DCAA)含量较高,春膝沟藻(G.verior)等甲藻可以直接吸收或吞噬这些内源DON[59],而演替成为优势藻[60-61]。

图8 灵敏度分析结果(CV)
综上,硅藻在生长和死亡生理功能上,可能更适应一般的海洋环境,这也是海洋相当区域和时间上,浮游植物以硅藻为优势藻[62],而甲藻则在特定条件下,如无机态营养盐缺乏且以DON为氮源环境中,特别在春季末硅藻藻华后而成为优势藻,但持续时间短,其他时间或季节又会以硅藻为主[63]。
4 结论
本文通过氮加富现场培养实验,利用实验数据进行的非线性拟合和灵敏度分析,得出如下结论:
(1)陆源DON培养实验组中,优势藻为密连角毛藻(C.densus),与NH4-N和NO3-N等DIN培养实验组下的优势种即丹麦细柱藻(L.danicusm)和舟形藻(Naviculaspp.),在硅藻门类上一致,说明硅藻更易于吸收无机态营养盐,而海上藻源DON培养实验组中,优势藻为甲藻的春膝沟藻(G.verior),说明甲藻能够吸收DON,并易于在DON为氮源下成为优势藻。
(2)营养盐吸收动力学速率常数对于浮游植物颗粒态氮的变化显示高灵敏性,说明浮游植物生长等生态学过程主要受营养盐吸收过程控制。
(3)陆源DON的矿化速率常数大于其浮游植物吸收速率常数,而藻源DON的浮游植物吸收速率常数大于其矿化速率常数,陆源DON的矿化速率常数表现为对浮游植物颗粒态氮的高灵敏性。说明陆源DON可能是通过矿化、硝化等动力学过程转化为NO3-N后,再被浮游植物吸收利用,而藻源DON主要是通过直接吸收过程被浮游植物利用,形成了甲藻与硅藻不同的培养体系优势种群。
