不同类型Zn胁迫对1株好氧反硝化细菌功能影响的比较研究❋
2021-03-23吴春晗赵阳国任朝萌孙鹏飞李岿然
吴春晗, 白 洁,2, 赵阳国,2, 任朝萌, 陈 琳, 孙鹏飞, 李岿然
(1. 中国海洋大学环境科学与工程学院,山东 青岛 266100; 2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;3. 中国海洋大学海洋生命学院,山东 青岛 266003)
重金属是常见的一类污染物,进入水环境后大多会在水体底部聚集[1]。重金属及其化合物在环境中难以自然降解,易在环境中累积,通过食物链传递最终威胁到人类健康[2]。含有重金属污染物的工业废水被大量排入海洋、湖泊等水环境中,导致水环境污染状况日趋严重,对水生生物的生长发育产生不良影响[1-2]。
Zn是一种常见的重金属,是生物体生长的一种必需元素,其含量过低或过高都会对生物的生长产生影响[3]。近年来我国近海海域的Zn污染在加剧,如对长江口附近海域的监测表明:由于沿江工厂‘三废’的直接排放,导致水体中受到多种重金属不同程度的污染,其中Zn和Cu浓度最高[4]。海洋沉积物环境质量对评价水环境重金属污染程度具有指示作用[5],而数据显示大连湾沉积物多种重金属浓度都严重超标;2012年监测数据显示渤海湾锦州区域的底泥中重金属Zn超标高达150倍以上;胶州湾是受人类生产、生活影响较大的近岸海湾,污染情况较其它远海海域严重[6],2018年监测数据表明胶州湾表层沉积物Zn浓度达到了104 mg·kg-1,远远高于红海湾,较1980年增长了1.98倍,由此可见,近海海湾重金属Zn的污染程度已不容忽视[7-9]。
普通ZnO、ZnO-NPs和ZnSO4这3种Zn化合物作为无机锌添加剂被广泛应用于生物饲料中,由于残留率较高、生物利用率较低,只有少部分锌可以被生物体吸收,其余大部分都会以粪便形式排出体外,最终随废水流入近海环境,对沉积物中的微生物产生影响[10]。目前针对这3种锌化合物对微生物的毒性研究多集中在单一锌化合物对不同微生物产生的毒性效应及机制的探究,ZnO-NPs对微生物的毒性受浓度、粒径、比表面积以及复合改性等多种因素的影响[11-12],研究表明ZnO-NPs可显著降低好氧反硝化细菌及典型厌氧反硝化菌的脱氮效率,促进胞外聚合物(Extracellular polymeric substances,EPS)的产生,抑制反硝化相关的酶活性,因ZnO-NPs比表面积大可与细菌产生作用,从而造成的微生物表面物理损伤被认为是其主要作用机制[13-15];ZnSO4毒性效应主要是其溶解后释放游离态的锌离子,锌离子能够破坏细菌的细胞膜,通过与细胞膜主要成分蛋白质上的基团发生反应,进入细胞内部,使细菌的电子传递系统的相关酶遭到破坏,从而影响菌体结构和生理活性,最终导致细菌死亡。菌膜破裂后锌离子还可以继续毒害其余细胞,循环往复的对细菌产生毒性[16]。Gui等人发现浓度高于20 mg·L-1的锌离子可使好氧反硝化菌株PseudomonasstutzeriPCN-1好氧反硝化活性显著下降,导致反硝化相关的nosZ基因和cnoB基因表达延时[17]。也有研究结果表明,浓度低于10 mg·L-1的锌离子对微生物厌氧氨氧化过程有一定的促进作用[18];普通ZnO的抑菌作用主要是由于其对细菌的亲和力较强,可通过抑制细菌纤维蛋白形成而减弱其繁殖能力[19]。然而,各无机锌化合物对同一种微生物作用差异的比较却少有研究。
高浓度的重金属Zn会对底泥微生物产生毒害作用,重金属Zn主要会与微生物酶的活性及非活性中心相结合,从而抑制其活性,导致微生物功能下降[20],进而对近海沉积物环境中的物质循环产生影响。微生物是生态系统最基本的一环,对维持近海生态系统稳定有重要意义。结构简单的细菌是良好的染毒实验模式生物[21],好氧反硝化细菌更是在海洋氮素循环中发挥着不可替代的作用[22],其数量占沉积物细菌总量的20%[23]。
本文以1株筛自胶州湾沉积物中的好氧反硝化细菌为研究对象,通过实验室模拟实验,比较研究了分别在3种不同类型含Zn化合物胁迫下该菌株生长及脱氮能力的变化。研究结果可为探讨不同类型含Zn化合物对好氧反硝化菌生长和脱氮功能的影响及作用机制提供依据。
1 材料与方法
1.1 菌种及培养基
培养基组成(g·L-1)[24]:KH2PO41.5;Na2HPO47.9;丁二酸钠 6.79;MgSO4·7H2O 0.01;NH4Cl 0.268 6;NaNO30.426 8;NaCl 35;2 mL微量元素溶液;1 000 mL去离子水。
微量元素溶液包含(g·L-1):Na2EDTA 63.70;ZnSO42.2;CaCl25.5;MnCl2·4H2O 5.06;CuSO4·5H2O 1.57;FeSO4·7H2O 5.0; CoCl2·6H2O 1.61; Na2MoO4·4H2O 1.1。
1.2 不同类型锌胁迫实验
本研究选用普通ZnO、ZnO-NPs和ZnSO43种类型锌进行实验,根据预实验菌株的效应浓度结果,每一种设置5个浓度,分别为0、5、20、50和200 mg·L-1。每个浓度设置3个胁迫实验平行样,其中0 mg·L-1为空白对照,5 mg·L-1为低浓度组,20和50 mg·L-1为中浓度组,200 mg·L-1为高浓度组。
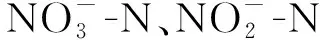
1.3 测定方法
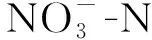
去除率=(1-取样时被测指标质量浓度/被测指标初始质量浓度)×100%。
为了减少耐药菌的产生,并保持ZITHROMAX和其他抗菌药的有效性,ZITHROMAX应仅用于治疗经证实或高度怀疑由敏感菌引起的感染。当培养并获得敏感性资料时,应考虑选择或调整抗菌治疗。在缺乏这些数据的情况下,当地流行病学和敏感性模式可能有助于治疗的经验性选择。
实验所用的纳米氧化锌(ZnO-NPs)购自美国SIGMA公司,粒径<50 nm,纯度>99.7%。
1.4 数据处理
数据结果取平均值±标准偏差表示,采用SPSS Statistics软件进行单因素方差分析(ANOVA),显著水平P<0.05,绘图采用 Origin软件。
2 结果与分析
2.1 不同类型锌对菌株生长的影响
2.1.1不同浓度ZnO-NPs对菌株生长的影响 为避免光催化效应引起的抑菌效应,本研究在避光条件下将菌株暴露于不同浓度的ZnO-NPs,测定细菌生长量(见图1)。
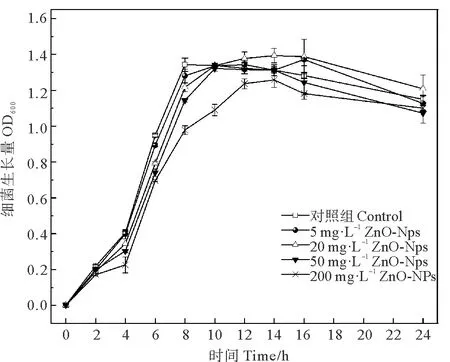
图1 不同浓度ZnO-NPs对菌株生长的影响
低、中浓度ZnO-NPs胁迫组与对照组生长趋势基本一致,在暴露8 h后,OD600都达到了1.2左右,并无显著差异(P>0.05);低浓度ZnO-NPs胁迫组对菌株生长还有轻微的促进作用,在16 h时达到OD600的极大值1.37,高于对照组;高浓度ZnO-NPs胁迫组在暴露过程中菌株生长速率始终低于其余各浓度组,在8 h时,菌株OD600值仅为0.978,较其他各浓度组生长速率稍慢;20 mg·L-1胁迫组极大值为1.4,50 mg·L-1胁迫组极大值为1.33,而200 mg·L-1胁迫组OD600的极大值也低于其他各浓度组,仅为1.2;高浓度ZnO-NPs胁迫组的生长平台期较短,仅在12~14 h之间,随后很快就进入了衰亡期,其余各浓度组的平台期都维持在6~8 h,这可能是由于ZnO-NPs造成菌株表面损伤使细胞死亡数目增多,而OD600值仅反映培养液的浊度,并不代表活细菌数目。死亡的细菌经过一段时间后裂解,造成OD600值快速下降,从而使高浓度胁迫组的平台期较短。Brayner等的研究也发现ZnO-NPs通过与大肠杆菌表面作用,会使大肠杆菌细胞壁解体,进而造成细胞裂解死亡[13]。由此可见,随浓度升高,ZnO-NPs对菌株的生长呈现出一定的抑制趋势。
2.1.2 不同浓度普通ZnO对菌株生长的影响 不同浓度的普通ZnO对菌株的生长并无显著影响(P>0.05)(见图2),当ZnO胁迫组浓度低于20 mg·L-1时,菌株的生长趋势与对照组基本一致;当ZnO胁迫组浓度为50 和200 mg·L-1时,在暴露4 h后的生长速率相比于其他各浓度组较低,在8 h差异最为明显,对照组、5和20 mg·L-1ZnO胁迫组的OD600值分别为1.13、1.22、1.19;50和200 mg·L-1胁迫组的OD600值分别为0.89、0.91,但在暴露16 h后有所恢复,逐渐与其他各浓度组趋于一致。由此可见浓度低于20 mg·L-1的普通ZnO对菌株生长并无显著影响(P>0.05),当浓度升至50 mg·L-1以上时,会使处于对数生长期的菌株生长速率变慢,平台期抑制作用减弱生长速率恢复。
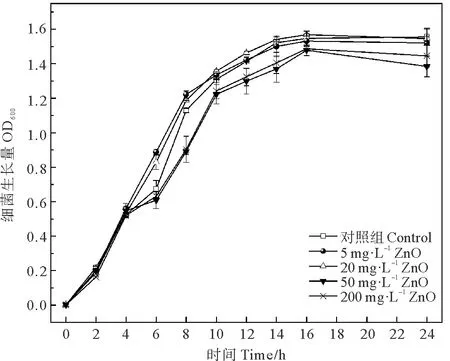
图2 不同浓度ZnO对菌株生长的影响
2.1.3 不同浓度ZnSO4对菌株生长的影响 Zn2+作为菌株生长必须的微量元素,其浓度过高或低都会对菌株产生一定的影响(见图3)。在暴露前4 h各ZnSO4胁迫组与对照组菌体的生长量及生长速率几乎相同,但在6 h时开始出现差异,50和200 mg·L-1胁迫组生长速率较对照组稍慢,随暴露时间延长,50 mg·L-1ZnSO4胁迫组菌株生长量速率逐渐恢复,与对照组无显著差异(P>0.05),但200 mg·L-1ZnSO4胁迫组的生长速率始终低于其他各组;对照组OD600极大值达到1.57,但200 mg·L-1ZnSO4胁迫组OD600最高仅为1.35,5 mg·L-1ZnSO4胁迫组在暴露整个过程中生长速率始终高于对照组,对菌株生长表现出一定的促进作用。由此可见,不同浓度ZnSO4对菌株Zobellellasp.B307影响不同,低于5 mg·L-1浓度的ZnSO4可一定程度提高菌株生长速率,20和50 mg·L-1ZnSO4胁迫组对菌株生长并无显著影响(P>0.05),200 mg·L-1ZnSO4胁迫组在整个暴露过程中减慢了菌株的生长速率,暴露14 h后抑制作用逐渐减弱,这可能是由于随时间延长,菌株对Zn2+产生了适应能力,导致其毒性降低[26]。杨旸等的研究也指出,ZnSO4可抑制变异链球菌的生长,但对其并不产生杀灭作用[27]。
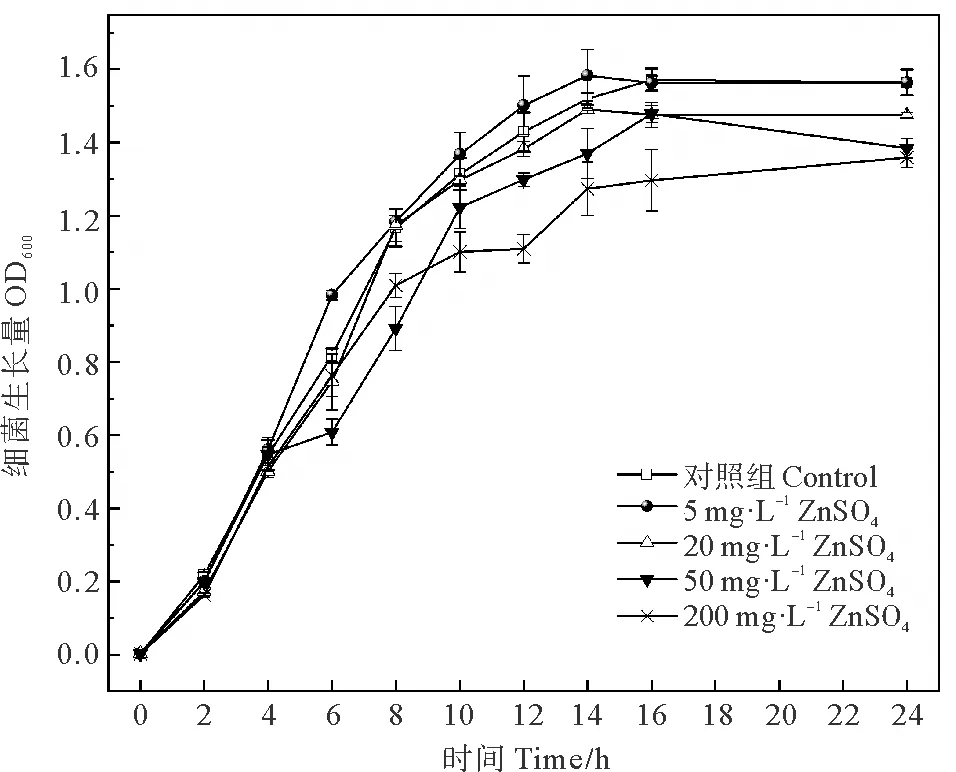
图3 不同浓度ZnSO4对菌株生长的影响
2.2 不同类型锌对菌株硝态氮去除率的影响
2.2.1 不同浓度ZnO-NPs对菌株硝态氮去除率的影响 不同浓度ZnO-NPs对菌株硝态氮去除率的影响如图4所示。在避光条件下,低浓度的ZnO-NPs胁迫组一定程度提高了菌株硝态氮去除率,在16 h时5 mg·L-1胁迫组去除率达到了98.26%,对照组此时为94.94%,这可能是由于低浓度ZnO-NPs促进菌株生长,使细菌密度提高,进而提高了硝态氮的去除效率;在暴露前8小时中浓度ZnO-NPs胁迫组硝态氮的去除效率始终低于对照组,8 h时对照组去除率为89.2%,20和50 mg·L-1的ZnO-NPs胁迫组的去除率分别为60.96%和64.88%,较对照组分别降低了31.7%和27.3%,暴露10 h后恢复至与对照组无显著差异(P>0.05),达到90%左右;高浓度ZnO-NPs胁迫组对菌株硝态氮的去除有显著抑制作用(P<0.05),且抑制作用在整个暴露过程中持续存在,在暴露24 h时,对照组去除率为95.21%,200 mg·L-1的ZnO-NPs胁迫组的去除率仅为53.11%,较对照组下降了44.2%,这可能是由于ZnO-NPs的比表面积大,吸附作用强,极易吸附反硝化酶中心的Fe、Cu等金属离子,从而降低其酶活性,抑制硝态氮的去除[28]。
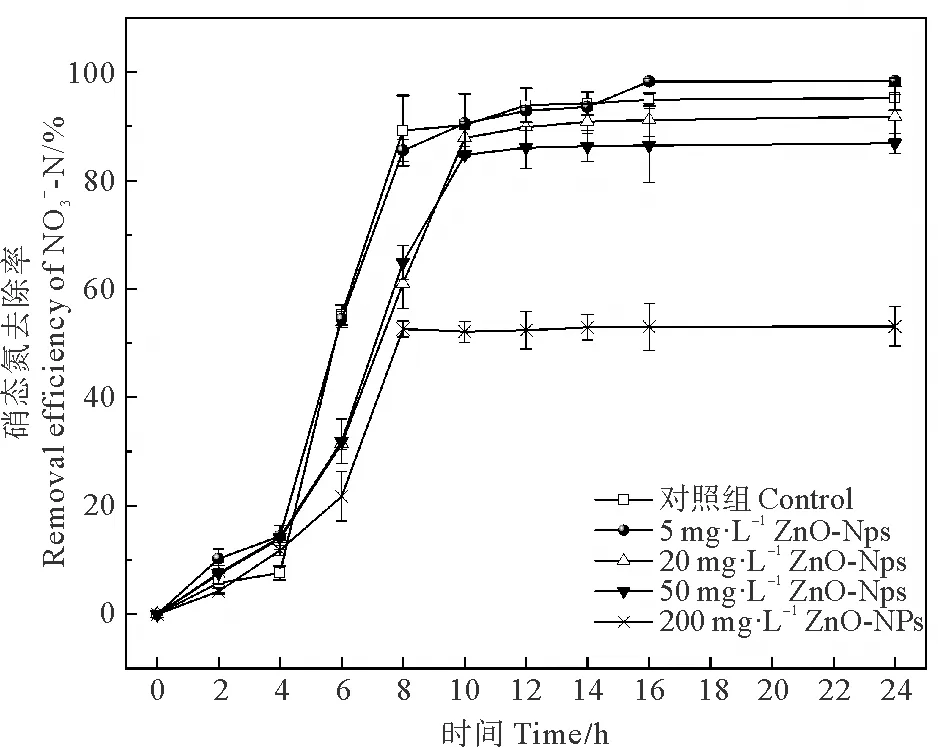
图4 不同浓度ZnO-NPs对菌株硝态氮去除率的影响
2.2.2 不同浓度普通ZnO对菌株硝态氮去除率的影响 不同浓度的普通ZnO对菌株硝态氮去除能力有不同程度的轻微的抑制作用,但并没有明显的剂量效应关系。普通ZnO浓度为20 mg·L-1以下时,硝态氮去除率与对照组并无显著差异(P>0.05),在暴露10 h时,体系中90%左右的硝态氮均已被去除;当浓度上升至50 mg·L-1时,硝态氮的去除在暴露10 h后开始出现停滞期,50 mg·L-1的普通ZnO胁迫组在10~14 h硝态氮去除的极其缓慢,200 mg·L-1胁迫组在12~14 h也出现了短暂的停滞,但在暴露16 h时,去除能力又恢复至与对照组无显著差异(P>0.05),去除率都达到了95%以上(见图5)。由此可见,普通ZnO在浓度为50 mg·L-1及以上时,会使菌株硝态氮的去除产生短暂的延迟期,但可在短时间内恢复。
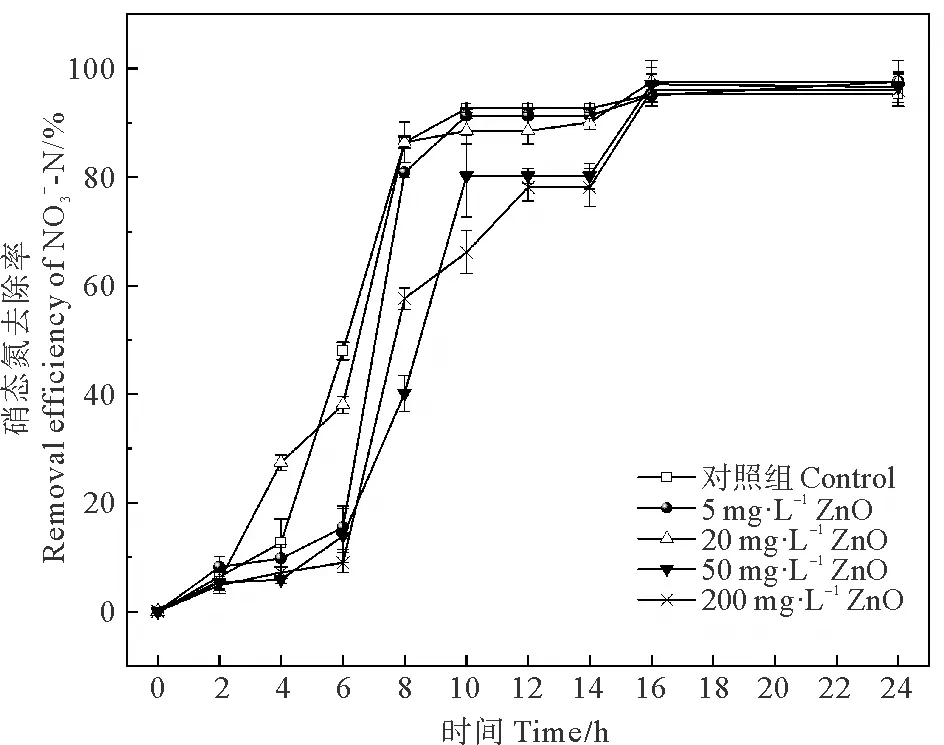
图5 不同浓度ZnO对菌株硝态氮去除率的影响
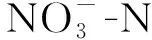
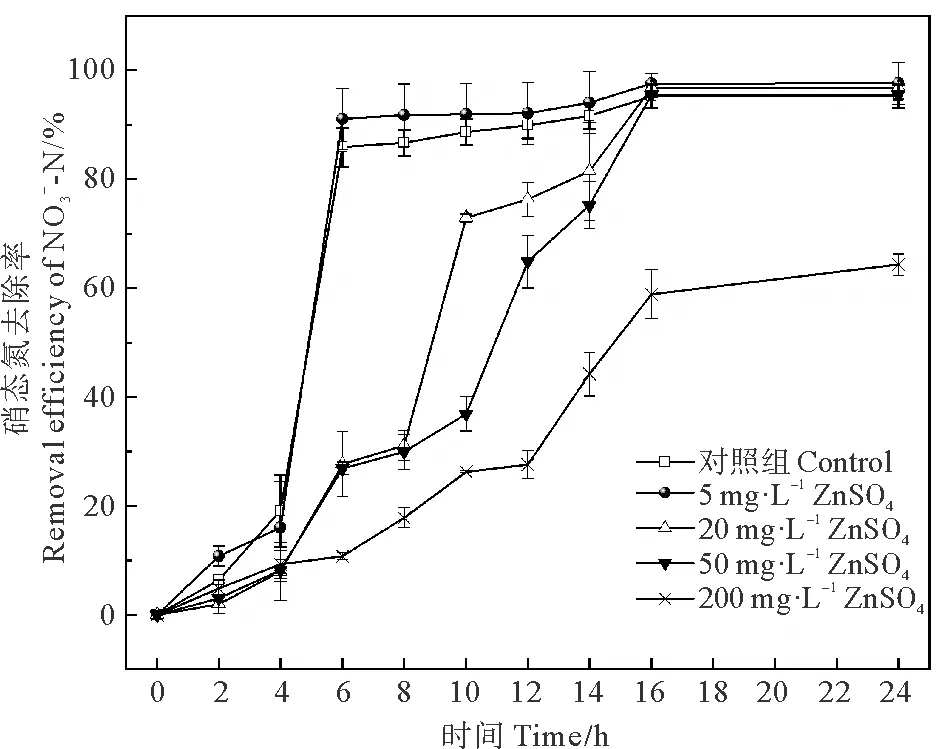
图6 不同浓度ZnSO4对菌株硝态氮去除率的影响
2.3 不同类型锌对菌株亚硝态氮去除率的影响
2.3.1 不同浓度ZnO-NPs对菌株亚硝态氮去除率的影响 避光条件下ZnO-NPs对体系中亚硝态氮累积的影响有一定的剂量效应关系,低浓度ZnO-NPs胁迫组变化趋势与对照组基本一致,在6 h体系中亚硝态氮的累积量达到峰值,在8 h时基本被去除完全,未产生累积现象;中浓度ZnO-NPs胁迫组的剂量效应关系并不明显,其较对照组亚硝态氮累积量的峰值出现时间延迟2 h,可能是由于ZnO-NPs在菌株对数生长期对菌株生长及硝态氮去除效率的抑制,导致硝态氮向亚硝态氮转化的过程有所延迟;高浓度ZnO-NPs胁迫组在整个暴露过程中对亚硝态氮的转化和去除均有持续的抑制作用,对照组与其他各ZnO-NPs胁迫组体系中的亚硝态氮仅出现了短暂的累积现象(见图7)。而200 mg·L-1的ZnO-NPs胁迫组在24 h时,体系中的亚硝态氮含量仍高达52.24 mg·L-1,去除速率缓慢,并产生持续的累积现象,亚硝态氮具有一定的生物毒性,会使水生生物产生缺氧现象(见图7),甚至死亡,其累积会对近海生态环境产生严重危害[30]。
2.3.2 不同浓度普通ZnO对菌株亚硝态氮去除率的影响 不同浓度的普通ZnO对菌株硝态氮去除能力有不同程度的轻微的抑制作用,但并没有明显的剂量效应关系。普通ZnO浓度为20 mg·L-1以下时,硝态氮去除率与对照组并无显著差异(P>0.05),在暴露10 h时,体系中90%左右的硝态氮均已被去除;当浓度上升至50 mg·L-1时,硝态氮的去除在暴露10 h后开始出现停滞期,50 mg·L-1的普通ZnO胁迫组在10~14 h硝态氮去除的极其缓慢,200 mg·L-1胁迫组在12~14 h也出现了短暂的停滞,但在暴露16 h时,去除能力又恢复至与对照组无显著差异(P>0.05),去除率都达到了95%以上(见图8)。由此可见,普通ZnO在浓度为50 mg·L-1及以上时,会使菌株硝态氮的去除产生短暂的延迟期,但可在短时间内恢复。
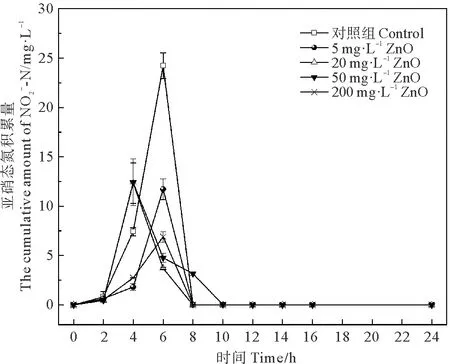
图8 不同浓度ZnO对菌株亚硝态氮去除率的影响
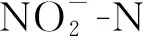
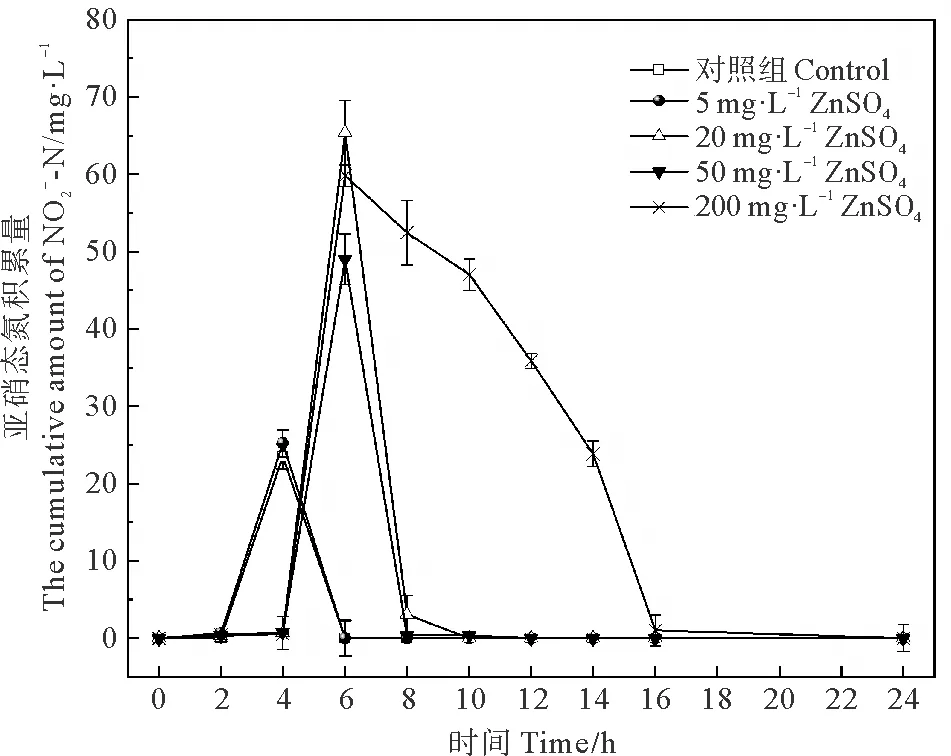
图9 不同浓度ZnSO4对菌株亚硝态氮去除率的影响
3 讨论
很多研究表明,不同结构的锌对微生物生长的影响具有显著差异[31-32]。段惺等比较了四针状ZnO晶须、ZnO-NPs和普通ZnO的抗菌性能,结果显示具有纳米结构且不易团聚比表面积更大的针状ZnO晶须抑菌效果最强,其次是ZnO-NPs,普通ZnO最差[33];普通ZnO对细菌也存在一定的抑制作用,但其抑菌效果远远低于ZnO-NPs,喻兵权等的研究结果指出,当普通ZnO和ZnO-NPs质量分数均为5%时,ZnO-NPs可抑制97.9%的大肠杆菌和98.8%的金黄色葡萄球菌生长,而普通ZnO抑制率仅为52.9%和68.3%[31];曲敏利等的研究结果也表明, ZnO-NPs的抑菌圈的半径比普通ZnO的半径要大2倍以上[32];Dadook M等研究了12种固氮菌对ZnSO4的敏感性,发现50 ppm的ZnSO4会对固氮菌这类土壤中的有益细菌的生长产生显著抑制[34]; 龙新宪等对东南景天根圈土壤微生物的研究发现,1 000 mg·kg-1的ZnSO4处理后的土壤中可培养微生物量显著降低,而普通ZnO处理后的微生物量却没有显著变化[35]。本研究通过将一株好氧反硝化菌分别暴露于不同浓度的普通ZnO、ZnO-NPs和ZnSO4,结果发现低浓度普通ZnO胁迫对好氧反硝菌株的生长几乎没有影响,浓度达到50 mg·L-1时,对使处于对数生长期的菌株生长速率变慢,平台期生长速率逐渐恢复。有研究指出,ZnO的抑菌机制主要是通过降低纤维蛋白的合成,从而抑制细菌繁殖[19],与本研究中普通ZnO主要对对数生长期的菌株产生抑制的结果相吻合。而ZnO-NPs不仅会对生长期菌株生长速率产生抑制,还会缩短菌株生长的平台期,使菌株提前进入衰亡期,这可能与ZnO-NPs粒径细小,比较面积大,会通过与菌体作用产生不可逆物理性损伤,或通过产生活性氧自由基,对细菌产生细胞毒性,从而对菌株有一定的杀灭作用有关[36-37];低浓度ZnSO4对菌株生长有一定的促进作用,ZnSO4浓度为200 mg·L-1时会降低菌株生长速率,但在暴露14 h后有所恢复,表明菌株可能具有一定的锌离子调控体系,随暴露时间延长可对高浓度的锌离子产生适应性[38],并且ZnSO4仅一定程度降低了菌株生长速率,并不会造成菌株平台期缩短,提前进入衰亡期,可见ZnSO4毒性相比于对菌株可能有杀灭作用的ZnO-NPs较弱。
综上所述,3种形态结构锌化合物对好氧反硝化菌株Zobellellasp. B307的抑制作用依次为ZnO-NPs> ZnSO4>普通ZnO。ZnO-NPs因表面效应引起的细菌表面不可逆的损伤对细菌具有一定的杀灭作用,因此对菌株生长及脱氮功能的抑制作用最强,因会产生亚硝态氮的累积现象,对生态环境产生的潜在危害也最大;ZnSO4通过释放锌离子,对菌株产生毒性,但由于菌株可能具有锌离子调节系统,因而暴露后期对ZnSO4产生适应性,使其抑制作用减弱;普通ZnO仅会抑制菌株繁殖,并无杀灭作用,因此对菌株抑制作用最弱。根据上述结果,在今后重金属锌相关材料的生产使用中需尽量减少ZnO-NPs的使用,寻求其替代品,以减少对近海氮素循环产生的潜在有害影响。
4 结论
(1)ZnO-NPs会导致菌株生长平台期缩短,提前进入衰退期;ZnSO4对菌株生长速率有轻微抑制作用,但在暴露14 h后逐渐减弱;普通ZnO对处于对数生长期的菌有轻微抑制,但抑制效应较前两类锌相比并不明显。
(2)ZnO-NPs会导致菌株前期脱氮速率减慢,暴露12 h后的脱氮过程处于停滞状态,体系出现亚硝态氮积累现象;ZnSO4对菌株前期脱氮功能有一定的抑制作用,但在后期有缓慢恢复的趋势,体系并无亚硝态氮累积;普通ZnO对菌株脱氮功能的抑制作用并不显著。
(3)3种形态结构锌对菌株Zobellellasp. B307的毒性效应表现为可产生菌体物理损伤的ZnO-NPs毒性最强,其次是通过锌离子释放产毒的ZnSO4,普通ZnO仅抑制对数生长期菌株的繁殖,毒性相对较弱。
