健康与患病大黄鱼消化道微生物结构特征分析❋
2021-03-23于超勇徐永江柳学周郑炜强
姜 燕, 于超勇, 徐永江, 柳学周❋❋, 郑炜强, 陈 佳, 刘 莹, 王 滨, 史 宝
(1. 大黄鱼育种国家重点实验室 宁德市富发水产有限公司, 福建 宁德 352103;2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071;3. 山东省海洋生物研究院, 山东 青岛 266104)
大黄鱼(Larimichthyscrocea)是中国主要经济鱼类之一,其繁育和养殖技术处于世界领先地位,在中国福建、浙江、广东等沿海省份均有养殖,其中,福建省养殖规模相对较大,2017年产量占全国大黄鱼总产量的84.75%,高达150 542 t,比2016年增长4 028 t[1-2]。养殖规模不断扩大的同时,环境胁迫、养殖管理不规范等各种问题不断涌现,导致大黄鱼养殖病害频发,严重限制产业的健康、持续发展。据统计,大黄鱼病害种类达30余种,细菌性疾病占据80%以上,并且,弧菌是大黄鱼溃疡病和肠炎病的主要病原,可以说,弧菌病是危害最为严重的细菌性疾病之一[3]。
肠道中居住着大量微生物,其携带的基因被称为机体的第二套基因组,能够编码合成多种消化酶参与消化道内营养物质的降解,并且,肠道微生物能够通过营养竞争、粘附位点竞争和产物抑制等方式阻止外源微生物在肠道中的定植[4-6]。可以说,肠道微生物对宿主的营养、免疫方面均发挥重要作用。同时,宿主生理阶段和环境因子等能够不同程度的影响肠道微生物群组成与分布[7-12]。因此,养殖密度、温度等环境因子的胁迫极易打破鱼类肠道微生物群的平衡状态,从而导致各种疾病的爆发,造成经济损失。
本文作者在大黄鱼室内工厂化养殖过程中,发现个别养殖池内的大黄鱼出现游动缓慢和死亡现象,即刻随机捞取几尾濒临死亡的患病鱼观察,发现其消化道内无食糜,肠道积存大量浅黄色黏液,类似肠炎的症状。为认知大黄鱼消化道微生物群结构与病害发生的关联性,本研究以患病鱼为对象,比较分析其消化道微生物群结构特征与健康鱼体的差异,及其与环境菌群结构的联系,明确主要致病菌,以期为大黄鱼养殖过程中消化道生理健康判别及益生菌有效调控提供参考资料。
1 材料与方法
1.1 样本采集与处理
试验所采集大黄鱼均来自于宁德富发水产有限公司的工厂化养殖池中,由同批受精卵孵化而来,养殖密度为60尾·m-3,水温为13~16 ℃,体重为90~110 g。上午投喂前采集各样本,患病大黄鱼从发病池中随机采集游动活力极弱的6尾作为平行样本;从未出现任何病症且鱼体游动力较强的养殖池中随机选择一个作为健康鱼样本采集池,从中随机捞取6尾作为平行样本。
消化道样本:健康组的试验鱼经MS-222 (Fluka, USA)麻醉后,同患病组试验鱼在无菌环境下采用75%酒精擦拭体表进行解剖,分别剪取大黄鱼消化道各组织(胃、幽门盲囊、肠道),去除各组织周围的脂肪等组织并挤去剩余的内容物,采用预冷的生理盐水冲洗各组织,分装后保存于液氮中备用。
水环境样本:同一养殖车间的进水口相同,因此,对进水口的水样采集 3次作为平行样本,每次3 L,现场经0.22 μm的滤膜真空抽滤,滤膜分装后液氮中保存,用于养殖用水微生物分析。
饲料样本:试验鱼的规格相同,所用配合饲料也完全相同。分别称取3份0.1 g的配合饲料作为3个平行样本于液氮中保存备用。
1.2 微生物总DNA提取与高通量测序
将液氮保存的各试验样本分别取出,液氮研磨,消化道、饲料样本通过QIAamp DNA mini kit (QIAGEN, Germany)试剂盒提取微生物总DNA;采用OMEGA Soil DNA kit (Omega Bio-Tek, USA)试剂盒提取水体微生物总DNA。共计提取24个生物样本(见表1)的微生物总DNA,用于后续的微生物结构与功能分析。提取的DNA通过浓度和纯度检测后,采用PCR技术扩增16s rDNA V3~V4高变区的序列,扩增所用引物为338F (5’-ACTCCTACGGGAGGCAGCA-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’),扩增产物经琼脂糖凝胶电泳检测合格后构建文库,采用Illumina MiSeq PE300平台进行高通量测序。
表1 高通量测序生物样本信息
1.3 数据处理
将测序所得的原始数据通过Trimmomatic (v 0.35)、Flash (v 1.2.11)、Uchime (v 4.2)等软件进行一系列的去杂、拼接、去嵌合体等处理得到有效序列。依据序列相似度≥97%的归为1个可操作分类单元(Operational Taconomic Unit, OTU)的原则对有效序列进行归类操作,选取各OTU的代表性序列,采用Silva数据库(v 123)对OTUs代表序列进行物种注释,保留置信区间大于0.7的注释结果。采用tax4fun (0.3.1)对微生物组基因参与的KEGG通路进行比对分析。
采用单因素方差分析(One-way ANOVA)方法对结果数据进行统计分析,利用Duncan’s检验对同一处理组大黄鱼不同消化道组织间的差异性进行多重比较,采用T-test检验对不同健康状态大黄鱼相同消化道组织间进行差异性分析,显著性水平为P<0.05。所有数值均采用平均值±标准误(Means±SE)表示。
2 结果
2.1 大黄鱼消化道微生物多样性
采集的24个生物样本经高通量测序和数据处理,共得到814 494条有效序列,归类分析后共得到2 239个OTUs。
在健康大黄鱼消化道中,从胃到幽门盲囊直至肠道,其中的微生物群Chao1指数由812.01下降至311.22;香农指数同样呈现逐渐下降趋势,由胃部的7.32下降至6.23,胃中微生物群的多样性均显著高于幽门盲囊和肠道中的(P<0.05),但幽门盲囊和肠道中的多样性指数差异不显著(P>0.05) (见表2)。
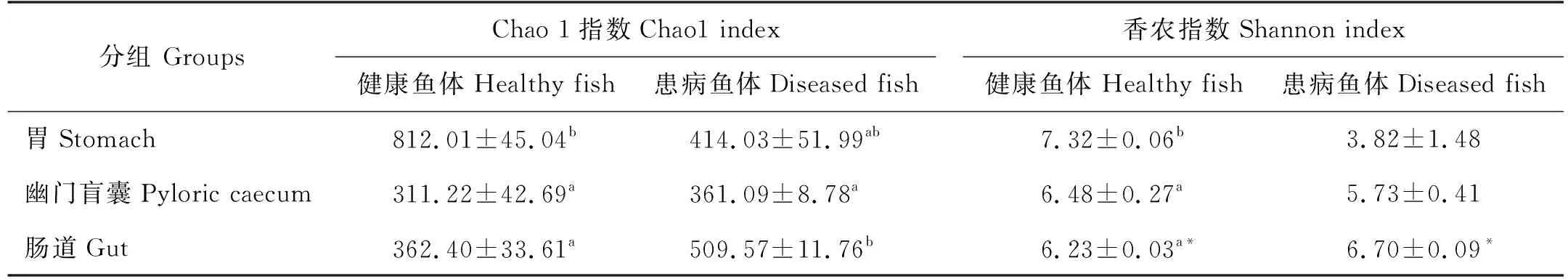
表2 两种健康状况大黄鱼消化道菌群多样性
患病大黄鱼消化道中微生物群多样性发生变化,Chao1指数呈现先下降后上升趋势,在肠道中表现出最高值(509.57),显著高于幽门盲囊中的(P<0.05);香农指数则逐渐升高,但是差异均不显著(P>0.05)。
健康大黄鱼胃中的多样性指数高于病鱼,但肠道中的香农指数则显著低于病鱼的(P>0.05)。
2.2 大黄鱼消化道微生物群结构特征
图1A显示了两种健康状况大黄鱼消化道微生物群门水平分布信息,在健康大黄鱼消化道中,从胃到幽门盲囊和肠道,厚壁菌门(Firmicutes)丰度(31.59%~34.84%)波动不明显,拟杆菌门(Bacteroidetes)(13.40%~39.88%)则呈现下降趋势,而变形菌门(Proteobacteria)(21.34%~42.92%)则迅速上升并成为最优势菌门。在患病大黄鱼胃部,变形菌门优势地位明显(74.84%),而在幽门盲囊和肠道中则下降至46.72%~51.49%;拟杆菌门相对丰度变化较小;厚壁菌门的丰度则由胃中的5.60%到幽门盲囊和肠道中上升至24.95%~27.62%。
变形菌门、拟杆菌门和厚壁菌门为两种健康状况大黄鱼相对丰度较高的物种,三者的丰度之和为85.03%~94.58%,并且幽门盲囊和肠道中的优势菌群组成较为相近(见图1A)。其中,厚壁菌门和拟杆菌门在健康大黄鱼胃中的相对丰度显著高于病鱼的(P<0.05),变形菌门丰度则显著低于病鱼的(P<0.05);厚壁菌门和酸杆菌门(Acidobacteria)在健康大黄鱼肠道中的丰度显著高于病鱼的(P<0.05),而变形菌门、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimona-detes)和酸杆菌门的丰度则显著低于病鱼的(P<0.05) (见图1B)。

(A:各部位优势菌群组成特征;B:健康和患病鱼消化道差异菌群特征;I1YS、I1YP、I1YG分别表示健康大黄鱼胃、幽门盲囊、肠道样本;I1DYS、I1DYP、I1DYG分别表示患病大黄鱼胃、幽门盲囊、肠道样本;其中,I1YS1、I1YS2、I1YS3、……、I1DYG2和I1DYG3分别表示I1YS、I1YP、……、I1DYG的平行样本。下同。A represents the composition of dominant microbiota of gastrointestinal tract; B represents the composition of gastrointestinal microbiota with significant differences between healthy and diseased large yellow croaker; I1YS, I1YP and I1YG represent stomach, pyloric caecum and gut of healthy large yellow croaker, while I1DYS, I1DYP and I1DYG represent those of diseased large yellow croaker; I1YS1, I1YS2, I1YS3, ……, I1DYG2 and I1DYG3 represent the parallel samples of I1YS, I1YP, ……, I1DYP and I1DYG. The same as below.)
图2A显示了每个样本中相对丰度排列前十的菌属,可以看出,在健康大黄鱼胃中拟杆菌属(Bacteroides)的相对丰度最高(23.70%),到幽门盲囊和肠道下降至1.16%~1.32%;幽门盲囊和肠道中的乳杆菌属(Lactobacillus)的相对丰度由胃中的5.84%上升至15.75%~17.04%。在患病大黄鱼胃中,Aliivibrio的相对丰度最高(33.68%),弧菌属(Vibrio)的丰度(20.21%)次之,随着消化道的延伸丰度分别下降至5.98%和3.69%;乳杆菌属的丰度在胃中为6.72%,到幽门盲囊和肠道中则上升至11.99%~12.51%。
图2B显示了两种健康状况大黄鱼消化道各部分差异均属的组成情况,可以看出,健康鱼胃中Alii-vibrio的相对丰度显著低于病鱼(P<0.05),拟杆菌属、普氏菌属(Prevotella)、Parabacteroides、Blautia和Faecalibacterium等的相对丰度则显著低于病鱼胃中的(P<0.05);健康鱼幽门盲囊中,仅Aliivibrio的相对丰度显著低于病鱼的 (P<0.05);健康鱼肠道中,Aliivibrio和鞘氨醇单胞菌属(Sphingomonas)的相对丰度显著低于病鱼的(P<0.05),而乳杆菌属、芽孢杆菌属(Bacillus)、拟杆菌属等的相对丰度则显著高于病鱼的(P<0.05)。

(A:各部位优势菌群分布特征;B:健康与患病鱼体消化道差异菌群特征。A represents the distribution of dominant microbiota of gastrointestinal tract; B represents the composition of gastrointestinal microbiota with significant differences between healthy and diseased large yellow croaker.)
2.3 大黄鱼消化道微生物群功能特征
大黄鱼消化道各部分微生物参与KEGG通路的基因数目分布情况基本相近,主要集中于新陈代谢和环境信息处理中(见图3)。其中,在二级水平下,两种健康状况大黄鱼胃中的微生物参与神经系统、免疫系统、循环系统方面基因数目差异显著(P<0.05);在幽门盲囊中,参与异源物质生物降解于代谢、萜类和聚酮化合物代谢、脂类代谢、其他次级代谢物生物合成通路的基因数目差异显著(P<0.05);肠道中,则参与核苷酸代谢和膜转运通路等的基因数目差异显著(P<0.05)。

(*:差异显著。*:Represents significant difference.)
2.4 大黄鱼消化道微生物与环境微生物的相似性
分别对两种健康状况大黄鱼消化道各部分与环境样品进行主成分分析(Principal components analysis, PCA),从图4中可以看出,健康大黄鱼胃、幽门盲囊和肠道样品分别相对比较聚集,与病鱼消化道各部分之间形成一定的距离,说明病鱼消化道各部分中的微生物组成与健康个体消化道各部分的微生物组成存在一定的差异。结合PC1和PC2的贡献率,可以得出,两种大黄鱼消化道各部分与饲料样品间的距离相对较近,说明消化道微生物组成与饲料微生物组成相近。

(A:大黄鱼胃部菌群与环境菌群;B:大黄鱼幽门盲囊菌群与环境菌群;C:大黄鱼肠道菌群与环境菌群。IYW1、IYW2、……、s1YF3分别表示水环境样本、饲料样本的三个平行样本。A: represents microbiota in large yellow croaker stomach and environment; B: represents microbiota in large yellow croaker pyloric caecum and environment; C: represents microbiota in large yellow croaker gut and environment. IYW1, ITW2, ……, s1YF3 represent parallel samples of water and feed.)
2.5 大黄鱼消化道主要微生物群在各样品中分布特征
大黄鱼胃、幽门盲囊和肠道中相对丰度高于5%的微生物群在生物样本中的分布特征如图5所示,在健康鱼消化道中Aliivibrio的相对丰度分别为0.020%、0.001%、0.005%,病鱼消化道Aliivibrio的相对丰度则是健康鱼的1 702.83~10 957.55倍,弧菌属的相对丰度是健康鱼的19.10~66.10倍;而健康鱼胃中拟杆菌属的丰度则是病鱼胃中的80.59倍。这些主要菌属在大黄鱼摄食饲料中的相对丰度均高于水环境中的,其中,乳杆菌属在饲料中的丰度(8.02%)相对较高,但仅为水环境中6.72倍;饲料中弧菌属的丰度虽然仅为1.19%,但却是水环境中的78.02倍。

图5 大黄鱼主要微生物在消化道各部位和环境样品中的分布
3 讨论
3.1 患病对消化道菌群结构的影响
在健康大黄鱼消化道/肠道中,变形菌门、厚壁菌门和拟杆菌门为主要的优势物种[13]。本研究中,两种健康状态大黄鱼消化道中主要优势菌门依然为变形菌门、厚壁菌门和拟杆菌门,但是其相对丰度存在显著性差异,说明这些菌门始终存在于大黄鱼消化道中,并且伴随着发病的过程其结构也发生了较大的改变[14]。拟杆菌属、乳杆菌属、Aliivibrio和弧菌属为主要的优势菌属,其中,Aliivibrio在病鱼整个消化道中的丰度显著高于健康鱼消化道中的,且差异悬殊;弧菌属在病鱼整个消化道中的丰度与健康鱼中的相比,虽然差异不显著,但也是健康鱼中的19.10~66.10倍;并且Alii-vibrio和弧菌属在病鱼胃中的丰度均最高,随着消化道的延伸,二者的丰度均呈现下降趋势,在幽门盲囊和肠道中失去最优势地位。推测Aliivibrio和弧菌属是本研究中大黄鱼的主要病原菌,在消化道中从胃部开始逐渐向下游感染,并引起疾病爆发。Aliivibrio和弧菌属的丰度在胃中急剧上升可能也是导致病鱼胃中微生物多样性下降的一个主要原因。Aliivibrio和弧菌属在健康鱼消化道中也存在[12,15-16],但是丰度均较低,说明二者的丰度均在健康范围内。
拟杆菌属在健康鱼胃中的丰度是病鱼胃中的81倍,推测Aliivibrio和弧菌属丰度的迅速上升突破了拟杆菌属的屏障作用,持续侵入到幽门盲囊和肠道,并降低了幽门盲囊和肠道中的乳杆菌属的丰度,同时有助于Brevinema的快速生长繁殖,也彰显了拟杆菌属和乳杆菌属在维持消化道微生物群平衡中的重要作用。有研究显示,通过实时荧光定量PCR法将结直肠癌、溃疡性肠炎患者粪便中的部分菌群数量同健康人群的进行对比分析,发现疾病的发生可能与菌群失衡有关[17-18],说明维持消化道菌群的平衡状态至关重要。
弧菌是弧菌病的主要病原菌,而且弧菌病也是大黄鱼细菌性疾病中危害最严重的疾病之一,溶藻弧菌(V.algiolyticus)、哈维弧菌(V.harveyi)和副溶血弧菌(V.parahaemolyticus)是具有代表性的3株病原菌[3,19-20]。Urbanczyk等[21]将V.fischeri,V.logei,V.salmonicida和V.wodanis4株菌同弧菌科其他物种进行系统发育和表型差异性分析,提出将这4株菌归为一个新的属-Aliivibrio,由此Aliivibrio包含了A.fischeri、A.salmonicida、A.wodanis和A.logei4株菌。之后,通过实验研究又分离出A.finisterrensis[22]、A.sifiae[23]等,使Aliivibrio属的细菌种类不断增多。在大西洋鲑(Salmosalar)、虹鳟鱼(Oncorhynchusmykiss)等研究中发现Aliivibrio(以前为Vibrio)是弧菌病的主要病原菌[24-25]。从本研究角度推断,Aliivibrio是本次大黄鱼发病的主要病原菌。
另外,在对消化酶分布与活性的研究中发现,大菱鲆对蛋白质的消化主要集中在胃和肠道中,对淀粉的消化则主要依靠幽门盲囊和肠道,对脂肪的消化主要集中在肠道中[26]。消化酶活性的不同将导致消化道各部位食糜的营养水平的差异,而营养水平的不同将显著影响定植菌群的组成结构[27]。因此,本研究中,通过对健康大黄鱼消化道微生物群门和属水平的组成结构分析发现,幽门盲囊和肠道中优势菌群的种类和相对丰度相近,二者与胃中的存在一定差异。
但是,由于受测序片段长度的限制,高通量测序技术不能鉴定到消化道菌群的具体菌种;同时,本研究由于受当时条件限制未及时将消化道菌群进行分离培养,不能对疑似病原菌进行种类的鉴定,今后应该结合对消化道的疑似致病菌进行分离、培养、生理生化特征分析等研究,通过双向判断得出具体病原菌种类,可能更为准确。
3.2 患病对消化道菌群功能的影响
消化道作为营养消化吸收的主要场所,其内部定植着数以万亿计的微生物,其携带的基因数量庞大[28],被称为机体的第二套基因组,参与宿主营养、免疫等多方面的生理功能[29-32]。目前,关于消化道菌群功能方面的前沿性研究主要集中在人和畜牧动物方面,由于受养殖环境、养殖动物自身等方面的影响,有关水产动物消化道功能方面的研究相对较少。研究发现,反刍动物能量的吸收依赖于肠道菌群[9],且在极端环境下,肠道菌群能通过调整自身结构以协同宿主更好的获取能量适应极端环境[10]。但是,当环境因子胁迫超过一定界限时,鱼体消化道微生物群平衡状态极易被打破,微生物群基因富集的代谢通路情况也随之改变,从而通过某一表型体现出来。本研究中,与健康鱼相比,病鱼消化道菌群结构发生了显著的变化,其菌群基因富集的代谢通路也发生了较大改变,其中消化道菌群参与的大部分代谢通路的基因数目明显低于健康鱼的,可能受Aliivibrio和弧菌属丰度大幅增加的影响比较明显。也反映了微生物群结构与功能的统一。
3.3 大黄鱼消化道菌群与环境菌群关系分析
水产养殖动物由于特殊的生活环境,外源微生物主要以水和饲料为载体对其进行生理影响。本研究中,饲料菌群对大黄鱼消化道这些主要微生物群的贡献相对较大,这与不同模式养殖大黄鱼[6,15]、早期发育阶段的牙鲆[12]和许氏平鲉[33]等研究结果相似。然而,本研究中的健康和患病大黄鱼摄食饲料完全相同,说明大黄鱼之所以出现消化道微生物群结构明显改变,可能是由于环境微生物群效应长期累积的结果,也有可能是温度、压力或外源物质介入等环境因子突变打破消化道菌群动态平衡状态[11],致使免疫水平较低的鱼体发生病变。尤其是在苗种繁育时期,仔稚鱼免疫器官发育不完全,免疫水平低下,极易受到病原微生物的侵染,一旦爆发疾病,将严重影响下游产业链的可持续发展。可见,保证养殖鱼类生长发育过程中良好的环境和饲料微生物卫生质量是绿色、安全养殖的关键措施之一。
4 结语
本研究条件下,与健康大黄鱼相比,病鱼消化道微生物群结构发生明显改变;推断Aliivibrio和弧菌属为主要病原菌,由胃部逐渐向幽门盲囊和肠道侵染并引发疾病。规模化养殖过程中,除了要有规范的操作技术外,养殖环境的微生物卫生质量也不容忽视。
