黄土高原雨养区不同种植年限紫花苜蓿土壤细菌群落特征与生态功能预测
2021-03-22马欣罗珠珠张耀全刘家鹤牛伊宁蔡立群
马欣 ,罗珠珠 ,张耀全 ,刘家鹤 ,牛伊宁 ,蔡立群 ,
(1. 甘肃农业大学资源与环境学院,甘肃兰州730070;2. 甘肃省干旱生境作物学重点实验室,甘肃兰州730070;3. 延安市农业科学研究所,陕西延安716000)
西部黄土高原丘陵沟壑区是中国乃至世界上水土流失最严重的区域之一,该区以小麦(Triticum aestivum)和玉米(Zea mays)单作为主的传统农业生产方式和自然资源过度利用是引起水土流失的最主要原因。严重的水土流失不仅破坏生态环境,而且降低土壤质量,减少土壤碳氮固存。紫花苜蓿(Medicago sativa)为豆科作物,因其高产、耐瘠、耐寒、保土和适应性强等优良特性,在黄土高原地区广泛种植,是当地退耕还林的主要草种,其根瘤可在根瘤菌的作用下固定游离氮,地上部枯枝落叶可经微生物分解增加土壤有机碳[1],改善土壤团粒结构[2],因此紫花苜蓿对于西北生态脆弱区的生态修复和土壤结构改善有着重要作用。但是苜蓿持续种植多年后会引起土壤水分[3-4]和磷(phosphorus,P)素[5-6]严重耗竭,导致牧草产量下降,草地严重退化。
土壤微生物是土壤生态系统的重要组成部分,可通过参与土壤中碳素转化,影响腐殖质的形成;参与物质循环,聚集土壤,有利于土壤结构和理化性质的稳定[7]。作为生态系统功能的基础和生态系统健康的指示物,土壤微生物群落结构的多样性可以反映出生态环境的功能演变及其环境影响[8]。细菌作为土壤微生物中数量最丰富的菌群,参与物质循环和养分吸收等过程[9],影响着土壤养分的吸收和转化,且细菌群落结构的变化规律在一定程度上可反映土壤质量现状,亦可用来表征土壤生态功能[10]。随着分子生物学技术与方法的不断发展,关于土壤细菌的研究逐步从结构转向功能,研究土壤细菌功能对于揭示细菌在土壤生态系统中的作用具有重要意义[11-13]。PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states)方法是基于系统发育与功能充分联系的假设,将现有的应用16S rRNA 测序基因与已知代谢功能的微生物参考基因组数据库相对比,从而实现对细菌代谢功能的预测,为深入理解微生物功能提供了新途径[14-15]。目前PICRUSt 算法已应用于土壤、海洋和湖泊细菌功能分析中[16-17],使得不同的微生物类群能够解释不同的生态系统功能,为土壤微生物群落结构与功能研究提供了新途径。
紫花苜蓿连续种植多年对土壤细菌群落有一定影响。Agnello 等[18]在对评估法国地区苜蓿植被恢复潜力的研究中发现种植苜蓿能够有效提高根际细菌活性;邰继承[19]对内蒙古灰色草甸土的研究发现,种植5 年的紫花苜蓿土壤细菌数量高于种植2 年苜蓿地;蔡艳等[20]采用454 测序技术发现,连续种植苜蓿会加速土壤水分和磷素的耗竭,导致其细菌多样性不及农田丰富。耿德洲等[21]采用高通量测序技术发现,与农田相比,贫营养型细菌类群酸杆菌门丰度在苜蓿土壤中有所增加,而富营养型细菌类群变形菌门则减少,并且随着种植年限的增加下降程度加剧。紫花苜蓿是豆科固氮植物,持续种植多年后产量就会明显下降,但土壤碳氮储量和土壤结构通常会得到改善,两者之间是否矛盾?大量研究表明,苜蓿持续种植多年引起土壤水分[3-4]和P 素[5-6]严重耗竭。因此假设,紫花苜蓿长期种植导致土壤剖面发生干燥化且使土壤P 素亏缺,从而可能影响到土壤细菌群落分布格局,而这些地下生物的演替变化影响到其代谢功能的改变和土壤营养元素的有效性,最终导致苜蓿地上生物量发生变化。本研究以农田为对照,通过基于Illumina MiSeq 平台的高通量测序技术,研究黄土高原雨养农业区旺盛生长期(L2012)和衰败期(L2003、L2005)苜蓿地土壤细菌分布格局和演替特征及其与环境因子的关系,并结合PICRUSt 预测土壤微生物生态功能,为西部黄土高原苜蓿人工草地的可持续利用和黄绵土细菌代谢潜力、功能预测提供参考。
1 材料与方法
1.1 试验区概况
本试验于2018 年在甘肃省定西市安定区李家堡镇甘肃农业大学旱作农业综合试验站(104°44′E,35°28′N)进行,该区属于典型的黄土高原半干旱雨养农业区,平均海拔约为2000 m,年均太阳辐射592.9 kJ·cm-2,平均日照时数2476.6 h,年均气温6.4 ℃,0~10 ℃积温范围为2239.1~2933.5 ℃,无霜期为141 d,年均降水量400 mm,年蒸发量1531 mm,干燥度2.53。土壤类型为黄绵土,土壤容重1.19 g·cm-3,pH 值8.36,土壤有机质含量12.01 g·kg-1,全氮含量 0.76 g·kg-1,全磷含量 0.89 g·kg-1。
1.2 试验设计
试验以农田(玉米)为对照,2003 年(L2003)、2005 年(L2005)、2012 年(L2012)建植的紫花苜蓿人工草地为研究对象,3 次重复,随机区组排列。小区面积均为3 m×7 m=21 m2。苜蓿品种为当地传统品种陇东苜蓿,整个生育期无人为干预,各处理田间管理保持一致,每年刈割两次(6 和10 月)。苜蓿人工草地在2003、2005 和2012 年建植时施纯氮105 kg·hm-2,纯P2O5105 kg·hm-2,之后在苜蓿生长期间未进行施肥、灌水。玉米品种为先玉335,2013 年开始种植玉米,持续至今,每年播前人工撒施纯N 200 kg·hm-2,纯P2O5105 kg·hm-2,生育期不再追肥,收获后期玉米根系不还田。
1.3 土样采集
于2018 年苜蓿第一茬盛花期(5 月20 日),用土钻采用对角线五点法采集耕层土壤(0~30 cm),每个取样点之间的距离间隔1 m,剔除土样中的植物根系、落叶、石块等杂物,将土样充分混匀后装入灭菌自封袋,干冰保存,迅速带回实验室。将土样分为3 部分,一部分过2 mm 筛置于-80 ℃冰箱用于细菌群落结构的测定,一部分过2 mm筛置于4 ℃冰箱用于土壤硝态氮测定,其余土样风干后过1 和0.25 mm 筛,用于全氮、有机碳、全磷、速效磷、速效钾含量和pH 的测定。
1.4 土壤理化指标测定
土壤理化指标均按照《土壤农化分析》[22]中的方法测定:全氮(total nitrogen,TN)含量采用凯氏定氮法测定,土壤有机碳(soil organic carbon,SOC)含量采用浓硫酸-重铬酸钾外加热法测定,全磷(total phosphorus,TP)含量采用HClO4-H2SO4法测定,速效磷(available phosphorus,AP)含量采用NaHCO3-钼锑抗比色法测定,速效钾(available potassium,AK)含量采用CH3COONH4-火焰光度法测定,硝态氮(NO3--N)含量采用 2 mol·L-1KCl浸提,全自动化学间断分析仪(Smart Chem140,意大利)测定,pH 采用酸度计(PB-10,德国赛多利斯)测定。
1.5 细菌16S rRNA 高通量测序
DNA 提取:土壤微生物群落结构土壤总DNA 采用PowerSoil® DNA 提取试剂盒提取,所提取的DNA 的纯度用1.0%琼脂糖凝胶电泳跑胶,用溴化乙锭染色之后在凝胶成像系统检测。
PCR 扩增:DNA 提取后,利用目标基因引物 515F(5′-GTGCCAGCMGCCGCGG-3′)和 907R(5′-CCGT⁃CAATTCMTTTRAGTTT-3′)对细菌 16S rRNA 基因 V4~V5 区进行 PCR 扩增[23-24],扩增条件为:95 ℃预变性2 min,接着进行 25 个循环,包括 95 ℃变性 30 s,55 ℃ 退火 30 s,72 ℃延伸 30 s;循环结束后 72 ℃最终延伸 5 min。PCR 采用 TransGen AP221-02:TransStart Fastpfu DNA Polymerase;PCR 仪:ABI GeneAmp® 9700 型;每个样本3 个重复,将同一样本的PCR 产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA 凝胶回收试剂盒(AXYGEN 公司,美国)切胶回收PCR 产物,Tris-HCl 洗脱,2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR 产物用QuantiFluor™-ST 蓝色荧光定量系统(Promega 公司,北京)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
IlluminaMiseq PE300 测序:对PCR 产物进行定量并均一化混匀,利用聚合DNA 产物构建Miseq 文库,然后借助高通量测序平台(IlluminaMiseq PE300)测序,由上海美吉生物医药科技有限公司完成。
1.6 PICRUSt 基因功能预测
首先通过PICRUSt 对OTU 丰度表进行标准化[25],即去除16S marker gene 在物种基因组中的copy 数目的影响;然后通过每个OTU 对应的green gene id,获得OTU 对应的COG 家族信息和KEGG Orthology(KO)信息;并计算各COG 的丰度和KO 丰度。根据COG 数据库的信息,可以从eggNOG 数据库中解析到各个COG 的描述信息,以及其功能信息,从而得到功能丰度谱;根据KEGG 数据库的信息,可以获得KO、Pathway、EC 信息,并能根据OTU 丰度计算各功能类别的丰度。
1.7 数据处理
采用SPSS 22.0 和Excel 2010 对土壤理化性质和细菌群落组成数据进行处理,差异显著性分析利用单因素方差分析(ANOVA)和多重比较法(Duncan)。通过上海美吉公司I-Sanger 云平台进行相关性热图(Heatmap)和PICRUSt 基因功能预测,使用CANOCO 5 软件对细菌群落进行冗余分析(redundancy analysis,RDA)和主成分分析(principal component analysis,PCA),采用AI 软件进行图表修饰。
2 结果与分析
2.1 不同种植年限苜蓿土壤化学性质
由表1 可以看出,与农田相比,不同种植年限苜蓿土壤全氮含量显著增加(P<0.05),增幅21.43%~40.48%;全磷、速效磷、硝态氮含量显著降低(P<0.05),全磷降低10.47%~16.28%,速效磷降低51.87%~85.31%,硝态氮降低60.67%~75.38%;但土壤有机碳表现为L2003和L2005显著高于农田(P<0.05),L2012和农田无显著差异。研究同时发现,随着苜蓿种植年限的延长,土壤SOC、TN 含量呈现明显增加趋势,土壤全氮和有机碳含量均表现为L2003显著高于L2012(P<0.05),增幅达15.69%和22.09%,速效磷含量表现为L2012和L2005显著高于L2003(P<0.05),不同种植年限苜蓿土壤全磷含量未表现出明显差异,速效钾含量在农田和苜蓿土壤间无明显差异。pH 值表现为苜蓿土壤显著高于农田土壤(P<0.05),增幅为3.25%~5.42%,且不同种植年限苜蓿土壤pH 值亦存在差异,表现为L2005显著高于L2012(P<0.05)。
2.2 不同种植年限苜蓿土壤细菌群落结构
本研究所有供试黄绵土样品共检测到细菌36 门90 纲192 目375 科715 属,从门水平的分类来看(图1),土壤细菌主要来自放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloro⁃flexi)、浮霉菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)、unclassified_k__norank、厚壁菌门(Fir⁃micutes)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)、装甲菌门(Armatimonadetes),其中放线菌门(20.34%~32.40%)、变形菌门(18.99%~23.14%)、酸杆菌门(12.50%~13.39%)、绿弯菌门(11.41%~12.55%)为黄绵土细菌群落优势菌群,占总序列的69%以上,农田土壤优势菌为变形菌门,苜蓿土壤优势菌为放线菌门。

表1 不同处理土壤化学性质Table 1 Chemical properties of different treatments
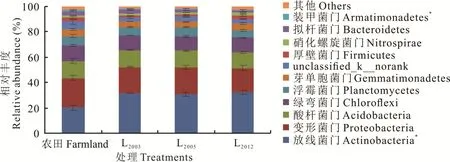
图1 不同处理土壤细菌门水平的相对丰度Fig.1 Phylum groups of soil bacterial community in different treatments
与农田相比,苜蓿土壤放线菌门相对丰度显著增加(P<0.05),装甲菌门相对丰度显著降低(P<0.05),且放线菌门随苜蓿种植年限延长呈降低趋势,装甲菌门随苜蓿种植年限延长而升高;不同种植年限苜蓿土壤放线菌门丰度比农田土壤提高51.16%~59.30%,装甲菌门丰度比农田土壤降低18.42%~48.80%。变形菌门和绿弯菌门相对丰度表现为农田土壤高于苜蓿土壤,且变形菌门、绿弯菌门相对丰度随种植年限延长先增加后降低,但处理间并无显著差异。酸杆菌门相对丰度在农田和苜蓿土壤间均无明显差异。
在属分类水平上(表2),种类繁杂、丰度较低的稀有细菌类群(相对丰度<1%)占总序列的33.88%~39.26%,各个门科下属分类地位不明确的菌属占总序列的42.58%~47.89%。已分类的相对丰度较高的属(相对丰度>1%)依次为Gaiella属(1.65%~3.33%)、硝化螺菌属(Nitrospira,1.52%~2.34%)、假节杆菌属(Pseudarthrobacter,1.36%~2.61%)、Solirubrobacter属(1.03%~2.24%)、微枝形杆菌属(Microvirga,1.45%~1.97%)、芽孢杆菌属(Bacillus,1.01%~1.94%)、链霉菌属(Streptomyces,1.11%~1.61%)、芽球菌属(Blasto⁃coccus,0.99%~2.08%)、H16(0.78%~1.28%)、类 诺 卡 氏 菌 属(Nocardioides,0.72%~1.79%)、RB41(0.93%~1.25%)、Pir4_lineage(0.40%~1.32%)和溶杆菌属(Lysobacter,0.16%~1.06%)。
与农田相比,苜蓿土壤Solirubrobacter属相对丰度显著增加(P<0.05),H16、Pir4_lineage 和溶杆菌属相对丰度显著降低(P<0.05)。不同种植年限苜蓿土壤优势属丰度亦存在差异,随苜蓿种植年限延长,Gaiella属和硝化螺菌属相对丰度逐渐降低,假节杆菌属、芽球菌属、链霉菌属和类诺卡氏菌属相对丰度逐渐增加,其中Solirubro⁃bacter属相对丰度表现为L2005处理显著高于L2012处理(P<0.05)。
2.3 土壤细菌群落结构与理化因子关系
对土壤细菌优势门与环境因子进行Spearman 相关性分析(图2),结果表明放线菌门与土壤全磷和硝态氮极显著负相关(P<0.01),与有机碳和速效钾显著负相关(P<0.05),与pH 显著正相关;硝化螺旋菌门与有机碳和全磷极显著负相关(P<0.01),与硝态氮和速效钾呈显著负相关关系(P<0.05);芽单胞菌门与全氮和有机碳极
显著负相关(P<0.01);装甲菌门与全磷、硝态氮和速效钾极显著正相关(P<0.01),与有机碳显著正相关(P<0.05);酸杆菌门与有机碳极显著正相关(P<0.01),与全磷和速效钾显著正相关(P<0.05);变形菌门、浮霉菌门和拟杆菌门均与有机碳、全磷极显著正相关(P<0.01);变形菌门还与速效钾极显著正相关(P<0.01)。总而言之,有机碳和全磷对细菌群落结构影响明显。

表2 不同处理细菌优势属相对丰度Table 2 Microbial community composition at genus rank in different treatments(%)

图2 土壤环境因子与细菌门水平相关性热图Fig.2 Correlation heatmap between soil environmental factors and phylum of bacterial
为进一步揭示影响苜蓿种植地土壤细菌群落组成的土壤环境因子,以不同种植年限苜蓿土壤细菌属水平群落丰度为响应变量,土壤TN、NO3--N、SOC、TP、AP、AK 和 pH 为解释变量进行冗余分析(RDA)(图 3)。结果表明,Gaiella属、Solirubrobacter属、类诺卡氏菌属、芽球菌属、假节杆菌属与土壤全氮呈显著正相关关系,与全磷、速效磷和硝态氮呈显著负相关关系;芽球菌属、假节杆菌属、微枝形杆菌属与有机碳和速效钾显著正相关;Pir4_lineage、溶杆菌属与全磷、速效磷和硝态氮显著正相关,pH 与硝化螺菌属显著正相关。其中,土壤全磷(P=0.002)是影响苜蓿土壤细菌群落结构的最主要因素。

图3 细菌群落与环境因子的RDA 图Fig. 3 RDA ordination graph for the bacterial community and environmental factors
2.4 不同种植年限苜蓿土壤细菌PICRUSt 功能预测
为了解黄绵土细菌代谢功能,采用PICRUSt 软件进行功能预测。将预测得到的功能基因家族与KEGG 数据库比对发现,在一级功能代谢通路农田和苜蓿土壤获得相对丰度>1%的所有菌群的基因序列注释到的功能可分为6 类(图4):新陈代谢、环境信息处理、遗传信息处理、细胞转化、人类疾病和生物体系统,其中新陈代谢为农田和苜蓿土壤细菌最主要的功能,占比为69.20%~70.22%。与农田相比,苜蓿土壤微生物新陈代谢、生物体系统功能基因丰度显著提高(P<0.05);且随苜蓿种植年限延长,细胞转化功能基因、生物体系统功能基因呈增加趋势。

图4 不同种植年限土壤细菌功能基因KEGG 丰度图(一级功能层)Fig. 4 Soil bacterial function prediction in different growth years(hierarchy level 1)

图5 不同种植年限苜蓿土壤细菌功能多样性热图Fig.5 Heat map of bacterial functional diversity in alfalfa soil under different growth years
二级功能预测发现(图5),苜蓿土壤和农田土壤均有碳水化合物代谢、全局概览通路、氨基酸代谢、能量代谢、辅助因子和维生素代谢、膜运输、翻译、细胞运动、传染病:细菌、内分泌系统等46 个子功能,其中碳水化合物代谢(13.68%~13.95%)、全局概览通路(12.53%~12.63%)和 氨 基 酸 代 谢(11.75%~11.91%)为主要子功能。与农田相比,苜蓿土壤辅助因子和维生素代谢、核苷酸代谢、折叠、分类和降解、传染病:细菌、免疫系统和信号分子及相互作用功能基因显著降低(P<0.05);碳水化合物代谢、外源物质降解及代谢、萜类和酮类化合物代谢、内分泌系统、神经系统和物质依赖功能基因显著增加(P<0.05)。其中碳水化合物代谢、全局概览通路、氨基酸代谢、脂质代谢和外源物质降解及代谢等功能基因丰度随种植年限延长逐渐增加,能量代谢、辅助因子和维生素代谢、核苷酸代谢、翻译、复制和修复等功能基因丰度随种植年限延长逐渐降低,但不同种植年限苜蓿土壤的功能基因在二级功能层均未表现出明显差异。主成分分析(PCA)发现(图6),在PC1 和PC2轴上,农田、旺盛期苜蓿草地和衰败期苜蓿草地土壤微生物群落功能显著分开,解释度达46.94%和36.63%。农田土壤功能基因主要分布在第1、2 象限,衰败期苜蓿(L2003和L2005)土壤功能基因主要聚集在第3 象限,旺盛期(L2012)苜蓿土壤功能基因主要分布在第4 象限。由此推断,农田和苜蓿土壤细菌功能组成差异较大,且旺盛期苜蓿和衰败期苜蓿土壤细菌功能组成也存在一定差异。
3 讨论
3.1 种植年限对苜蓿土壤化学性质的影响

图6 细菌功能多样性主成分分析Fig.6 Principal component analysis of bacterial functional diversity
苜蓿属于深根系、高耗水的豆科固氮植物,持续种植多年后导致土壤剖面理化性质发生改变。种植苜蓿可增加土壤有机质和全氮含量,但苜蓿对磷含量耗竭强烈[5-6]。本研究发现,随着苜蓿种植年限延长,土壤全氮含量呈增加趋势,这与张春霞等[26]的研究结果一致,这是由于苜蓿为固氮作物,随着种植年限的增加,其根部受根瘤菌的侵入,刺激根部膨大形成的根瘤-苜蓿根共生关系逐渐稳定,根瘤菌固定到土壤中的氮素含量也随之增加,此外,随着苜蓿进入衰退期,生物量逐渐下降,苜蓿本身对氮素的需求量也逐渐下降,进而使得土壤氮素呈上升趋势[27]。而土壤中氮含量的增加会增强土壤氮的矿化速率,随着植物氮素对土壤中硝态氮的吸收,土壤氮平衡打破,使得硝化作用加强,进而导致其转化的硝态氮含量也逐渐提高,最后可能会引起土壤中硝态氮的富集[28],本研究中苜蓿土壤硝态氮含量的变化趋势与其相符。本研究还发现,土壤有机碳含量随着苜蓿种植年限的增加亦增加,这可能是由于随苜蓿种植年限延长,地上部的枯枝落叶和地下部的植物残根不断累积,再通过微生物腐解后形成腐殖质,增加了土壤有机碳含量,加之苜蓿土壤长期未翻耕扰动,促进了有机碳在表层的积累[10]。与土壤碳、氮不同的是,土壤全磷和速效磷含量随苜蓿种植年限延长而降低,这是因为仅在苜蓿建植当年施入磷肥,之后苜蓿多年生长过程中并添加磷肥,其生长中所需的磷营养只能从土壤中摄取,使得土壤速效磷在不断供应苜蓿生长过程中严重耗竭,且土壤中难溶性的磷也会因转化消耗而导致土壤全磷水平下降[6,29]。
3.2 种植年限对苜蓿土壤细菌群落结构的影响
土壤细菌群落结构受种植作物的影响[30],不同植物类型根系分泌物存在异质性,使得土壤微生物所处环境发生改变,细菌组成和丰度大小亦有差异[31]。本研究发现黄绵土农田和苜蓿人工草地土壤细菌群落组成相似,主要有放线菌门、变形菌门、酸杆菌门、绿弯菌门、浮霉菌门、芽单胞菌门、拟杆菌门、厚壁菌门、硝化螺旋菌门和装甲菌门10 类菌群,但是优势菌群的丰度有所变化。苜蓿土壤放线菌门相对丰度显著高于农田土壤,且随种植年限延长呈降低趋势。放线菌在纤维素、半纤维素降解以及果胶和木质素转化中起最主要的作用[32],为土壤提供养分且可以分泌多种抗生素类物质,而人工草地具有更多的抗生素资源[21];且农田土壤中C、N 营养远远低于苜蓿土壤,这可能是制约放线菌繁殖的因素,使其丰度不及苜蓿土壤。纤维素类物质是土壤有机质的重要组成部分,苜蓿属多年生固氮植物,刈割后凋谢物逐年累积,土壤有机质含量递增[10],但陇中黄土高原半干旱区多年平均降水量不足400 mm,远不能满足苜蓿生长对水分的需求,苜蓿持续种植10 年以后草地已经处于相当干燥的土壤水分环境[33],虽然苜蓿地土壤水分受当地降水量影响明显,但无论干旱还是半干旱区,种植苜蓿超过6~7 年土壤水分均大幅度降低[34],水分含量降低会影响到根系的生长和活力,从而影响到根系分泌物质的含量,因此会降低根际土壤中放线菌门相对丰度[35]。同时放线菌还具有解磷作用,其相对丰度对于土壤磷含量具有一定的指示作用[36],随着苜蓿生长年限的延长,苜蓿自身的生理代谢逐渐减弱、根系生长和活力会有一定程度下降,苜蓿自毒化感作用的增强导致土壤中可利用资源下降[37],进而对微生物群落结构造成影响。变形细菌能够利用有机物分解产生的氨气、甲烷等营养物质进行生长代谢活动[38]。本研究中变形菌门为农田土壤最优势菌群,这与刘泉成等[39]对玉米细菌群落的研究结论一致,农田土壤变形菌门丰度显著高于苜蓿土壤可能是由于种植的玉米CH4吸收量、N2O 排放量均高于苜蓿[40],为变形菌的生长代谢提供适宜的条件。变形菌门相对丰度随种植年限延长呈增加趋势,之后随着苜蓿生长的衰败又有所降低。长期种植苜蓿后,其枯枝落叶经微生物分解进入土壤,不断增加土壤有机碳含量,变形菌可利用有机碳为土壤提供固氮能力且对农田土壤养分循环有明显的促进作用[41-42],随苜蓿种植时间延长,其全氮含量与有机碳含量明显增加,为变形菌的生长代谢提供营养条件,使其丰度不断增加。此外作为富含蛋白质的豆科牧草,苜蓿根瘤结构可以显著提高生物量的积累,长期种植苜蓿后根系的生长和生理活性增加,根系分泌物有利于促进土壤微生物的繁衍,使其生命活动旺盛,引起与根际效应直接相关联的变形菌门相对丰度增加[43],但之后苜蓿草地开始退化,地上生物量减少,种间竞争增强产生自毒效应损害根系生长,降低根瘤菌的固氮能力[37],使变形菌门丰度略有降低。拟杆菌门与有机碳和全磷有显著正相关关系,可能是因为拟杆菌为富营养细菌,能有效利用土壤中C、P 营养[44],有机碳含量的累积为拟杆菌和酸杆菌的生长繁殖提供了有利条件。
在细菌属水平,苜蓿土壤Solirubrobacter属和类诺卡氏菌属相对丰度显著高于农田土壤,这与植被类型有关。Solirubrobacter属、芽孢杆菌属、链霉菌属和类诺卡氏菌属等可以通过产生抗生素类物质或植物生长素等的方式对植物病原菌产生拮抗作用[45-46]。苜蓿根系会分泌酚酸类等化感物质,在土壤中逐渐积累[47],部分促使与病原菌增加产生拮抗作用的益生菌活性增加。Gaiella属作为不同种植年限苜蓿土壤已分类的最优势属(2.56%~3.32%),相对丰度并未出现显著性差异,可能是因为隶属于放线菌的Gaiella属能产生种类繁多的抗生素,使土壤中大量储存抗生素产生菌资源,尤其是干旱、高温等逆境条件更有利于Gaiella属的生长繁殖[48]。长期种植苜蓿土壤硝化螺菌属含量逐渐降低,与土壤硝态氮含量显著负相关,可能是因为硝化螺菌属是典型的亚硝酸盐氧化菌,具有氨氧化作用,参与土壤中氮素循环,且适宜生存在硝态氮含量较低的地方[49];螺旋菌参与土壤硝化过程,且随着苜蓿种植年限的延长,根瘤菌不断固定大气中的氮素,土壤中的氮素含量呈现缓慢上升趋势,更多的氮转化为更有利于旱地植物吸收的硝态氮,而硝化螺旋菌以NH4+为底物,过高的pH 会降低其丰度[50]。本研究还发现,在属分类水平上稀有细菌类群占总数量的33.88%~39.26%,说明黄绵土中还存在未被挖掘利用的微生物资源,还须进一步探索。
3.3 种植年限对苜蓿土壤细菌功能基因的影响
PICRUSt 分析通过与KEGG 数据库比对,将微生物的变化情况和生物功能联系起来[17]。目前该方法已在不同植物土壤细菌功能研究中得到应用,为细菌的生态功能研究提供了帮助[51-53]。将黄绵土区农田和苜蓿土壤测序结果进行PICRUSt 功能预测分析发现,黄绵土主要有碳水化合物代谢、全局概览通路、氨基酸代谢、能量代谢、辅助因子和维生素代谢、膜运输、翻译、细胞运动、传染病∶细菌、内分泌系统等46 个功能基因,充分证明其功能丰富性。新陈代谢(69.20%~70.22%)通过摄取碳水化合物、氨基酸、能量和维生素等来保证细菌的存活成为细菌群落最主要的功能,这也印证相关研究的结论[52-53]。本研究中苜蓿土壤代谢功能显著高于农田土壤,主要体现在碳水化合物代谢、外源物质降解及代谢、萜类和聚酮类化合物代谢方面,这与土壤益生菌含量有一定关系,土壤微生物通过代谢活动促进植物生长、提高作物产量,而苜蓿土壤Solirubrobacter属和类诺卡氏菌属相对丰度显著高于农田,Solirubrobacter属、芽孢杆菌属、链霉菌属和类诺卡氏菌属等可以通过代谢产生抗生素类物质或植物生长素等方式对植物病原菌产生拮抗作用,促进植物生长[45-46,54]。苜蓿属为多年生草本,其根瘤菌的固氮作用较强,随种植时间的延长积累在地表的残留物增多,凋落物和根系的腐解程度增大,使土壤C、N 营养随可分解植物残茬的微生物增多而持续提高[30,55],促进碳水化合物、外源物质及萜类和聚酮类化合物代谢,提高其功能基因的丰度。本研究中与代谢相关的二级功能层中碳水化合物代谢、全局概览通路和氨基酸代谢占比较高,且功能基因丰度随种植年限延长逐渐增加。其中碳水化合物代谢通过植物光合作用产生并被其他生物消耗,调控生物体内碳水化合物的代谢形成、分解和相互转化[56];氨基酸代谢主要通过脱氨作用、转氨作用、联合脱氨或脱羧作用分解成α-酮酸、胺类及二氧化碳,氨基酸代谢与植株氮素的循环息息相关[52]。本研究发现种植苜蓿对土壤C、N 有累积作用,且随种植年限延长累积作用增强,并影响到土壤微生物活性,这与碳水化合物与氨基酸代谢丰度变化相呼应。
4 结论
1)与农田相比,种植紫花苜蓿土壤C、N 营养呈现增加趋势,P 营养呈现下降趋势,但速效钾含量在农田和苜蓿土壤间无明显差异。
2)半干旱雨养区黄绵土上共检测到细菌36 门90 纲192 目375 科715 属,其中门水平优势群落为放线菌门、变形菌门、酸杆菌门、绿弯菌门;已分类优势细菌属包括Gaiella属、硝化螺菌属、假节杆菌属、Solirubrobacter属。
3)紫花苜蓿土壤Solirubrobacter属丰度显著高于农田土壤;随苜蓿种植年限延长,Gaiella属和硝化螺菌属相对丰度逐渐降低,假节杆菌属、芽球菌属、链霉菌属和类诺卡氏菌属相对丰度逐渐增加;冗余分析表明,土壤全磷是影响细菌群落结构的主要环境因子。
4)黄绵土细菌生态功能较为丰富,在新陈代谢、环境信息处理、遗传信息处理、细胞转化、人类疾病和生物体系统方面表现活跃,其中农田土壤的代谢、生物体系统功能基因丰度均显著低于苜蓿土壤,而细胞转化功能和生物体系统功能基因随苜蓿种植年限延长显著增加。
