右美托咪定门静脉预处理对肝部分切除术患者肝脏缺血-再灌注损伤中炎症反应及氧化应激的价值分析
2021-03-22周瑜姝姜涛王子轩
周瑜姝 姜涛 王子轩

【摘要】 目的:分析右美托咪定門静脉预处理对肝部分切除术患者肝脏缺血-再灌注损伤中炎症反应及氧化应激的价值。方法:选择2016年2月-2020年1月全身麻醉下肝部分切除术105例患者,以随机数字表法分为A、B、C组,每组35例。A组在门静脉游离后经门静脉输注1.0 μg/kg右美托咪定,B组在门静脉游离后经颈内静脉输注1.0 μg/kg右美托咪定,C组在门静脉游离后经颈内静脉输注等量0.9%氯化钠注射液。三组于肝门阻断前10 min(T0)以及肝门开放后1 h(T1)、6 h(T2)、12 h(T3)采集颈内静脉血,检测指标包括肿瘤坏死因子-α(TNF-α)、白细胞介素-33(IL-33)、高迁移率族蛋白1(HMGB1)、血红素氧合酶-1(HO-1)、超氧化物歧化酶(SOD)。结果:与T0比较,各组T1、T2、T3的TNF-α、IL-33、HMGB1、HO-1均明显升高,SOD活性均明显降低(P<0.05)。与C组比较,A、B组T1、T2、T3的TNF-α、IL-33、HMGB1均明显下降,而HO-1、SOD均明显升高(P<0.05);与B组比较,A组上述各时间点的TNF-α、IL-33、HMGB1均明显下降,而HO-1、SOD均明显升高(P<0.05)。结论:右美托咪定门静脉预处理能显著减轻肝部分切除术患者肝缺血-再灌注损伤,使炎症反应与氧化应激得到有效抑制,并增强抗炎抗氧化能力。
【关键词】 门静脉 右美托咪定 氧化应激 肝脏缺血-再灌注损伤
Value of Dexmedetomidine Via Portal Vein Preconditioning on Inflammatory Response and Oxidative Stress in Hepatic Ischemia-reperfusion Injury in Patients with Partial Hepatectomy/ZHOU Yushu, JIANG Tao, WANG Zixuan. //Medical Innovation of China, 2021, 18(31): 00-010
[Abstract] Objective: To analyze the value of Dexmedetomidine via portal vein preconditioning on inflammatory response and oxidative stress in hepatic ischemia-reperfusion injury in patients with partial hepatectomy. Method: A total of 105 patients with partial hepatectomy under general anesthesia from February 2016 to January 2020 were selected and randomly divided into group A, group B and group C, 35 cases in each group. Group A received 1.0 μg/kg Dexmedetomidine via portal vein after portal vein dissociation, group B received 1.0 μg/kg Dexmedetomidine via internal jugular vein after portal vein dissection, and group C received intrajugular Dexmedetomidine after portal vein dissociation intravenous infusion of 0.9% Sodium Chloride Injection. The internal jugular vein blood samples were collected at 10 min (T0) before hepatic portal occlusion and at 1 h (T1), 6 h (T2), 12 h (T3) after hepatic portal opening. The detection indexes included tumor necrosis factor-α (TNF-α), interleukin-33 (IL-33), high mobility group protein 1 (HMGB1), heme oxygenase-1 (HO-1) and superoxide dismutase (SOD). Result: Compared with T0, TNF-α, IL-33, HMGB1, HO-1 at T1, T2, T3 in each group were significantly increased, and SOD activity were significantly decreased (P<0.05). Compared with group C, TNF-α, IL-33 and HMGB1 in group A and group B were significantly decreased at T1, T2, T3, while HO-1 and SOD were significantly increased (P<0.05). Compared with group B, TNF-α, IL-33, HMGB1 in group A were significantly decreased, while HO-1 and SOD were significantly increased (P<0.05). Conclusion: Dexmedetomidine via portal vein preconditioning in patients with partial hepatectomy can significantly reduce hepatic ischemia-reperfusion injury, effectively inhibit inflammatory reaction and oxidative stress, and enhance anti-inflammatory and antioxidant capacity.
[Key words] Portal vein Dexmedetomidine Oxidative stress Hepatic ischemia-reperfusion injury
First-authors address: Fukuang General Hospital of Liaoning Health Industry Group (Seventh Clinical College of China Medical University), Fushun 113008, China
doi:10.3969/j.issn.1674-4985.2021.31.002
目前肝脏缺血-再灌注损伤(hepatic ischemia-reperfusion injury,HIRI)已成为肝部分切除术后患者肝功能异常甚至肝衰竭的重要原因[1]。右美托咪定是一类高选择性α2肾上腺素能受体激动药,不仅能用于镇静、抑制交感神经活性,还具有潜在保护神经作用[2]。文献[3]报道经中心静脉或外周静脉输注右美托咪定后,可經不同途径抑制中性粒细胞浸润及肝巨噬细胞活化,使得细胞因子释放减少以发挥减轻HIRI的作用。本研究拟分析右美托咪定门静脉预处理对肝部分切除术患者HIRI中炎症反应与氧化应激的价值,现报道如下。
1 资料与方法
1.1 一般资料 选择2016年2月-2020年1月本院择期行肝部分切除术患者105例,其中男58例,女47例;年龄24~65岁,平均(45.2±6.9)岁;体重55~71 kg,平均(61.2±4.5)kg。纳入标准:(1)肝功能Child-Pugh A级;(2)ASAⅠ、Ⅱ级;(3)心脏功能及肾功能正常。排除标准:(1)既往存在严重其他系统疾病;(2)血小板异常、凝血功能异常;(3)有抗凝药服用史、肝胆手术史或糖尿病史。剔除标准:(1)在右美托咪定输注过程中出现不稳定血流动力学,即平均动脉压<60 mmHg或心率<60次/min,经阿托品等药物治疗无效;(2)术中肝门阻断≥2次;(3)术中出血量>800 mL或接受输血;(4)术后接受抗凝治疗。按随机数字表法将105例患者均分为A、B、C三组,每组35例。本研究入选患者或其家属均签署相关知情同意书,符合2013年修订的《赫尔辛基宣言》的要求,本研究经本院医学伦理委员会批准。
1.2 方法 所有患者术前常规禁食水,入手术室后常规麻醉诱导:静脉分别注射咪达唑仑(生产厂家:江苏恩华药业股份有限公司,批准文号:国药准字H20031037,规格:2 mL︰2 mg)0.05 mg/kg、舒芬太尼(生产厂家:宜昌人福药业有限公司,批准文号:国药准字H20054171,规格:1 mL︰50 μg)0.5 μg/kg、丙泊酚(生产厂家:意大利Corden Pharma S.P.A,批准文号:进口药品注册证号H20100646,规格:50 mL︰1 000 mg)2.0 mg/kg、罗库溴铵(生产厂家:浙江仙琚制药股份有限公司,批准文号:国药准字H20093186,规格:50 mg)0.6 mg/kg,面罩给氧5 min,气管插管进行机械通气。麻醉维持:经颈内静脉分别输注4~6 mg/(kg·h)丙泊酚、0.1~0.3μg/(kg·h)瑞芬太尼(生产厂家:宜昌人福药业有限公司,批准文号:国药准字H20030197,规格:1 mg)、0.1 mg/(kg·h)阿曲库铵(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20060869,规格:10 mg)联合吸入1%~2%七氟烷(生产厂家:上海恒瑞医药有限公司,批准文号:国药准字H20070172,规格:240 mL/瓶)。三组患者均由同一手术小组完成。开腹将手术部位充分暴露后,肝门阻断采取第一肝门阻断法[4],肝血流阻断时间≤20 min。其中A组在门静脉游离后经门静脉输注1.0 μg/kg右美托咪定(生产厂家:扬子江药业集团有限公司,批准文号:国药准字H20183219,规格:0.2 mg︰2 mL),B组在门静脉游离后经颈内静脉输注1.0 μg/kg右美托咪定,C组在门静脉游离后经颈内静脉输注等量0.9%氯化钠注射液;需于15 min内输注完毕,同时要维持稳定的血流动力学,即心率≥60次/min、平均动脉压≥60 mmHg。如心率<60次/min静脉注射0.5 mg阿托品;如平均动脉压<60 mmHg静脉注射6 mg麻黄碱(生产厂家:东北制药股份有限公司,批准文号:国药准字H21022412,规格:1 mL︰30 mg)或0.04 mg去氧肾上腺素(生产厂家:上海禾丰制药有限公司,批准文号:国药准字H31021175,规格:1 mL︰10 mg),必要时可重复给药。
1.3 观察指标 三组患者于肝门阻断前10 min(T0)以及肝门开放后1 h(T1)、6 h(T2)、12 h(T3)采集颈内静脉血,检测指标包括肿瘤坏死因子-α(TNF-α)、白细胞介素-33(IL-33)、高迁移率族蛋白1(HMGB1)(酶联免疫吸附法检测)、血红素氧合酶-1(HO-1)(免疫组织化学法检测)、超氧化物歧化酶(SOD)(黄嘌呤氧化酶法检测)。
1.4 统计学处理 采用SPSS 21.0软件对所得数据进行统计分析,符合正态分布的计量资料用(x±s)表示,多组间比较采用方差分析,组内比较采用重复测量数据方差分析,两两比较采用SNK-q检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
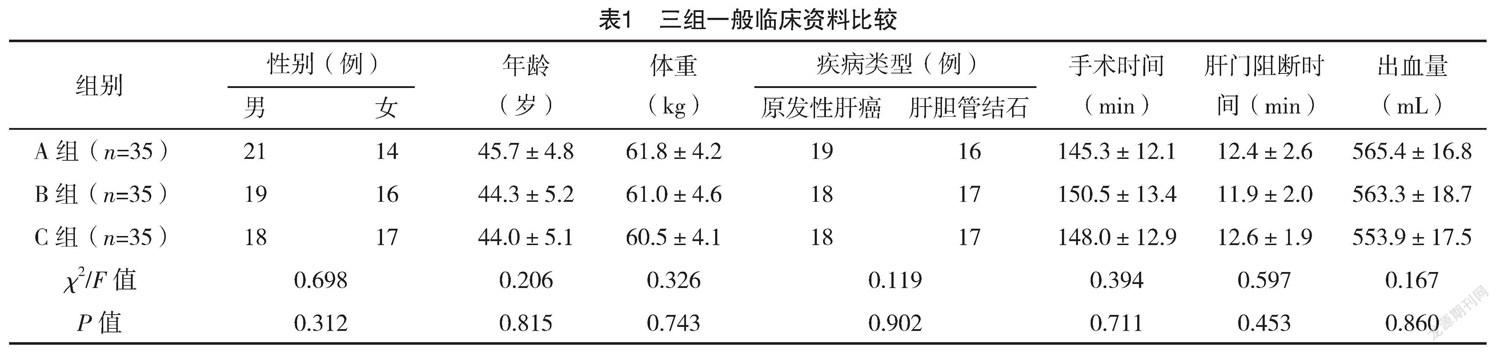
2.1 三组一般临床资料比较 三组一般临床资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
2.2 三组不同时间TNF-α、IL-33、HMGB1比较 与T0比较,三组T1、T2、T3的TNF-α、IL-33、HMGB1均明显升高(P<0.05)。与C组比较,A组与B组T1、T2、T3的TNF-α、IL-33、HMGB1均明显下降,同时与B组比较,A组上述各时间点的TNF-α、IL-33、HMGB1均明显下降,差异均有统计学意义(P<0.05)。见表2。
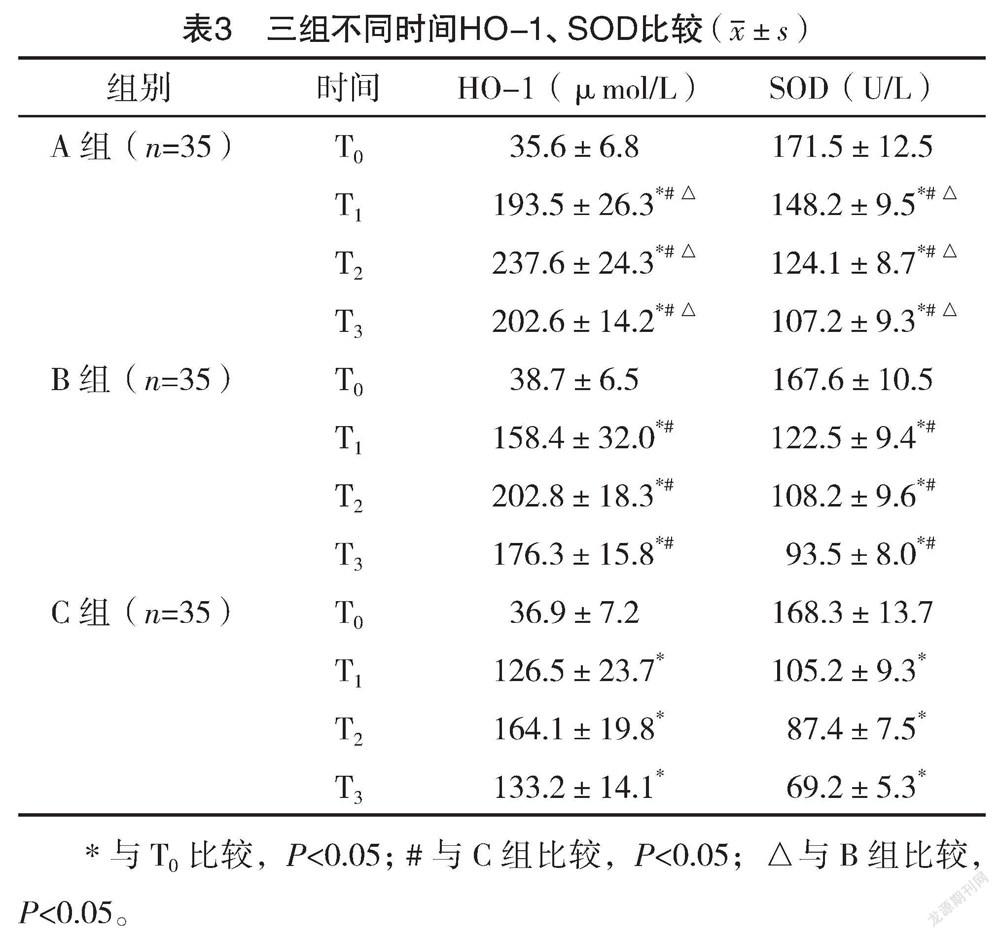
2.3 三組不同时间HO-1、SOD比较 与T0比较,三组T1、T2、T3的HO-1均明显升高,SOD均明显下降(P<0.05)。与C组比较,A组与B组T1、T2、T3的HO-1、SOD均明显升高,同时与B组比较,A组上述各时间点的HO-1、SOD均明显升高,差异均有统计学意义(P<0.05)。见表3。
3 讨论
右美托咪定作为镇静类药物已广泛使用于临床麻醉中,尤其应用于重要脏器功能障碍的全身麻醉中或实施重大手术时,其在避免器官功能恶化、保护器官功能中发挥极其重要的作用[5-7]。肝脏血供主要通过肝动脉与门静脉,而门静脉承担70%~75%的血供;因此通过门静脉输注右美托咪定后,其药物浓度能迅速在肝脏中达较高水平,可保护HIRI,同时能减少右美托咪定相关不良反应[8-9]。IL-33除了是细胞核转录调节因子,还作为细胞炎症因子参与炎症反应,在正常情况下其表达水平较低[10-11]。在HIRI中IL-33发挥重要作用,当机体处于缺血-再灌注的应激状态时,IL-33由肝细胞释放后经IL-33/ST2传导途径激活被浸润嗜中性粒细胞,促进机体发生全身炎症反应,同时IL-33表达水平亦随之明显升高[12-13]。HMGB1在机体发生HIRI时易引发炎症反应,可分泌促炎细胞因子如TNF-α、IL-6、NF-κB等[14-15]。文献[16]报道,IL-33保护肝细胞避免缺血-再灌注损伤以及炎症反应是以抑制HMGB1释放而发挥作用。本研究结果显示,与T0比较,三组T1、T2、T3的TNF-α、IL-33、HMGB1均明显升高(P<0.05),这也进一步证实术后在缺血-再灌注应激状态,各组均出现较为严重的炎症反应。HO-1属于内源性细胞保护酶,具有可诱导性,机体处于正常状态下其活性很低,而当细胞处于缺血缺氧、炎症反应等应激状态时则被激活[17-18]。而HO-1发挥抗氧化作用是将血红素降解成CO而抑制肝Kupffer细胞的活化来完成[19]。SOD是人体内抗氧化物酶反应的第一道体系,正常状态下其活性较高,SOD保护HIRI的作用是以清除活性氧自由基来完成的[20-21]。本研究结果显示,与T0比较,三组T1、T2、T3的HO-1均明显升高、SOD均明显下降(P<0.05);进一步证实术后在缺血-再灌注应激状态下HO-1被激活而SOD浓度下降,机体氧化应激反应加重。
本研究通过两种给药途径(门静脉与颈内静脉)输注右美托咪定,对比其对HIRI中炎症反应以及氧化应激指标的影响差异,结果提示,在炎症反应指标方面,A、B组T1、T2、T3的TNF-α、IL-33、HMGB1较C组均明显下降,同时A组上述各时间点的TNF-α、IL-33、HMGB1亦较B组均明显下降(P<0.05);在氧化应激指标方面,A、B组T1、T2、T3的HO-1、SOD较C组均明显升高,同时A组上述各时间点的HO-1、SOD亦较B组均明显升高(P<0.05)。可见右美托咪定对炎症因子发挥抑制其释放的作用,同时通过促进HO-1释放、升高SOD浓度发挥抗氧化应激的作用,能明显减低HIRI的影响。与颈内静脉给药途径相比,右美托咪定经门静脉预处理减低HIRI的作用则更加明显,分析其原因可能有以下几点:(1)经门静脉途径给予右美托咪定能有效维持肝内血药浓度;(2)经门静脉途径给予右美托咪定后,药物能直接对肝Kupffer细胞及肝实质细胞发挥作用而增强抗氧化能力;(3)经门静脉途径给药后除了扩张肝内动静脉,还可减轻肝窦的淤血,从而有效减低术后肝细胞炎症反应以及氧化应激程度。
综上所述,肝部分切除术患者右美托咪定经门静脉预处理能更有效抑制炎症因子并促进HO-1释放、增强SOD浓度,能显著减低HIRI,使炎症反应及氧化应激得到有效抑制,并增强抗炎抗氧化能力,这对行肝部分切除术患者实施肝门阻断的辅助用药可提供参考。
参考文献
[1] YAN Z Z,HUANG Y P,WANG X,et al.Integrated Omics Reveals Tollip as an Regulator and Therapeutic Target for Hepatic Ischemia-Reperfusion Injury in Mice[J].Hepatology,2019,70(5):1750-1769.
[2]陈元良,徐丽丽,张磊,等.乌司他丁联合右美托咪定对幕上肿瘤切除术患者氧化应激及S100β和NSE的影响[J].中华全科医学,2018,16(1):41-43.
[3] ZHOU Z,CHEN Q,WAN L,et al.Dexmedetomidine protects hepatic cells against oxygen-glucose deprivation/reperfusion injury via lncRNA CCAT1[J].Cell Biol Int,2018,42(9):1250-1258.
[4] Donadon M,Molinari A F,Corazzi F,et al.Pharmacological Modulation of Ischemic-Reperfusion Injury during Pringle Maneuver in Hepatic Surgery.A Prospective Randomized Pilot Study[J].World J Surg,2016,40(9):2202-2212.
[5]中国心胸血管麻醉学会.右美托咪定在心血管麻醉和围术期应用的专家共识(2018)[J].临床麻醉学杂志,2018,34(9):914-917.
[6]李春香,马虹.开胸食管癌根治术患者单肺通气时经远程缺血预处理联合右美托咪啶对肺组织损伤的意义[J].中国医师进修杂志,2016,39(1):46-49.
[7]刘清仁,肖英,张学伟,等.关节腔注射罗哌卡因复合右美托咪定或吗啡用于膝关节镜术后镇痛效果比较[J].中国综合临床,2016,32(8):694-697.
[8]李红霞,翁亦齐,喻文立,等.右美托咪定预先给药对肝缺血再灌注致大鼠心肌损伤时JAK/STAT信号通路的影响[J].中华麻醉学杂志,2019,39(1):44-47.
[9]王清平,王永旺,杜洪印,等.右美托咪定对自体原位肝移植术大鼠肝缺血再灌注时程序性坏死的影响[J].中华麻醉学杂志,2019,39(12):1484-1487.
[10] Allinne J,Scott G,Lim W K,et al.IL-33 blockade affects mediators of persistence and exacerbation in a model of chronic airway inflammation[J].J Allergy Clin Immunol,2019,144(6):1624-1637.
[11]刘琼,杨歆,唐简,等.慢性乙型肝炎患者外周血单个核细胞Tim-3和血清IL-33表达及临床意义[J].中华医院感染学杂志,2020,30(13):2014-2017.
[12] Hatzioannou A,Banos A,Sakelaropoulos T,et al.An intrinsic role of IL-33 in T(reg) cell-mediated tumor immunoevasion[J].Nat Immunol,2020,21(1):75-85.
[13]刘静,施炜,孙泽丽.特布他林联合羧甲司坦片治疗哮喘急性发作的临床疗效及对血清IL-33、CRP、TNF-α的影响[J].医学综述,2019,25(19):3939-3943.
[14]许勇,应荣超.X染色体连锁的凋亡抑制蛋白、高迁移率族蛋白1及波形蛋白在胃癌中的表达及意义[J].中华实验外科杂志,2020,37(1):141-143.
[15] Cheng K J,Alshawsh M A, Mejia Mohamed E H,et al.
HMGB1:an overview of its versatile roles in the pathogenesis of colorectal cancer[J].Cell Oncol(Dordr),2020,43(2):177-193.
[16] LI Z L,GAO M,YANG M S,et al.Sesamin attenuates intestinal injury in sepsis via the HMGB1/TLR4/IL-33 signalling pathway[J].Pharm Biol,2020,58(1):898-904.
[17]董貝贝,张智申,杨永妍,等.HO-1在血红素结合蛋白减轻大鼠脑缺血再灌注损伤中的作用[J].中华麻醉学杂志,2020,40(3):342-346.
[18] Akamatsu Y,Pagan V A,Hanafy K A.The role of TLR4 and HO-1 in neuroinflammation after subarachnoid hemorrhage[J].
J Neurosci Res,2020,98(3):549-556.
[19] Abdel-Gaber S A,Geddawy A,Moussa R A.The hepatoprotective effect of sitagliptin against hepatic ischemia reperfusion-induced injury in rats involves Nrf-2/HO-1 pathway[J].Pharmacol Rep,2019,71(6):1044-1049.
[20] Dworzański J,Strycharz-Dudziak M,Kliszczewska E,et al.
Glutathione peroxidase(GPx) and superoxide dismutase(SOD) activity in patients with diabetes mellitus type 2 infected with Epstein-Barr virus[J/OL].PLoS One,2020,15(3):e0230374.
[21]黄蕾,杨全伟,夏俊锋,等.鼠麴草醇提物对大鼠肝脏缺血再灌注损伤的保护作用及机制研究[J].中国药师,2020,23(11):2114-2117.
(收稿日期:2021-01-20) (本文编辑:程旭然)
