固相反应对纳米钙基CO2吸附剂自激活的影响
2021-03-19吴素芳
刘 昊, 吴素芳
固相反应对纳米钙基CO2吸附剂自激活的影响
刘 昊, 吴素芳
(浙江大学 化学工程与生物工程学院, 浙江 杭州 310027)
为了探究纳米钙基吸附剂中掺杂剂与CaO之间发生的固相反应对其自激活过程的影响,对比纳米CaO与MgO、Al2O3、TiO2和ZrO2等掺杂的合成吸附剂的微观结构以及20次钙循环中的自激活性能。结果表明,热预处理阶段发生的固相反应增加吸附剂初始结构的致密性,可以提高自激活程度。另外钙钛矿盐迁移到CaO晶粒团聚体的表面防止二次聚并,可以避免新增的活性比表面积损失,提高自激活稳定性。
CO2吸附;钙循环;纳米CaO;自激活;稳定性
1 前 言
利用CaO-CaCO3的碳酸化-热分解可逆反应进行高温CO2捕集的技术被称为钙循环技术(calcium looping,CaL)[1]。该技术不仅可以有效降低碳排放,也能够强化特定的工艺过程[2-6]。但CaL技术的发展面临一个瓶颈问题,即CaO基吸附剂的吸附容量在高温循环过程中经常因烧结而迅速衰减[7],这将影响该技术的经济性[8]。因此目前许多研究工作集中在提升吸附剂循环吸附容量的稳定性[9],其中最有效的方法包括热预处理[10-11]以及引入热稳定性更好的掺杂剂[11-16]。Manovic等[17]发现天然石灰石基吸附剂在900~1 200 ℃下热预处理6~48 h后再经历钙循环过程,其最初几次的循环吸附容量会出现反常的升高现象,他们将其定义为钙基吸附剂的“自激活现象”,这一现象可以有效解决吸附剂初始钙循环的吸附容量衰减问题[18],从而制得兼具高吸附容量和高稳定性的吸附剂。随后,Manovic等[17]提出了石灰石基吸附剂的“孔隙-骨架”模型,将其自激活触发的原因解释为CaO软-硬骨架的转化。合成CaO基吸附剂自激活现象的研究并不多见[11,19-20],其中纳米CaO基吸附剂的钙前驱体粒径(几十~几百纳米)[21]比石灰石基吸附剂(>1mm)更小,而且成分不同,因此自激活的机理有区别。Lan等[20]曾提出纳米CaO基吸附剂自激活的“颗粒-核-孔”模型,说明纳米CaO微晶团聚体的碎裂过程是触发自激活现象的原因。自激活过程可以划分为2个阶段:吸附容量快速升高的“激活段”和吸附容量停止增长并开始衰减的“稳定段”。“激活段”中吸附容量增长程度可定义为“自激活程度”,而“稳定段”中吸附容量衰减程度可定义为“自激活稳定性”,二者共同决定吸附剂最终稳定的吸附水平,可以用来描述并比较不同吸附剂的自激活性能。含有不同掺杂剂的钙基吸附剂自激活性能具有明显的差异[22-24],但原因尚不清楚。例如纳米CaO@CaTiO3吸附剂自激活稳定性优于纳米CaO@MgO吸附剂[20],然而已知CaTiO3的热稳定性(塔曼温度851 ℃)比MgO更差(塔曼温度1 150 ℃)[25],可见掺杂剂CaTiO3对自激活性能的影响并不在于其热稳定性。有别于纳米CaO@MgO吸附剂,纳米CaO@CaTiO3吸附剂在热预处理阶段中CaO与TiO2会发生固相反应生成CaTiO3,因此推测固相反应的过程可能会对吸附剂的微观结构产生影响,从而导致自激活性能不同。
本文采用相同的湿式混合法制备不发生固相反应的纳米CaO@MgO吸附剂以及发生固相反应的纳米CaO@CaTiO3、CaO@CaZrO3和CaO@CaO·Al2O3吸附剂,其中CaO·Al2O3表示多种铝酸钙产物的混合。通过比较纳米CaO和4种合成吸附剂的微观结构演变和循环吸附性能,研究固相反应对吸附剂自激活触发和稳定性的作用。
2 实验部分
2.1 吸附剂的制备
以纳米CaO@MgO吸附剂湿式混合法制备过程为例,分为镁溶胶制备、纳米CaCO3与镁溶胶的混合以及热预处理。将轻质氧化镁(分析纯,国药集团化学试剂有限公司)加入去离子水中制成氧化镁浆料,将配制好的质量分数=35%的柠檬酸溶液(分析纯,国药集团化学试剂有限公司)逐滴加入氧化镁浆料中直至pH=6.5~7,随后在50℃水浴中加热2 h形成柠檬酸镁溶胶。将粒径大约70 nm的纳米CaCO3粉末(>95%,浙江菱化集团有限公司)超声分散在蒸馏水中,取一定量的柠檬酸镁溶胶滴加至纳米CaCO3悬浊液之中(Ca与Mg的摩尔比为8:1),随后在80℃水浴中加热搅拌6 h。将蒸干的混合浆料置于110℃烘箱中干燥过夜,所得的块状样品研磨成60~80 μm的颗粒。所得样品先在马弗炉中550℃空气气氛下煅烧4 h以分解脱除柠檬酸根。随后升温至850℃并切换氮气气氛煅烧1 h,使CaCO3转化为CaO并触发自激活。纳米CaO@CaTiO3、CaO@CaZrO3和CaO@CaO·Al2O3吸附剂的制备方法与纳米CaO@MgO相同。其中钛溶胶和锆溶胶分别是由二氧化钛(分析纯,国药集团化学试剂有限公司)和二氧化锆(分析纯,国药集团化学试剂有限公司)与柠檬酸反应制得,而铝溶胶(淄博金琪化学试剂公司)则采用商业试剂。Ca与Ti、Ca与Zr和Ca与Al的摩尔比均设为8:1。为探究热预处理时长对自激活性能的影响,另外将纳米CaO@CaTiO3吸附剂在850℃下的煅烧时间延长至2~4 h。
2.2 吸附剂的表征
用X射线衍射仪(X-ray diffraction,XRD,D/MAX-RA,Rigaku, Japan)测定吸附剂组分的晶相,衍射角范围为10°~80°,各组分的特征峰由Jade6.0软件直接读取。CaO的晶粒尺寸可由Scherrer公式(式(1))计算[26]。另外,采用日本BEL公司生产的SORP-mini II型测试仪,在-196 ℃液氮环境下检测吸附剂的孔结构并进行比表面积分析和平均孔径分析,比表面积分析采用BET(Brunauer-Emmett-Teller)方法,平均孔径分析采用BJH(Barrett-Joyner-Halenda)方法。用透射电镜(transmission electron microscope,TEM,JEM-2100F,JEOL,Japan)和能谱仪(energy dispersive spectrometer,EDS)研究吸附剂的形貌。

式中:为晶粒垂直于晶面方向的平均厚度,nm;为Scherrer常数,0.89;为X射线波长,0.154 056 nm;为实测样品衍射峰半高宽度,rad;为衍射角,(o)。
2.3 吸附剂自激活性能的评价与指标
采用热重分析仪(thermal gravimetric analyzer,TGA,Pyris1,Perkin Elmer)测试CO2吸附容量,测试条件为:吸附剂重量2 mg,气体总流量53 mL×min-1,在700 ℃与0.02 MPa的CO2分压下(N2平衡)吸附10 min,随后升温至730 ℃,并切换纯N2气氛再生10 min,即组成1次钙循环过程,共经历20次钙循环以考察吸附剂循环稳定性。为探究钙循环条件对自激活性能的影响,对纳米CaO@CaTiO3吸附剂在600 ℃下吸附和850 ℃下再生的循环稳定性进行了测试。为获取足够质量的吸附剂来测试其不同钙循环次数下CaO的平均粒径和孔结构的演化情况,另取1 g吸附剂在12 mm×1 mm、=400 mm的实验室级固定床反应器[26]中进行与TGA条件相同的钙循环过程。根据式(2)[27]计算吸附容量的大小,此外定义两个新的指标来量化吸附剂自激活的性能,包括自激活程度:吸附容量增加的比例(式(3)),以及自激活稳定性:吸附容量衰减的比例(式(4))。

(3)

3 结果与讨论
3.1 不同掺杂剂对吸附剂初始结构影响
本节通过测试并对比纳米CaO、纳米CaO@MgO、CaO@CaTiO3、CaO@CaZrO3和CaO@CaO·Al2O35组吸附剂在热预处理之后的微观结构,以判断不同掺杂剂对吸附剂预烧结情况的影响。
图1是4组含有不同掺杂剂的吸附剂XRD测试结果,可以看出马弗炉中850 ℃下煅烧1 h后,大部分CaCO3分解成CaO,仅有少量CaCO3未分解。MgO的晶相被完整保留,TiO2和ZrO2分别与CaO发生固相反应生成CaTiO3和CaZrO3,而Al2O3与CaO之间的固相反应生成多种铝酸钙产物,包括Ca12Al14O33、Ca3Al2O6和CaAl2O4。上述结果表明,该热预处理条件可以满足TiO2、ZrO2和Al2O3与CaO发生固相反应的需求。
根据XRD测试结果和谢勒公式计算得到5组吸附剂中CaO晶粒平均粒径,数据结果如表1所示。纳米CaO吸附剂热预处理之后CaO晶粒平均粒径为54.0 nm,纳米CaO@MgO吸附剂为55.2 nm,二者十分接近。而发生了固相反应的纳米CaO@CaTiO3、CaO@CaZrO3和CaO@CaO·Al2O3吸附剂拥有更小的CaO粒径,分别为44.8、44.4和45.7 nm。上述结果说明固相反应生成的CaTiO3、CaZrO3和CaO·Al2O3可以更有效地减缓CaO在热预处理阶段的生长速度。另外,表1中也列举5组吸附剂的孔结构测试结果。与纳米CaO吸附剂(5.45 m2×g-1)相比,MgO的掺杂可以提高吸附剂在热预处理后的比表面积(7.32 m2×g-1),而存在固相反应的纳米CaO@CaTiO3、CaO@CaZrO3和CaO@CaO·Al2O3吸附剂拥有更低的比表面积(4.40,4.31和4.76 m2×g-1),这说明固相反应的发生使得吸附剂中晶粒团聚更紧密。综上,固相反应的发生在使吸附剂结构更致密化的同时,也能限制CaO晶粒的热生长。

图1 纳米CaO基吸附剂XRD测试结果
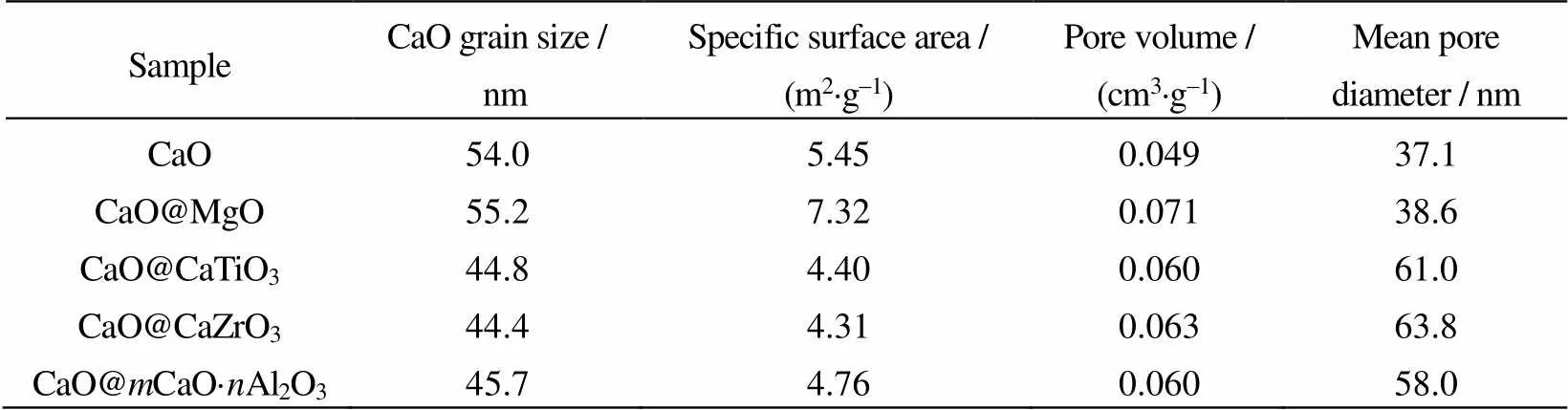
表1 掺杂剂对CaO晶粒粒径和孔结构的影响
3.2 不同掺杂剂对吸附剂自激活性能影响
为了对比不同纳米CaO基吸附剂的自激活性能,选取纳米CaO和4组合成吸附剂进行了20次钙循环过程中的吸附容量测试,结果如图2所示。5组吸附剂都呈现出明显的自激活现象,自激活性能指标的计算结果列于表2中,其中自激活稳定性的负值表示吸附容量的衰减程度。
纳米CaO@MgO吸附剂的自激活程度(9.7%)明显低于无掺杂剂的纳米CaO(19.1%),这与一般的观点相违背[20],即掺杂剂反而对吸附剂的自激活过程带来不利影响。由纳米钙基吸附剂的自激活机理可知[20],自激活触发的前提是热预处理阶段中吸附剂微观结构的致密化,而由3.1节可知MgO的掺杂导致吸附剂比表面积增大,说明其阻碍了致密化进程,因此不利于自激活。另外纳米CaO@MgO吸附剂的自激活稳定性(-22.2%)与纳米CaO(-19.0%)相近,说明MgO并不能阻止自激活之后吸附剂的二次失活,抗烧结性较差。这些结果都表示掺杂剂MgO对吸附剂的自激活性能不利。纳米CaO@CaO·Al2O3、CaO@CaTiO3、CaO@CaZrO3吸附剂的自激活程度(15.7%、20.8%、21.9%)和稳定性(-5.7%、-2.2%、-0.6%)依次升高,原因是3种钙钛矿盐的塔曼温度依次升高(Ca12Al14O33-725 ℃、CaTiO3-851 ℃、CaZrO3-1 036 ℃[25])。与纳米CaO@MgO吸附剂相比,含有固相反应的吸附剂自激活性能得到了明显的提升,因为固相反应在热预处理阶段促进了吸附剂的结构致密化,并且钙钛矿盐减缓了纳米CaO微晶的热生长。
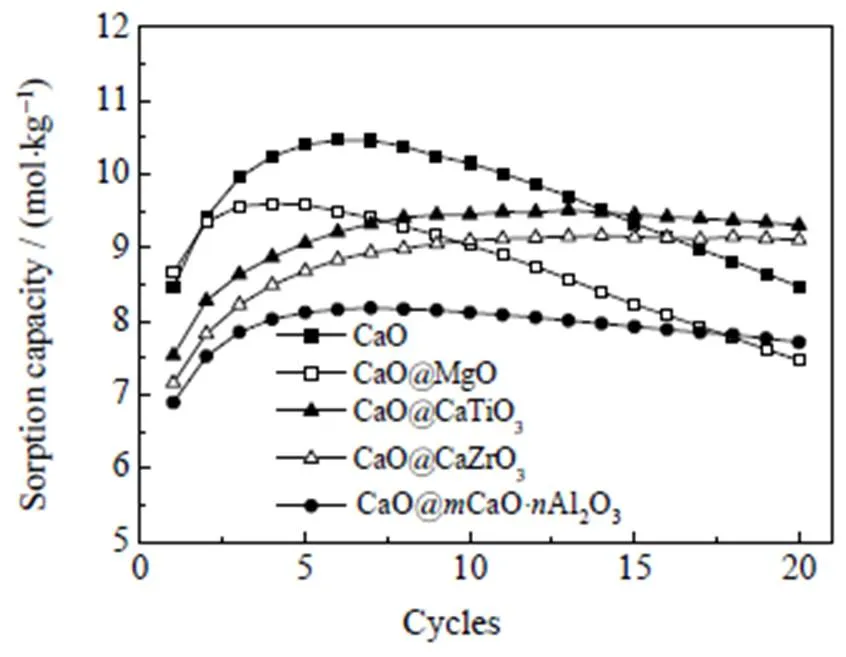
图2 纳米CaO基吸附剂循环吸附容量测试结果

表2 纳米CaO基吸附剂的自激活性能指标
3.3 固相反应对吸附剂自激活性能的影响机理
为解释固相反应对吸附剂自激活过程的作用机理,需要探究吸附剂在钙循环过程中的微观结构变化。本节选择纳米CaO@CaTiO3和CaO@MgO吸附剂分别作为有无固相反应的吸附剂样品,并取它们经历5次和10次钙循环后的样品对比。CaO@MgO-和CaO@CaTiO3-中的“”表示第个钙循环周期后获得的样品。
之前的研究表明[26],采用商业纳米碳酸钙粉末作前驱体的纳米钙基吸附剂的比表面积大多在10 m2×g-1左右,可以满足碳酸化反应的需求。此外孔结构与自激活存在对应的关系[27],即自激活与比表面积和孔隙量的增加有关。表3描述2组吸附剂样品在5次、10次钙循环后CaO晶粒平均粒径和孔结构的测试结果。与表2中新鲜剂的测试结果对比发现,5次钙循环后,纳米CaO@MgO和CaO@CaTiO3吸附剂都出现CaO晶粒平均尺寸减小(50.3和44.5 nm),比表面积增大(12.63和5.51 m2×g-1)的情况。这说明2组吸附剂的自激活过程都是伴随着CaO微晶团聚体的开裂,因为钙循环过程中摩尔体积有差别的CaCO3与CaO之间的转化会带来预先烧结的吸附剂结构的改变,这符合纳米钙基吸附剂自激活的触发机理[20]。团聚体的开裂暴露出部分更小粒径的纳米CaO,从而提供了更多的活性比表面积。与5次钙循环相比,10次钙循环后,纳米CaO@MgO吸附剂的CaO晶粒平均尺寸重新升高(52.2 nm)且比表面积下降(8.58 m2×g-1),纳米CaO@CaTiO3吸附剂的CaO晶粒平均尺寸继续减小(41.4 nm)且比表面积仍然增大(6.90 m2×g-1)。这说明经过更多的钙循环次数后,纳米CaO-MgO吸附剂中CaO微晶重新团聚烧结,活性比表面积损失。而固相反应生成的CaTiO3可以有效阻止CaO微晶的二次团聚烧结,继续使比表面积增加,活性CaO粒径减小。此外,纳米CaO@MgO与纳米CaO@CaTiO3吸附剂的孔径分布演化如图3所示。5次钙循环后,团聚体开裂使纳米CaO@MgO吸附剂中直径2 nm左右的孔分布显著增加,但是10次钙循环后,这些孔的数量迅速减少。其先增后降的规律与表3中粒径和比表面积的结果一致,说明纳米CaO@MgO吸附剂增加的比表面积主要由微孔提供。而团聚体开裂使纳米CaO@CaTiO3吸附剂中增加的孔径尺寸为10~35 nm,说明纳米CaO@CaTiO3吸附剂增加的比表面积主要由介孔提供。

表3 钙循环过程中吸附剂的CaO晶粒粒径和孔结构演化
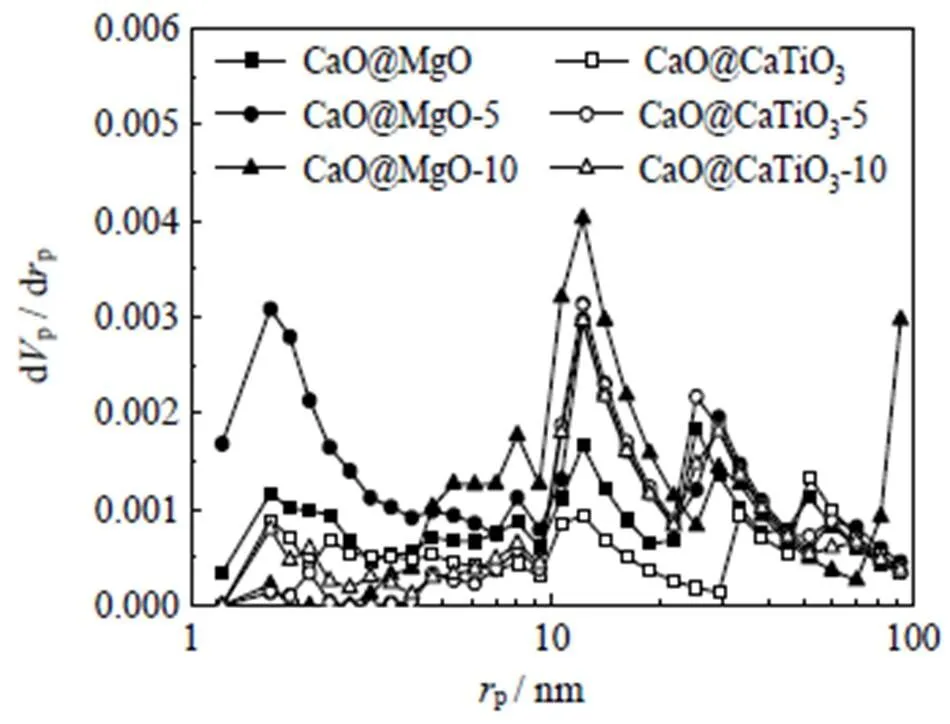
图3 钙循环过程中吸附剂的孔径分布演化
形貌表征可以更直观地显示吸附剂微观结构演变过程。图4(a)~(d)和图6(a)~(d)分别是纳米CaO@MgO及CaO@CaTiO3新鲜吸附剂的TEM和EDS图像,而图5(a)~(d)和图7(a)~(d)分别是纳米CaO@MgO及CaO@CaTiO3吸附剂在经历10次钙循环后的TEM和EDS图像。对比图4(a)和图6(a),两组吸附剂在热预处理后都经历预烧结,即形成了纳米CaO晶粒团聚体(以下简称为团聚体),但纳米CaO@CaTiO3吸附剂团聚体致密化程度比纳米CaO@MgO吸附剂严重。由图6(c)可知Ti元素存在的区域团聚体致密化程度更严重,说明TiO2与CaO发生固相反应是吸附剂预烧结程度加剧的原因。而经过10次钙循环后,纳米CaO@MgO吸附剂中CaO微晶团聚烧结变得严重(图5(a)),但纳米CaO@CaTiO3吸附剂中大尺寸团聚体转化为小尺寸团聚体,且分散良好(图7(a))。Mg元素仍在大团聚体内均匀分散(图5(c)),未起到抗团聚烧结的效果。Ti元素则迁移到小团聚体表面(图7(c)),从而有效阻止小团聚体的二次聚并,使新生成的活性位点得以保留,因此提升吸附剂的自激活性能。综上,固相反应可以增加热预处理阶段吸附剂的致密化程度,从而提高了自激活程度;同时钙钛矿盐迁移到小尺寸团聚体的表面防止二次聚并,使得增加的活性比表面积能够保持稳定,有助于提高自激活稳定性。
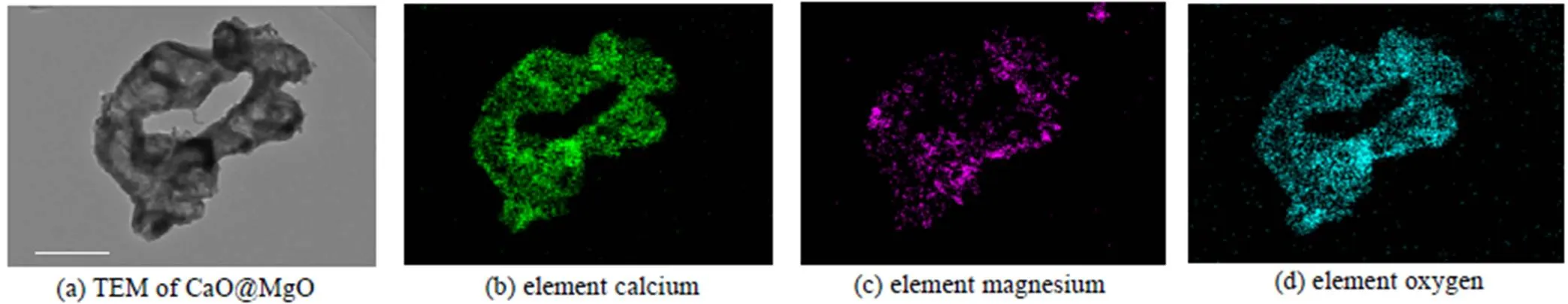
图4 CaO@MgO的TEM和EDS图
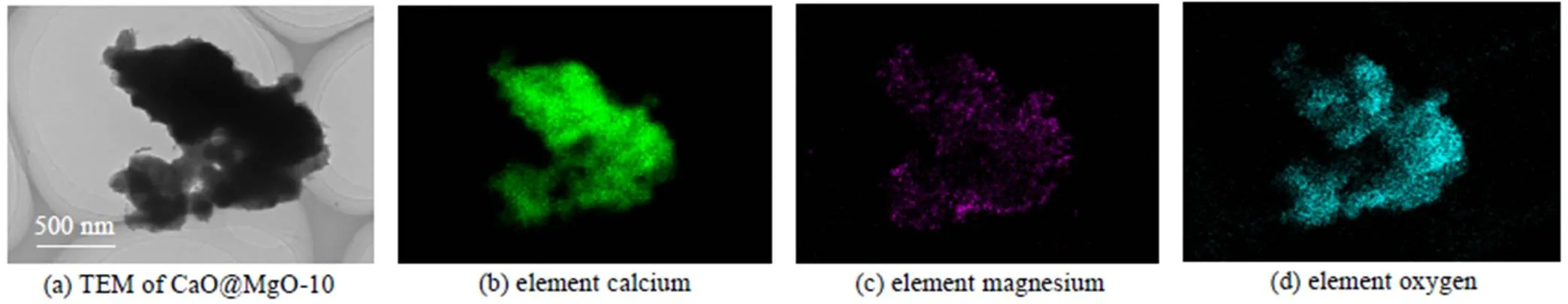
图5 CaO@MgO-10的TEM和EDS图
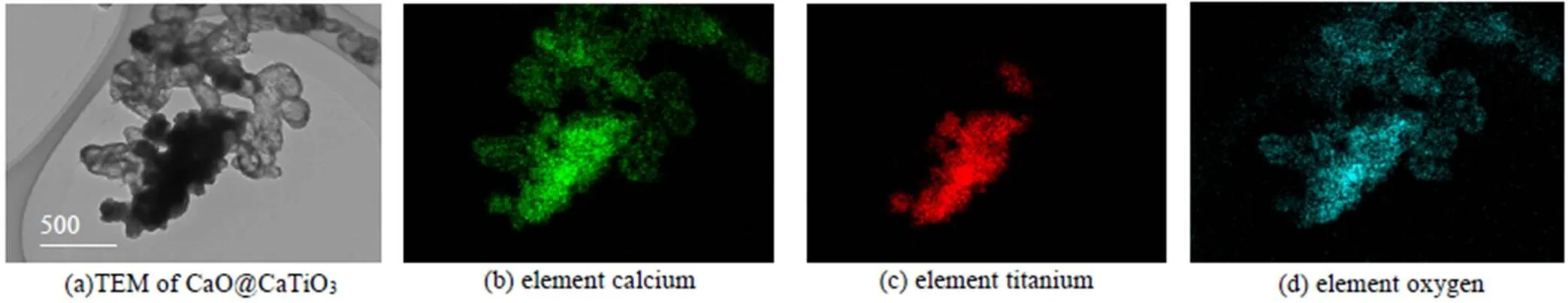
图6 CaO@CaTiO3的TEM和EDS图
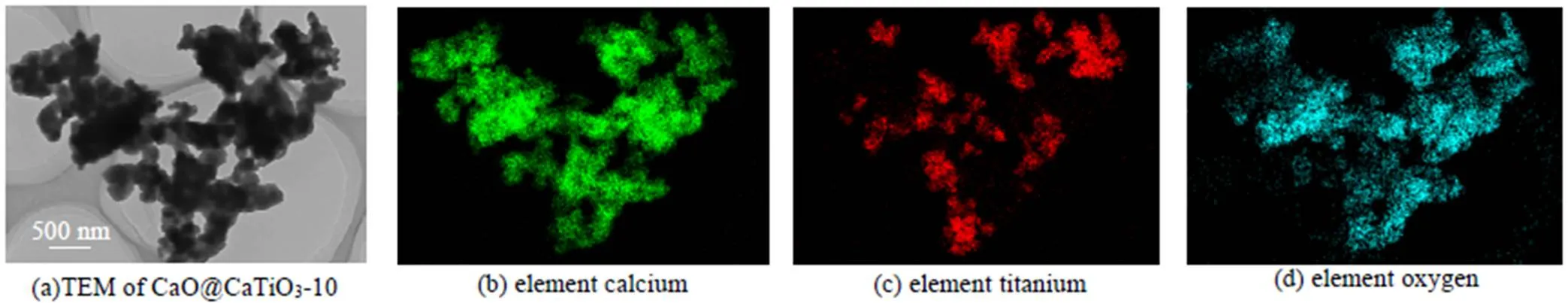
图7 CaO@CaTiO3-10的TEM和EDS图
3.4 严苛条件对吸附剂自激活性能的影响
含有固相反应的纳米CaO@CaTiO3吸附剂在严苛的制备条件(热预处理时长延长至2~4 h)和钙循环条件(吸附温度降至600℃,再生温度升至850℃)下自激活性能的变化仍需进一步探究。图8中对比热预处理温度850℃下,时长分别为1、2和4 h时纳米CaO@CaTiO3吸附剂20次钙循环过程中吸附容量演化情况。可以看出,当时长由1 h分别提升至2 h和4 h时,初始吸附容量由7.5 mol×kg-1降低至5.9和4.4 mol×kg-1,但自激活程度由20.8% 明显提升至40% 和41.4%,自激活稳定性由-2.2%变为-1.1%和-3.3%。这说明煅烧时长2 h虽然导致吸附剂的初始吸附水平变差,但自激活程度可以得到明显提升,且稳定性得以保持。但煅烧时长延长至4 h并不能继续提升吸附剂的自激活性能,相反会导致整体吸附水平下降[12]。图9对比了纳米CaO@CaTiO3吸附剂在3组不同钙循环条件下的20次钙循环吸附容量演化情况,分别为(1)低吸附温度条件(600 ℃/730 ℃);(2)温和条件(700 ℃/730 ℃)和(3)高再生温度条件(700 ℃/850 ℃)。结果表明,当吸附温度低至600 ℃时,吸附剂的自激活现象基本消失,且稳定性明显变差,这说明纳米CaO@CaTiO3吸附剂自激活现象的触发依赖于高吸附温度。而当再生温度高至850 ℃时,吸附剂的自激活现象可以触发,但稳定性明显变差,说明高再生温度将导致自激活增加的活性位点因烧结加剧而再次损失。综上,高吸附温度和低再生温度对吸附剂的自激活性能更有利。
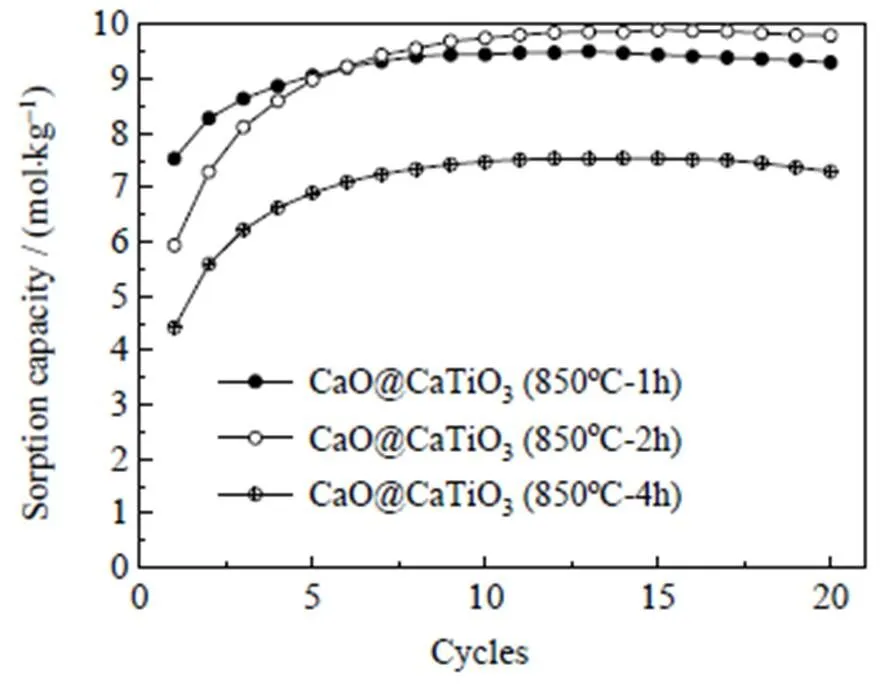
图8 热预处理时长对自激活性能影响
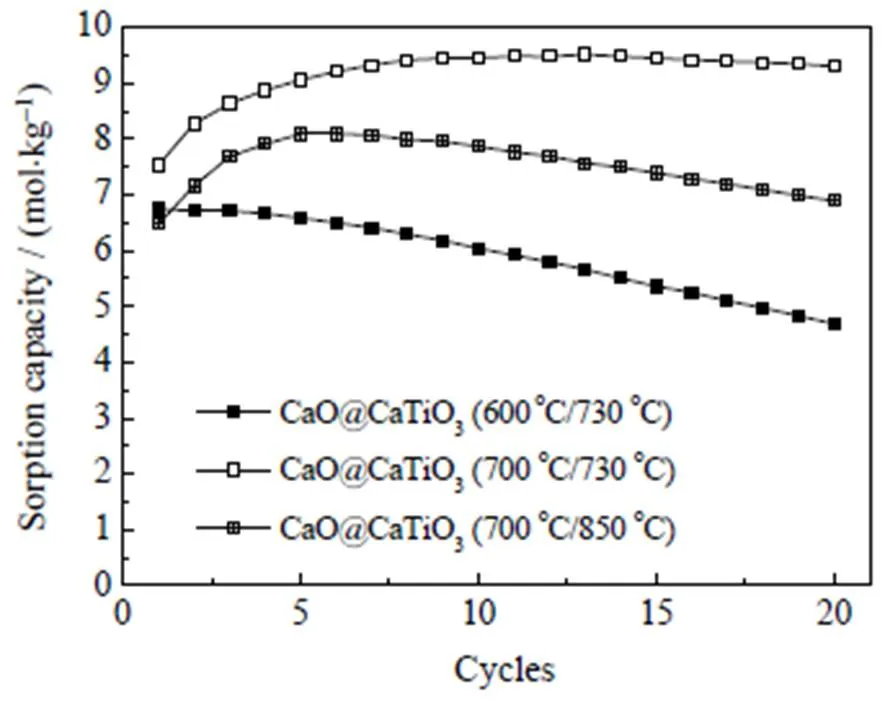
图9 钙循环条件对自激活性能影响
4 结 论
探究掺杂剂对纳米钙基吸附剂的自激活性能的影响机理,有利于制备兼具高吸附容量和高稳定性的吸附剂。本文通过比较纳米CaO、CaO@MgO、CaO@CaTiO3、CaO@CaZrO3和CaO@CaO·Al2O3吸附剂样品的自激活性能的差异,旨在研究掺杂剂TiO2、ZrO2、Al2O3和CaO之间固相反应的发生对自激活性能的影响。结果表明,固相反应可以使吸附剂的自激活性能得到明显提升,因为固相反应增加热预处理阶段吸附剂的致密性,从而提高了自激活程度。同时自激活后吸附剂中钙钛矿盐会迁移到小尺寸团聚体表面防止二次聚并,使得增加的活性比表面积能够保持稳定,有助于提高自激活稳定性。
[1] SHIMIZU T, HIRAMA T, HOSODA H,. A twin fluid-bed reactor for removal of CO2from combustion processes [J]. Chemical Engineering Research & Design, 1999, 77(1): 62-68.
[2] LACKNER K. A guide to CO2sequestration [J]. Science, 2003, 300(5626): 1677-1678.
[3] WU S F, BEUM T H, YANG J I,. The characteristics of a sorption-enhanced steam-methane reaction for the production of hydrogen using CO2sorbent [J]. Chinese Journal of Chemical Engineering, 2005, 13(1): 43-47.
[4] 张帆, 吴嵘, 吴素芳. 水热沉淀法制备NiO-CaO/Al2O3复合催化剂及其在ReSER制氢中的应用[J]. 高校化学工程学报, 2014, 28(5): 985-991.
ZHANG F, WU R, WU S F. Preparation of a NiO-CaO/Al2O3sorption complex catalyst by hydrothermal precipitation method and its application in ReSER process [J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(5): 985-991.
[5] 林启睿, 许增栋, 吴素芳. 纳米钙基吸附剂脱碳强化生物乙醇蒸汽重整制氢工艺[J]. 高校化学工程学报, 2018, 32(1): 161-167.
LIN Q R, XU Z D, WU S F. Hydrogen production via sorption enhanced steam reforming of bio-ethanol using nano Ca-based adsorbents [J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(1): 161-167.
[6] BENITEZ-GUERRERO M, VALVERDE J M, PEREJON A,. Low-cost Ca-based composites synthesized by biotemplate method for thermochemical energy storage of concentrated solar power [J]. Applied Energy, 2018, 210(1): 108-116.
[7] WU S F, LI Q H, KIM J N,. Porperties of a nano-CaO/Al2O3CO2sorbent [J]. Industrial & Engineering Chemistry Research, 2008, 47(1): 180-184.
[8] MACKENZIE A, GRANATSTEIN D L, ANTHONY E J. Economics of CO2capture using the calcium cycle with a pressurized fluidized bed combustor [J]. Energy & Fuels, 2007, 21(2): 920-926.
[9] HU Y C, LIU W Q, CHEN H Q,. Screening of inert solid supports for CaO-based sorbents for high temperature CO2capture [J]. Fuel, 2016, 181(10): 199-206.
[10] MANOVIC V, ANTHONY E J, LONCAREVIC D. CO2looping cycles with CaO-based sorbent pretreated in CO2at high temperature [J].Chemical Engineering Science, 2009, 64(14): 3236-3245.
[11] JING J Y, ZHANG X W, LI Q,. Self-activation of CaO/Ca3Al2O6sorbents by thermally pretreated in CO2atmosphere [J]. Applied Energy, 2018, 220(1): 419-425.
[12] WU S F, ZHU Y Q. Behavior of CaTiO3/nano-CaO as a CO2reactive adsorbent [J]. Industrial & Engineering Chemistry Research, 2010, 49(6): 2701-2706.
[13] HYUNG J Y, KI B L. Introduction of chemically bonded zirconium oxide in CaO-based high-temperature CO2sorbents for enhanced cyclic sorption [J]. Chemical Engineering Journal, 2019, 355(1): 850-857.
[14] PING H L, WANG Y, WU S F. Preparation of MgO-coated nano-CaO using adsorption phase reaction technique for CO2sorption [J]. RSC Advances, 2016, 47(6): 41239-41246.
[15] SUN J, GUO Y F, YANG Y D,. Mode investigation of CO2sorption enhancement for titanium dioxide-decorated CaO-based pellets [J]. Fuel, 2019, 256(15): 116009-116018.
[16] 唐琪, 吴素芳. CaO含量对纳米CaO/Al2O3吸附剂性能的影响[J]. 高校化学工程学报, 2012, 26(1): 31-36.
TANG Q, WU S F. The effect of CaO content on sorption performance of nano CaO based CO2adsorbent [J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(1): 31-36.
[17] MANOVIC V, ANTHONY E J. Thermal activation of CaO-based sorbent and self-reactivation during CO2capture looping cycles [J]. Environmental Science & Technology, 2008, 42(11): 4170-4174.
[18] SANCHEZ-JIMENEZP E, VALVERDE J M, PEREZ-MAQUEDA L A. Multicyclic conversion of limestone at Ca-looping conditions: The role of solid-sate diffusion controlled carbonation [J]. Fuel, 2014, 127(7): 131-140.
[19] STENDARDO S, ANDERSEN L K, HERCE C. Self-activation and effect of regeneration conditions in CO2-carbonate looping with CaO-Ca12Al14O33sorbent [J]. Chemical Engineering Journal, 2013, 220(3): 383-394.
[20] LAN P Q, WU S F. Mechanism for self-reactivation of nano-CaO-based CO2sorbent in calcium looping [J]. Fuel, 2015, 143(3): 9-15.
[21] 史余耀, 兰培强, 王燕, 等. 钙基吸附剂中纳米CaO与CO2反应动力学模型的改进[J]. 高校化学工程学报, 2015, 29(1): 96-101.
SHI Y Y, LAN P Q, WANG Y,. Modified kinetics model of nano CaO reactions with CO2in a CaO-based adsorbent [J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(1): 96-101.
[22] MANOVIC V, ANTHONY E J, GRASA G,. CO2looping cycle performance of a high-purity limestone after thermal activation/doping [J]. Energy & Fuels, 2008, 22(5): 3258-3264.
[23] VALVERDE J M, SANCHEZ-JIMENEZ P E, PEREJON A,. Constant rate thermal analysis for enhancing the long-term CO2capture of CaO at Ca-looping conditions [J]. Applied Energy, 2013, 108(8): 108-120.
[24] LIU X T, MA X X, HE L,. Effect of pre-calcination for modified CaO-based sorbents on multiple carbonation/calcination cycles [J]. Chinese Journal of Chemical Engineering, 2017, 25(7): 1412-1421.
[25] PING H L, WU S F. CO2sorption durability of Zr-modified nano-CaO sorbents with cage-like hollow sphere structure [J]. ACS Sustainable Chemistry & Engineering, 2016, 4(4): 2047-2055.
[26] LIU H, PAN F F, WU S F. The grain growth mechanism of nano-CaO regenerated by nano-CaCO3in calcium looping [J]. RSC Advances, 2019, 46(9): 26949-26955.
[27] LIU H, WU S F. Preparation of high sorption durability nano-CaO−ZnO CO2adsorbent [J]. Energy & Fuels, 2019, 33(8): 7626-7633.
Effect of solid-phase reaction on self-reactivation of nano-calcium-based CO2adsorbents
LIU Hao, WU Su-fang
(College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China)
The microstructure and self-reactivation performance during 20 calcium-looping cycles of nano-CaO and its synthetic adsorbents doped with MgO, Al2O3, TiO2and ZrO2were compared for studying the effect of solid-phase reaction between dopants and CaO on the self-reactivation process of nano-CaO-based adsorbents. The results show that the solid-phase reaction in the heat pretreatment stage increased the compactness of the initial microstructure of adsorbents, which could improve the self-reactivation of adsorbents. Moreover, the migration of calcium titanium salt to the surface of CaO grains’ aggregates could prevent secondary coalescence, avoid the loss of newly increased active specific surface area and improve the self-reactivation stability of adsorbents.
CO2adsorption; calcium looping; nano CaO; self-reactivation; stability
TQ115
A
10.3969/j.issn.1003-9015.2021.01.007
1003-9015(2021)01-0057-08
2020-05-15;
2020-08-08。
国家自然科学基金(21276234)。
刘昊(1993-),男,辽宁葫芦岛人,浙江大学博士生。
吴素芳,E-mail:wsf@zju.edu.cn
