光学相干断层扫描血管成像技术观察糖尿病性视网膜病变及糖尿病性黄斑水肿患者视网膜血流变化
2021-03-19王韩影王晴仪邢馨丹沈胤忱
王韩影,蒋 炎,王晴仪,石 新,牛 田,邢馨丹,沈胤忱,陈 翀,刘 堃
上海交通大学附属第一人民医院眼科,国家眼部疾病临床医学研究中心,上海市眼底病重点实验室,上海市眼视光及光医学工程研究中心,上海市眼科疾病精准诊疗工程技术研究中心,上海200080
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病引起的主要眼部并发症[1],是工作人群的首要致盲性眼病[2]。根据DR临床表现分为非增殖性糖尿病性视网膜病(non-proliferative diabetic retinopathy,NPDR)、增殖性糖尿病性视网膜病(proliferative diabetic retinopathy,PDR)以及糖尿病性黄斑水肿(diabetic macular edema,DME);其中,PDR及DME被认为是DR最主要的致盲原因[3]。目前已明确的DR危险因素包括糖尿病的类型、病程、高血糖、高血压以及高血脂状态等[3]。
光学相干断层扫描(optical coherence tomography,OCT)是目前临床广泛应用的眼科检查手段,用于识别DR 形态学特征,如黄斑水肿、视网膜内囊样水肿以及视网膜下液等;此外,OCT 可以识别视网膜内层和外层结构的破坏。视网膜外界膜和椭圆体带的完整性[4-6]、光感受器外层节段的厚度[7]、视锥细胞外节末梢的状态[5]、视网膜内高反光点[8]以及视网膜下液[9]均可能是与视力相关的因素。视网膜内层结构紊乱(disorganization of retinal inner layers,DRIL)被证明可作为评估DR 患者视力结局的影像学生物标志物[10]。它与视网膜中心凹厚度、血糖水平等相比,与患者视力水平的关系更加密切,并且早期DRIL范围的变化可用于预测较长期的视力结局。
光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)技术可以检测毛细血管的灌注情况,提供视网膜血管网络三维图像。许多OCTA血流检测指标均已应用于DR 研究,如中心凹无血管区(foveal avascular zone,FAZ)、血流密度和血管分形维数(fractal dimension,FD)[11]。有研究[12]发现FAZ 面积、FD、血流密度和深层毛细血管丛可以预测DR 的发生,而血流密度和浅层毛细血管丛与DME 的发生相关。在国内,仅有极少量针对OCTA 标志物与NPDR 或DME 之间关系的研究,且这些研究样本量较小,考虑因素较为单一[13-14]。
本研究通过对DR 患者影像学数据进行分析,寻找不同疾病进程患者之间的影像学差异,并进一步以DME 存在与否为因素进行分组,探究与DME 发生相关的影像学危险因子,期望找到可以用于预测DME 和DR 发生、发展的相关因素,并对其可能的机制进行探讨。
1 对象与方法
1.1 研究对象
收集2017 年8 月—2019 年11 月于上海交通大学附属第一人民医院眼科就诊的90 例患者的临床信息及影像学资料。所有参与研究的患者均确诊为糖尿病,并且曾经或正在服用至少1种糖尿病药物。受试者均经散瞳眼底检查后诊断为DR。由临床技师使用彩色眼底照相(Zeiss Visucam 500 眼底照相机,Carl Zeiss Medite,德国)记录全部受试者眼底影像(标准七象限彩色眼底照片);由眼科医师进行糖尿病视网膜病变早期治疗研究(early treatment of diabetic retinopathy study,ETDRS) 眼底评分[15]。定义双眼中病程进展较快的一只眼为研究眼。如双眼病情一致,则随机选择任一眼别(Randbetween 函数生成随机数,Microsoft®Excel,版本16.16.8)。排除标准包括非糖尿病性视网膜病变或视网膜变性、青光眼、活动性眼部炎症以及影响眼底检查的角膜疾病和白内障。研究通过上海交通大学附属第一人民医院伦理委员会审批,审批号为2017KY194。
1.2 信息收集
受试者签署知情同意书后,填写基本信息,包括姓名、性别、出生日期、身份证号码、联系方式、身高、体质量和疾病病史。糖化血红蛋白(glycosylated hemoglobin,HbA1c)、C 反应蛋白、血清总胆固醇、三酰甘油、肌酐、尿酸、尿素的测定值均来自每名受试者的电子病历记录(最接近填表日期的记录)。高血压、冠状动脉疾病和血脂异常的病史基于对患者的面对面询问及电子病历记录。
1.3 图像采集
所有图像均由经验丰富的临床技师采集。使用OCT(Spectralis OCT,Heidelberg Engineering,Inc.,德国)对受试者双眼黄斑区进行扫描(97线扫描模式)。对于每只研究眼,评估黄斑中心凹1 mm 直径区域内的视网膜厚度,存在DME、视网膜层内囊样水肿、视网膜下液及DRIL 则进行记录。DME 定义为黄斑中心凹1 mm 直径区域内的视网膜厚度,男性≥305 μm,女性≥290 μm[16]的黄斑水肿;或黄斑中心凹1 mm 直径区域内出现囊样水肿和/或视网膜下液。DRIL 定义为在黄斑中心凹1 mm 区域内,有50%的面积无法区分视网膜内层中任意两层之间的界限。所有OCT 扫描都要求信号强度至少达到5。运动伪影、中心位置不佳、数据丢失或分割错误的OCT 扫描不采用。使用OCTA(PTVue XR,Optovue,Inc.,美国)获得双眼眼底血管(6 mm×6 mm 扫描模式)扫描图像,获得的OCTA 图像通过内置软件自动分割浅层毛细血管丛和深层毛细血管丛:浅层毛细血管区域设定在内界膜至内丛状层上10 mm 处;深层毛细血管扫描从内丛状层上10 mm 处开始至外丛状层下10 mm 结束。图像需满足以下条件:①质量评分不低于6分。②组织层分割准确。③图像清晰,微毛细血管网可区分。④图像中心位置无偏离。⑤图像无运动伪影。⑥深层毛细血管网上无投影伪影。
1.4 数据管理
保存所有患者的原始资料,并在病例报告表中记录有关的影像学检查数据、实验室检查数据、眼科检查数据等内容。采用电子数据捕获系统(http://www.linktree.vip/)进行录入。
1.5 统计学分析
采用IBM SPSS statistics version 26(IBM 公司,美国)软件进行统计学分析。定量数据采用例数、均数(或中位数)、标准差进行描述。年龄、血清总胆固醇、尿酸、视网膜厚度、FAZ 及血流密度符合正态分布,以-x±s的形式表示,使用t检验进行2组间比较,使用方差分析进行多组间比较;非正态分布数据(HbA1c、C反应蛋白、血清三酰甘油、尿素、肌酐和黄斑中心凹厚度)以中位数(四分位数间距)的形式表示,通过Wilcoxon 秩和检验进行2 组间比较,通过Cruskal-Wallis 秩和检验进行多组间比较;糖尿病病程为非正态分布数据,但以-x±s的形式表示。定性数据(性别、眼别、用药和疾病百分比)采用频数、构成比或百分比描述,使用χ2检验或Fisher 精确概率法等方法分析。采用Logistic 多因素分析模型进行关于DR 严重程度的独立影响因素的筛选。P<0.05表示差异有统计学意义。
2 结果
2.1 DR进展相关因素分析
共采集了90 例DR 患者的临床信息。根据入组患眼ETDRS 评分[15],将所有患者分为轻度、中度、重度NPDR 及PDR 共4 组。除肌酐外,4 组之间在人口统计学或基本临床特征上比较,差异无统计学意义。PDR 组患者的肌酐值显著高于轻度、中度、重度NPDR 组(P=0.034,P=0.002,P=0.043),各NPDR 组患者之间的差异无统计学意义(表1)。
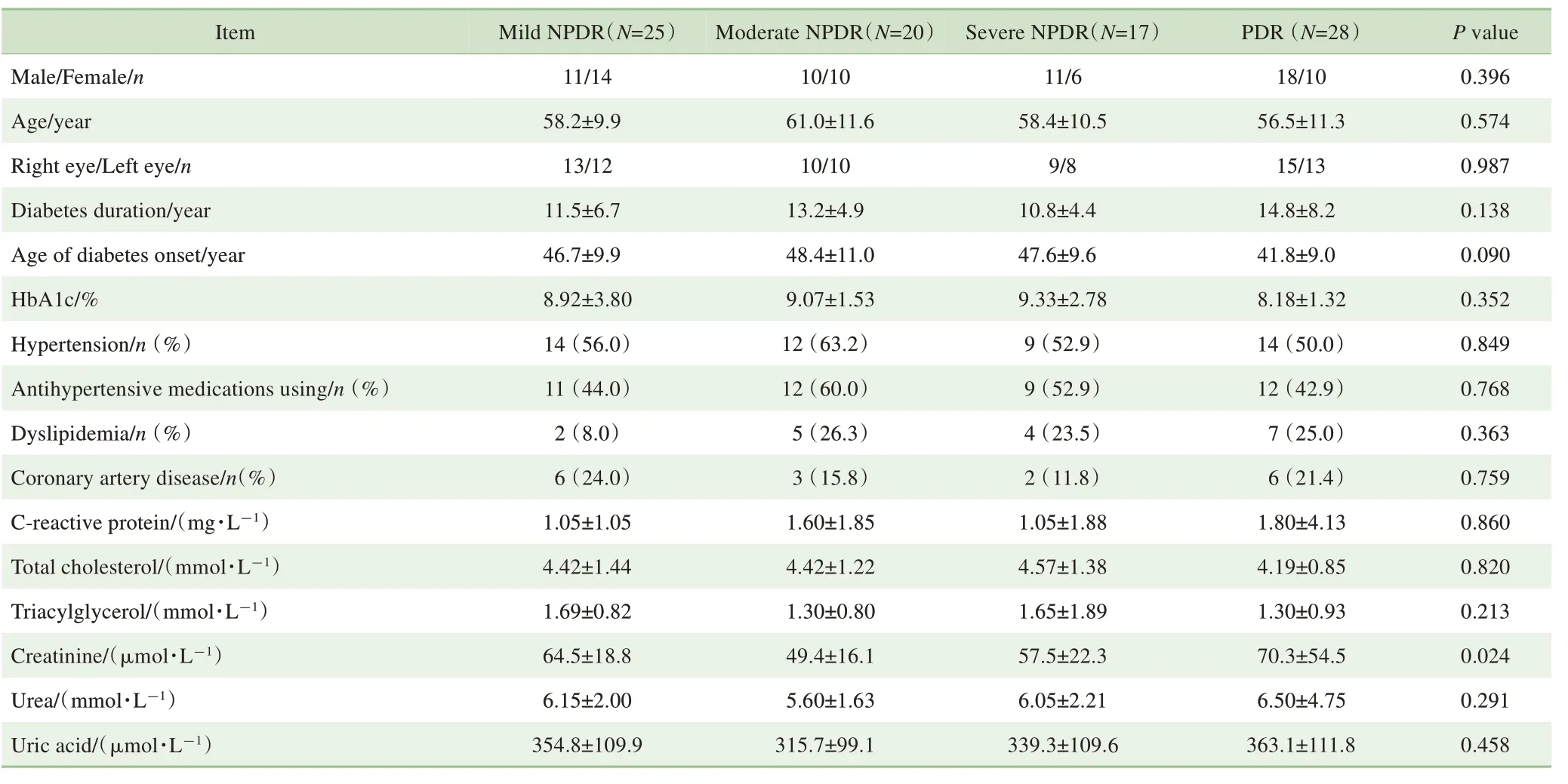
表1 受试者基本临床资料Tab 1 Basic clinical data of subjects
为初步寻找与DR 严重程度相关的因素,应用OCTA检查中ETDRS 环内各个区域(图1)的视网膜浅层及深层血管血流密度进行统计分析,初步筛选出14 项与DR疾病分期相关因素,如表2 所示。随DR 的严重程度增加,视网膜血流密度整体呈显著减少趋势;且与浅层血管相比,深层血管表现出更大范围的血流密度降低与DR严重程度相关。FAZ与DR的严重程度无明显相关性。
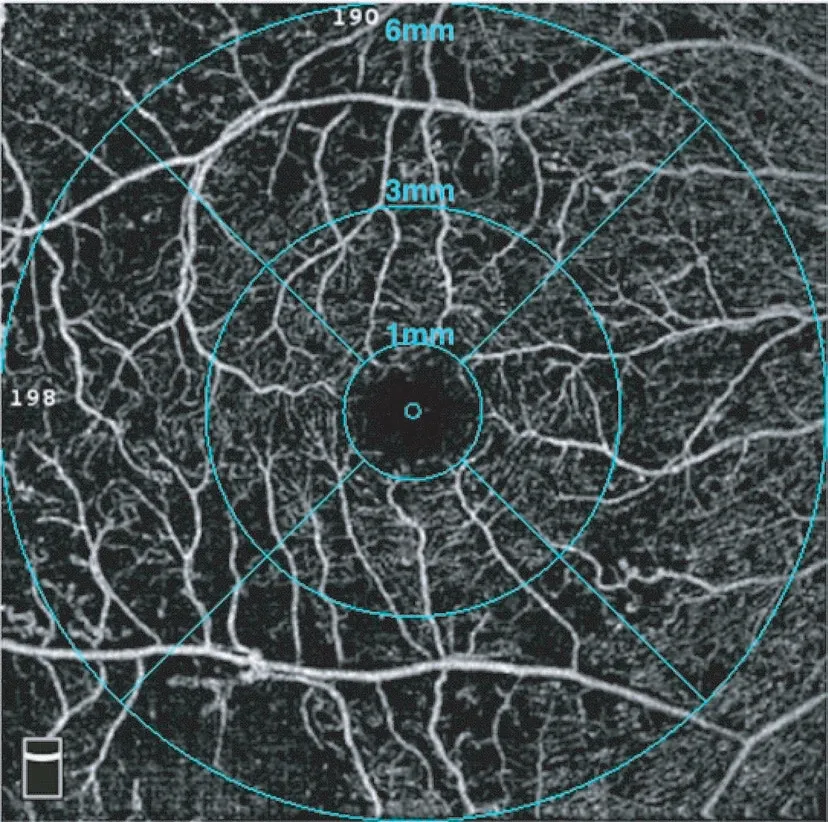
图1 OCTA内的ETDRS环Fig 1 ETDRS macular grids in OCTA
为进一步筛选与DR 严重程度相关的独立危险因素,将血流密度结合临床相关危险因子如糖尿病病程、糖尿病发病年龄、HbA1c、尿酸、尿素、高血压、高血脂和心血管疾病病史,建立有序Logistic 回归模型。因组间基线肌酐值有显著差异,亦将肌酐加入模型,排除其混杂因素。Logistic 回归模型伪R2(McFadden R2)值为0.105,表示该模型可以解释DR严重程度改变的10.5%。
分析结果显示:糖尿病发病年龄低、视网膜深层血流密度降低是DR 严重程度的危险因子,而无高血脂为DR进展的保护因素(表3)。
2.2 DME发生相关因素分析
以DME 存在与否对全部受试者进行分组。90 例患者中,有DME 者57 例,无DME 者33 例。如表4 所示,2组DR 等级的分布比较,差异有统计学意义(P=0.004);在其他人口统计学和基本临床信息上比较,差异无统计学意义。进一步利用OCT 影像对不同DR 分期的受试眼DME 相关特征进行比较,包括视网膜厚度、视网膜下液及囊样水肿有无。结果显示:不同分期DR 中DME 出现比例的差异有统计学意义(P=0.004);由轻度NPDR 至PDR,黄斑中心凹平均厚度逐渐增加(P=0.033)(表5)。视网膜层间囊样水肿在4组间的出现频率比较,差异也有统计学意义,较重的DR(重度NPDR 及PDR)存在囊样水肿的可能性更大。
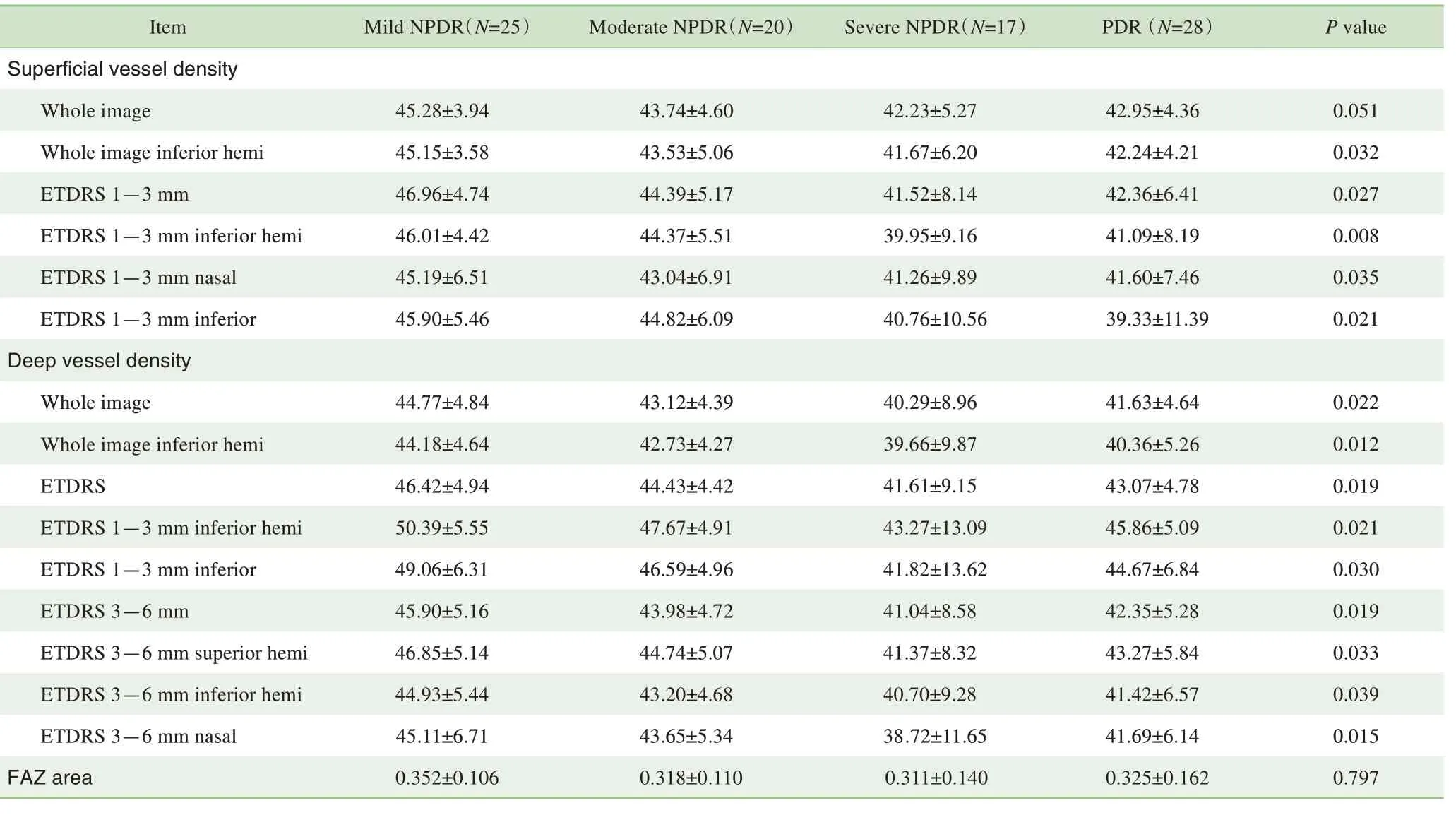
表2 影像学特征与DR等级的相关性Tab 2 Correlation between imaging features and DR stages
对受试者OCT 特征进行分析发现,DRIL 的发生与DME 具有相关性;视网膜层间囊样水肿、视网膜下液以及视网膜增厚的发生率在组间比较,差异均有统计学意义(均P=0.000)(表6)。利用二元Logistic回归对视网膜血流分析发现:浅层、深层视网膜血流密度,围绕FAZ区域300 μm 宽度内的中心凹血管密度(FD-300)以及FAZ 面积与DME 均无相关性(表6)。将糖尿病病程、HbA1c、高血压、高血脂和心血管疾病病史加入Logistic回归方程,将DR 等级作为混杂因素进行调整后,并未发现上述因素与DME相关。

表3 有序Logistic回归分析结果Tab 3 Results of ordinal Logistic regression analysis

表4 有无DME的受试者的基本资料比较Tab 4 Comparison of basic data of subjects with and without DME
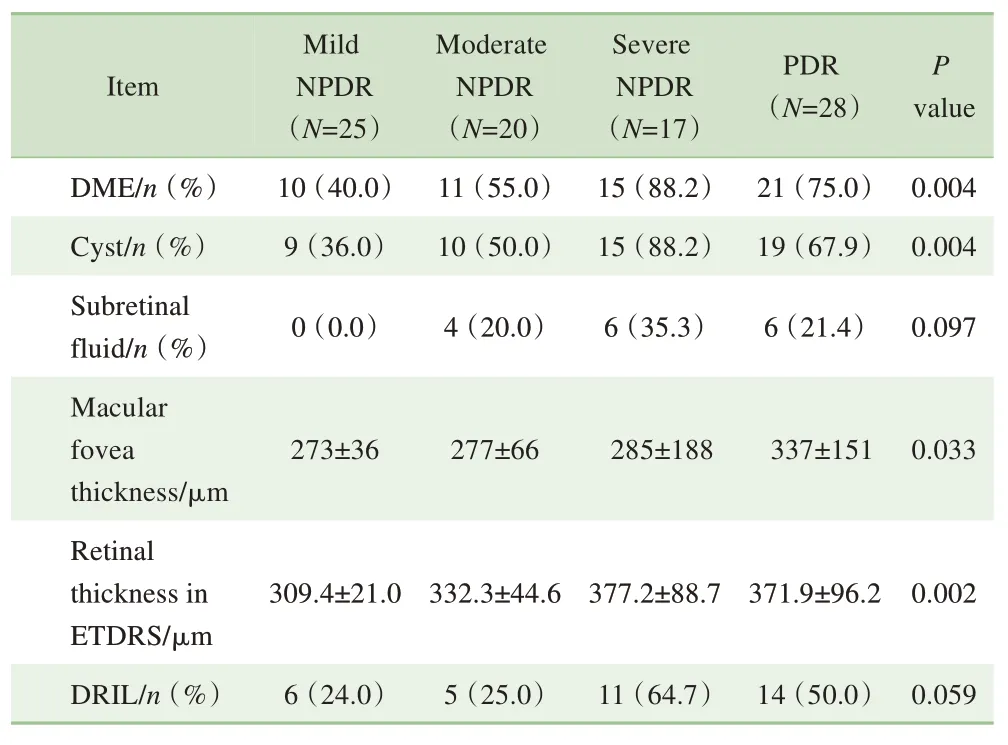
表5 DME相关影像学特征与DR分期的相关性Tab 5 Correlation between DME-related imaging features and DR stages
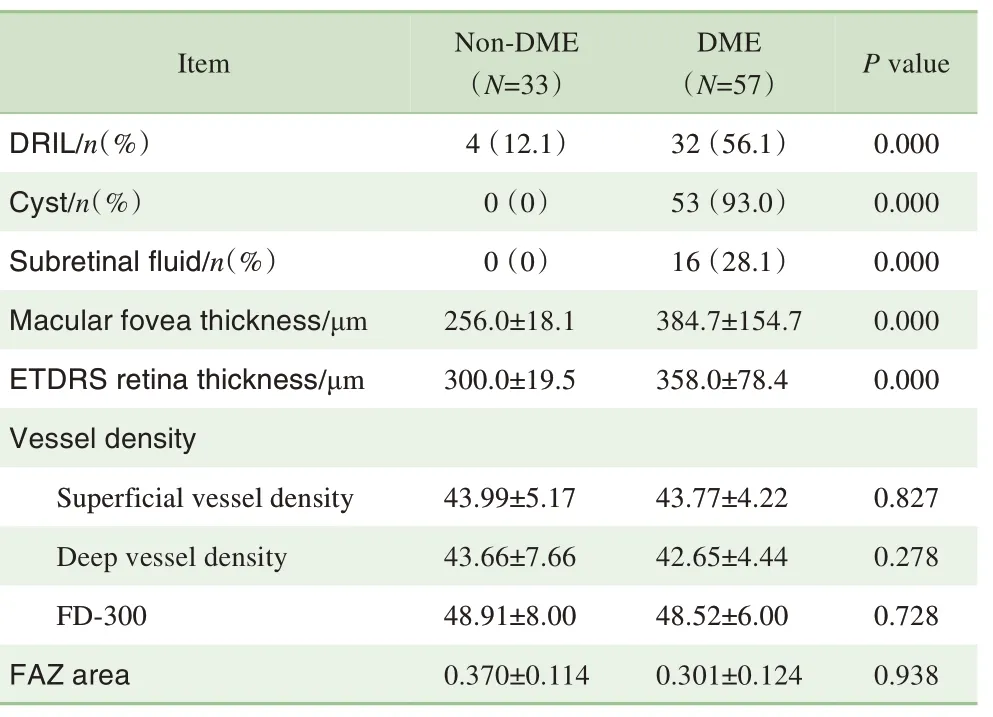
表6 影像学特征与DME的相关性Tab 6 Correlation between imaging features and DME
3 讨论
本研究通过对90 例DR 患者的基本临床信息及OCT、OCTA数据的分析发现,糖尿病发病年龄、视网膜深层血流密度与DR 进展的严重程度呈负相关;而高血脂与DR的严重程度呈正相关;未发现OCTA 血流变化与DME 的发病有相关性;DRIL 的出现与DME 密切相关,且DME发生的概率随着DR严重程度增大而增加。
目前已有大量关于DR 危险因子的临床研究,其中,糖尿病的发病年龄与DR 有密切关系。在1 型糖尿病中,关于发病年龄对DR 患病率的影响,有多种结论。有研究认为DR 发生概率与糖尿病的患病年龄呈负相关[17],15岁以上发病的患者更易发展至晚期DR[18];Hietala 等[19]认为15~40岁发生1型糖尿病的人群比5~14岁发病人群的PDR 风险更高;而Kullberg 等[20]报道,15~19 岁发生糖尿病的人群DR 的发病率为48%,但在30~35 岁发病则DR 发病率下降至30%。相比之下,研究[21]发现对于2型糖尿病,31~45 岁确诊的患者较其他年龄段患DR 的风险更高。在本研究中,未对患者糖尿病的分型进行筛选,全部受试者的平均糖尿病确诊年龄为35.7~55.7 岁,且并未涉及未成年受试者。我们发现在这个范围内,糖尿病发病年龄越低,则患者进展为晚期DR 的可能性越大,该结果与以上关于1 型和2 型糖尿病患者DR 患病率的研究结果一致。研究[22-24]显示,其他因素包括HbA1c、糖尿病病程、高血压和高血脂均为DR 以及DME 的危险因子。在本研究中,发现高血脂与DR 的病情加重相关,但并未识别出其他因素对DR 以及DME 的影响。一方面这些患者均已在入组前接受糖尿病治疗,HbA1c 浓度已在控制中;另一方面,部分患者糖尿病病程、高血压和高血脂有无是根据患者回忆或自述进行记录,回忆偏倚可能对结果造成一定的影响。
在OCTA 的成像中,视网膜浅层毛细血管丛位于视网膜神经纤维层和神经节细胞层,中间毛细血管丛和深层毛细血管丛分别位于内核层的内、外边界处[25-26],而中间毛细血管丛和深层毛细血管丛由于在结构上距离极其微小且血管形态相近,经常同归类为深层毛细血管复合体[27]。本研究中关于深层血管的分析,准确描述应为对深层毛细血管复合体的研究。早前通过眼底荧光血管造影进行的研究发现DR患者FAZ面积扩大,并认为该特征是DR 发生与发展的危险因素[28]。一项利用OCTA 指标对DR 的进展和DME 的发生进行探索的前瞻性研究[12]表明,FAZ 面积、视网膜深层血管丛的血流密度减小可以预期DR 的进展,而浅层血管丛的血流密度减小与DME 发生密切相关。相同的是,本研究也发现了OCTA中视网膜深层血流密度减少可能是DR 进展的危险因子。也有临床研究发现视网膜浅层血流密度与深层血流密度同时随着DR 的进展而减少,且深层血管的血流密度变化在分辨患者的进展程度中敏感度更高。Onishi 等[29]也观察到DR 中深层的血流急剧下降而浅层的血流相对维持的现象。本研究发现,与浅层血管相比,与DR 严重程度相关的血流密度下降在深层血管中涉及的范围更大。若将本研究中较重的DR(重度NPDR 和PDR)人群与较轻的DR(轻度NPDR 和中度NPDR)人群相比较,仅有深层血流密度的减小有显著差异(P=0.028),而浅层血流密度在2组人群中的差异无统计学意义(P=0.057)。这也从侧面证实了深层血流密度改变对DR 进展的指示更具敏感性,深层血流的改变可能是导致DR 发展的主要原因。这一结果在组织学研究[27]中亦得到证实,80%的微血管瘤位于视网膜的内核层,即视网膜深层血管发生损伤的概率更大。
关于DR 血流密度改变的研究发现,DR 伴随DME 患者较DR 不伴随DME 患者深层及浅层血流密度均显著减小[29],且伴有FAZ的明显扩大[30]。在正常情况下,浅层血管产生的液体分布于视网膜间质组织内,Müller细胞进行水转运并主要由深层血管丛吸收,当液体的产生与流出不平衡时即出现视网膜血管性的黄斑水肿[31]。因此,如果浅层血管的血-视网膜屏障破坏导致产生超过排出能力的液体量,或Müller 细胞功能异常、深层血管损伤造成水转运障碍均可以导致DME的产生。有横断面研究[12]发现DME 患者的深层血管血流密度显著减少,支持了深层血管损伤的理论。但前瞻性研究[12]表明,OCTA 中浅层血管灌注显著减少是DME 的危险因子。Fayed等[32]发现全视网膜激光光凝后,浅层血管的FD 明显提高,血管弯曲度下降,侧面反映了浅层血管在DME 中的重要性。但在本研究中,并未发现与DME 相关的视网膜血流改变指标,2组患者FAZ面积也无显著差异。国内已有的相关研究也并未发现DME 与无DME 人群之间深层、浅层毛细血管血流密度有显著差异[14]。因此,目前考虑该结果可能与样本人群选择及研究样本量有关。
另外,本研究发现DRIL 与DME 密切相关。DRIL 是视网膜结构(内丛状层、内核层和外丛状层)的紊乱,即位于这些区域的无长突细胞、双极细胞和/或水平细胞的轴突和细胞核结构紊乱或遭到破坏。当视网膜水肿,厚度超过弹性极限,双极细胞轴突断裂,而这种双极细胞的破坏可能不是完全可逆的,可能可以解释部分患者DME消退但视力仍恢复不理想[33]。
本研究分析了患者基础情况对DR 影像学结果的影响,在排除了潜在混杂因素影响的基础上,筛选出与DR相关的特征性影像学改变,局限性在于考察的OCTA 检测指标较少。今后,可以进一步细化分析深、浅层血管FAZ 的区别,纳入更多指标如FD、血管弯曲度等,更全面地探索与DR 严重程度以及DME 相关的潜在的影像学生物标志物。未来可扩大样本量,考虑更多因素与影像学改变之间的关系,如DR 患者的视力、微视野、全身代谢性因素等。
综上所述,本研究主要利用OCT和OCTA探究DR及DME 相关的结构特征,并发现糖尿病的发病年龄、高血脂以及视网膜深层血流密度减少可能为预测DR 进展的独立危险因子,但并未发现OCTA 中血流密度变化与DME的发生相关。
