垂体腺苷酸环化酶激活肽38对急性放射性心肌损伤的防护作用
2021-03-19易培强陈培战陈佳艺
李 欢,易培强,苏 筠,陈培战,许 赬,曹 璐,陈佳艺,李 敏
1.上海交通大学医学院附属瑞金医院肿瘤放射治疗科,上海200025;2.上海交通大学医学院附属瑞金医院北院中心实验室,上海201801
放射治疗是恶性肿瘤综合治疗不可或缺的组成部分。据报道,约52.3%的肿瘤患者在其肿瘤诊治过程中需要进行放射治疗[1]。放射治疗相关正常组织损伤是肿瘤多学科综合治疗中的重要临床问题。放射性心脏疾病(radiation-induced heart disease,RIHD)已成为胸部恶性肿瘤放射治疗远期非肿瘤死亡的主要原因之一,常发生于霍奇金淋巴瘤[2-3]和早期乳腺癌[4-5]这些有较长生存期和随访时间的患者。随着放射治疗技术的快速发展,现代是以调强技术为主流的放射治疗时代,心脏及其亚结构的受照剂量明显下降。但是,在平衡肿瘤靶区剂量覆盖和最大限度地降低心脏受照剂量时,放射性心脏毒性仍是重要的关注点。
心脏的所有亚结构,包括心包、心肌、心瓣膜、传导系统和冠状动脉都有可能受到放射损伤[6]。放射相关心脏疾病类型主要包括冠状动脉粥样硬化性心脏病、心包疾病、瓣膜性心脏病、心力衰竭、心律失常、心肌病等。目前,对于RIHD的治疗通常遵循常规心脏疾病患者的管理标准。由于放射性心肌损伤的潜伏期可长达10~20年,发现症状时多数情况下心脏已有器质性的变化。目前的药物干预无法达到预期的治疗效果,且尚无成熟的预防放射性心肌损伤的药物。所以亟需探究放射性心肌损伤的发生、发展过程,开发药物,预防、修复和治疗放射治疗对心脏的损伤。
垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase-activating polypeptide,PACAP)是一种最初从羊的下丘脑获取的神经生物多肽。由于其在进化过程中结构高度保守,PACAP 被认为是血管活性肠多肽/生长激素释放激素/胰高血糖素超家族的祖先分子,具有PACAP38和PACAP27 2 种生物活性形式[7]。据报道[8],PACAP38是一种具有抗凋亡、抗炎与抗氧化作用的多功能生物活性肽。在心脏中,PACAP 具有正向肌力及舒张血管等作用;在心肌细胞中,PACAP 具有减轻蒽环类药物诱导的细胞凋亡与氧化应激性损伤的作用。本研究中,探讨PACAP38 对放射性心肌损伤的防护作用,为针对RIHD新型多肽类靶向药物治疗的转化研究提供实验基础。
1 材料与方法
1.1 实验材料
1.1.1 实验用细胞株 H9C2 大鼠心室肌母细胞(CRL-1446) 购自美国模式培养物集存库(American type culture collection,ATCC),应用DMEM 培养基,补充10%的胎牛血清(fetal bovine serum,FBS)和1%的青霉素-链霉素双抗在37 ℃、95%空气、5%CO2条件下培养。
1.1.2 实验动物 C57BL/6J 雄性小鼠(20~25 g,6~8周)购于上海斯莱克实验动物有限责任公司,在上海嘉定区育成中心上海君伯生物科技有限公司饲养。动物生产许可证号为SCXK(沪)2017-0005,使用许可证号为SYXK(沪)2018-0003。饲养条件为SPF 级,保持12 h的昼夜节律,温度适宜(22~27 ℃),湿度适宜(40%~60%)。所有动物实验流程按照上海交通大学医学院附属瑞金医院实验动物管理条例进行。
1.1.3 主要试剂和仪器 PACAP38 (A1439,美国Sigma-Aldrich),FBS(16000044,美国Gibco),胰蛋白酶含EDTA (25200056,美国Gibco),二甲基亚砜(D2650,美国Sigma-Aldrich),青霉素-链霉素双抗(15140122,美国Gibco),DMEM 培养基(SH30243,美国Hyclone),TRIzol 试剂(15596026,美国Invitrogen),增强型CCK-8试剂(C0042,上海碧云天),苏木精-伊红(hematoxylin and eosin,H-E)染液(G1005,武汉谷歌生物);医用直线加速器(Trilogy,美国Varian),倒置荧光显微镜(Axio Vert A1,德国Carl Zeiss)。
1.2 实验方法
1.2.1 体外心肌细胞辐照模型的构建 H9C2心肌细胞随机分为6 组:对照组[磷酸盐缓冲液(phosphate buffer saline,PBS)]、PACAP38 (10-7mol/L) 单 独 处 理 组、PACAP38(10-9mol/L)单独处理组、辐照(irradiation,IR)组(加PBS)、IR+PACAP38(10-7mol/L)组、IR+PACAP38(10-9mol/L)组。细胞照射(12 Gy)前2 h,各组细胞给予PACAP38(10-7或10-9mol/L)或等体积无菌PBS预处理。PACAP38的剂量选择(10-9和10-7mol/L)参照本课题组前期研究结果[9]。
应用医用直线加速器的X 射线构建体内外心脏辐照模型,剂量仪为PTW UNIDOS(德国),放射治疗计划系统为Eclipse 13.6。根据细胞培养皿中培养基与顶盖之间存在气体的特征,首先在Eclipse 计划系统建立细胞照射虚拟模型,设定30 cm×30 cm 的照射野,源皮距(source skin distance,SSD) 100 cm,射线能量6 MV,剂量率3 Gy/min,机臂180°向上,培养皿下放置1 cm 有机玻璃板作为补偿物,上方放置5 cm 有机玻璃板作为散射体。
1.2.2 CCK-8 实验检测细胞活性 制备密度为1 000/mL的细胞悬液进行细胞铺板,于照射前2 h 给予PACAP38或PBS 处理细胞,随后给予12 Gy 的细胞辐照。照射后48 h,各孔加入10 µL CCK-8 试剂混匀,置于细胞培养箱,继续孵育2 h。各组孵育时间保持一致。应用酶标仪在450 nm测定吸光度。
1.2.3 克隆形成实验 细胞铺板数随辐照剂量的增大而增加,细胞辐照剂量依次为0、2、4 和8 Gy 组,铺板细胞数依次为500/0 Gy 组,1 000/2 Gy 组,2 000/4 Gy 和8 000/8 Gy 组。细胞辐照前2 h 给予PACAP38 或PBS 处理细胞,随后给予细胞照射。辐照后将细胞放入37 ℃培养箱培养2 周。2 周后依次经过无菌PBS 洗涤、多聚甲醛固定15 min、1%结晶紫染色20 min、流水洗涤及空气干燥。倒置显微镜下观察并计数细胞数≥50 的克隆数。计算细胞贴壁率,为对照组集落数与细胞种植数的比值。计算细胞存活率,为实验组集落数与细胞种植数和贴壁率乘积的比值。以辐照剂量为横坐标,细胞存活率(survival fraction,SF)为纵坐标,绘制不同处理组的剂量效应曲线,即细胞存活曲线;利用GraphPad Prism 5.0c 软件,采用单击多靶模型进行曲线拟合。方程式为SF=1-(1-e-KD)n。其中,n 为外推数,也称为靶数,即细胞内所含放射敏感区域数;K 为1/D0,是与射线质及细胞敏感性相关的常数;D 为细胞辐照剂量。
1.2.4 动物心脏辐照模型的构建 将48只雄性C57BL/6J小鼠分成4 组:溶剂对照组、PACAP38 对照组、IR 组、IR+PACAP38 组,每组各12 只小鼠。对于需经PACAP38处理的小鼠,在辐照前2 h、辐照后24 及48 h 分别给予10µg PACAP38(100µL)腹腔注射;溶剂对照组给予相同体积和次数的生理盐水腹腔注射。辐照后继续正常饲养,1个月后脊椎脱臼法处死小鼠获取标本。
小鼠心脏辐照同样是在医用直线加速器上进行,心脏辐照的条件如下:射线能量6 MV;剂量/分次为14 Gy/1 Fx;剂量率为300 cGy/min;SSD 为100 cm;补偿1 cm固体水;照射野为1 cm×1 cm。照射野的位置主要依据预实验时对小鼠胸部解剖,明确心脏相对于体表的位置。将小鼠用4%水合氯醛(0.1 mL/10 g)催眠小鼠,然后用强力胶带固定四肢和尾巴于固体水上,用线将门齿牵拉固定,注意力度,确保小鼠呼吸通畅。
1.2.5 H-E 染色 将心脏组织固定于4%多聚甲醛24 h 以上,随后经过浓度梯度乙醇脱水、浸蜡,进行石蜡包埋、切片烤片。H-E染色前先进行切片脱蜡,然后将脱蜡至水的切片放入苏木精染液中浸染3~8 min 以染细胞核;随后将切片置于伊红染液中浸染1~3 min,目的是浸染细胞质;最后进行脱水封片,脱水透明后晾干,中性树胶封片。通过显微镜镜检,观察各组心脏组织病理学改变,图像采集并标注分析。
1.3 统计学分析
应用GraphPad Prism 5.0c进行统计学分析,两独立样本均数比较应用非配对t 检验,3 个及以上样本均数比较应用单因素方差分析和Bonferroni的多重比较。实验数据表示为xˉ±s。P<0.05表示差异具有统计学意义。
2 结果
2.1 PACAP38 干预对辐照诱导的H9C2 心肌细胞毒性的防护作用
CCK-8 实验检测细胞活性的改变,结果如图1 所示:辐照48 h 后,IR 组H9C2 细胞活性[(83.67±0.78)%]较对照组细胞显著下降(P=0.000);在辐照前给予PACAP38 预处理有效逆转了辐照诱导的细胞活性下降,10-7与10-9mol/L PACAP38 处理后细胞活性分别为(98.63±2.70)%和(92.57±0.82)%,与IR 组的差异有统计学意义(P=0.000,P=0.014);PACAP38 单独处理组的细胞活性未见明显改变。
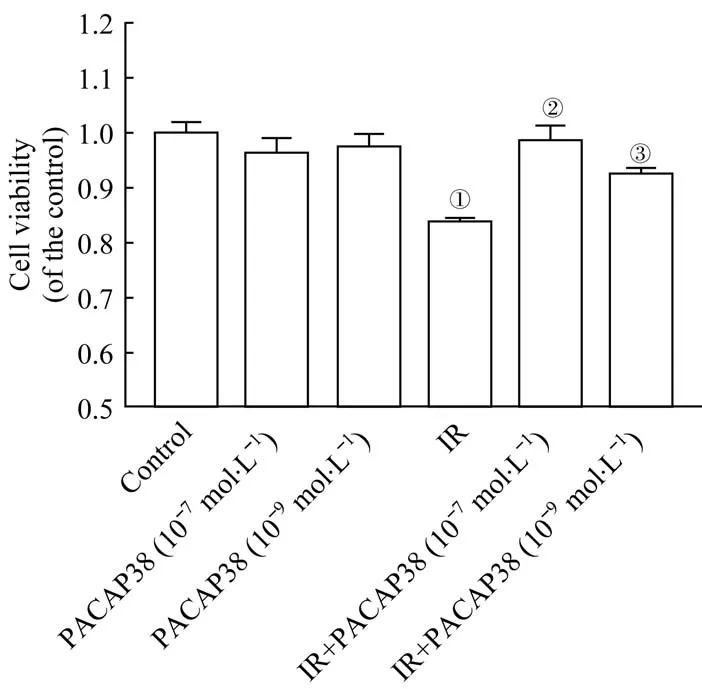
图1 PACAP38对辐照诱导的H9C2心肌细胞毒性的防护作用Fig 1 Protective role of PACAP38 against IR-induced cytotoxicity in H9C2 cells
2.2 PACAP38干预对H9C2心肌细胞辐照敏感性的影响
IR+10-9mol/L 和IR+10-7mol/L PACAP38 处 理 组 经 过辐照(0、2、4、8 Gy)后细胞克隆形成能力明显提高。以照射剂量为横坐标,细胞SF 为纵坐标,绘制不同处理组的剂量效应曲线,即细胞存活曲线。采用单击多靶模型进行曲线拟合,结果如图2 所示。2 Gy 时的细胞SF(SF at 2 Gy,SF2)在10-9和10-7mol/L PACAP38 预处理后从0.53 增加至0.63 和0.70,放射增敏比(sensitization enhancement ratio,SER)在10-9和10-7mol/L PACAP38处理组分别为0.95 和0.91。PACAP38 干预对平均致死剂量D0及准阈剂量Dq的影响如表1 所示:10-9和10-7mol/L PACAP38 干预后D0及Dq均提高,提示PACAP 干预降低了心肌细胞的辐照敏感性。
2.3 PACAP38干预对辐照小鼠心肌组织病理损伤的缓解作用
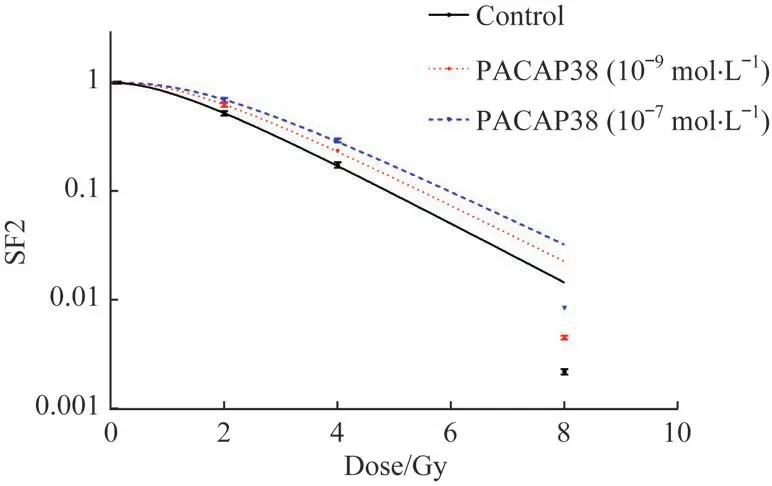
图2 PACAP38干预对H9C2心肌细胞SF2的影响Fig 2 Effect of PACAP38 intervention on SF2 of H9C2 cells
通过对小鼠心肌组织H-E 染色发现,PACAP38 干预可以显著改善辐照诱导的心肌组织病理损伤,如图3 所示。与溶剂对照组小鼠相比,IR 组小鼠的左心室心肌组织呈现明显的损伤性病变,包括心肌细胞变性、嗜酸性增强、细胞质空泡化、细胞核固缩及心肌纤维扭曲;而在IR+PACAP38 组,上述急性损伤性组织病理改变得到明显改善。
表1 PACAP38对H9C2心肌细胞辐照敏感性的影响(s)Tab 1 Effect of PACAP38 on radiosensitivity of H9C2 cells(±s)
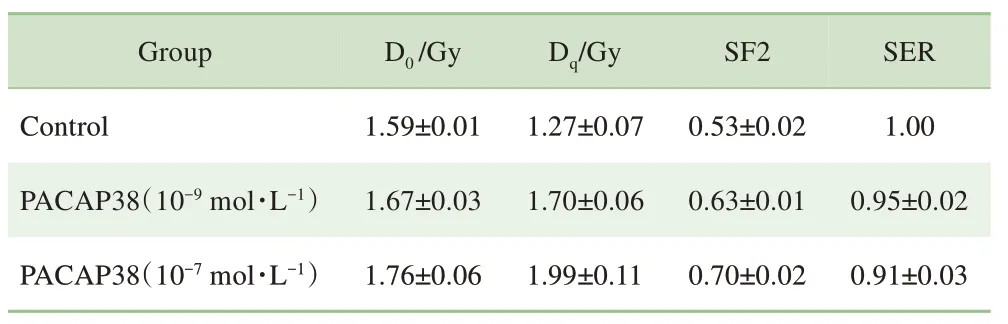
表1 PACAP38对H9C2心肌细胞辐照敏感性的影响(s)Tab 1 Effect of PACAP38 on radiosensitivity of H9C2 cells(±s)
Group D0/Gy Dq/Gy SF2 SER Control PACAP38(10-9 mol·L-1)PACAP38(10-7 mol·L-1)1.59±0.01 1.67±0.03 1.76±0.06 1.27±0.07 1.70±0.06 1.99±0.11 0.53±0.02 0.63±0.01 0.70±0.02 1.00 0.95±0.02 0.91±0.03
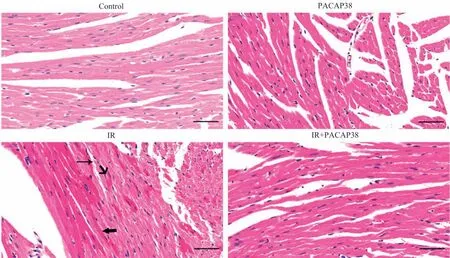
图3 PACAP38干预对辐照小鼠心肌组织的保护作用(H-E染色,×400)Fig 3 Protective effect of PACAP38 treatment on myocardial tissue after irradiation(H-E staining,×400)
3 讨论
RIHD 的发生随着随访时间的延长而增多,并且在一定程度上抵消胸部肿瘤放射治疗的生存获益。来自早期乳腺癌临床试验协作组的一项meta 分析显示,术后放射治疗可使乳腺癌患者的15年乳腺癌死亡风险降低5%,但是发生致死性心血管事件的相对风险却增加27%[5]。随着现代放射治疗技术的快速发展,心脏受照剂量和体积明显下降,但是仍不能降至零;并且随着乳腺癌大分割及肺癌立体定向放射治疗的应用,心脏受照的剂量体积模式发生了改变,呈现高剂量小体积及低剂量大体积共存的现象。只要有剂量就会有损伤,所以亟需发掘新的保护策略抵抗放射性心肌损伤。既往在探索RIHD的临床治疗药物方面有过多次尝试。例如氨磷汀,1995 年被美国食品药品监督管理局批准为放射保护剂[10];但是,由于其会引起严重的恶心、呕吐及低血压等不良反应,并未在临床常规应用[11]。血管紧张素转化酶抑制剂也被报道过,有望成为降低放射性心肺损伤的治疗药物;但是,缓激肽积累引起的血管性水肿、低血压及干咳等不良反应限制了其应用[12]。因此,亟需发掘有效但无毒的药物,预防和治疗放射性心肌损伤。
PACAP 作为一种内源性生物多肽,由于其在进化过程中保持高度保守的结构,被认为是血管活性肠多肽超家族的祖先分子[7]。PACAP 包括2 种生物活性形式,即PACAP38 和PACAP27(分别包括38 或27 个氨基酸),而PACAP38 约占总数的90%。PACAP38 是一种天然多效生物活性肽,在缺血缺氧后组织损伤的早期修复中起重要作用[13]。基于PACAP38 的抗炎、抗凋亡和抗氧化活性,PACAP38 被认为具有重要的细胞保护作用。在心脏整体功能中,有研究[8]发现PACAP干预后具有正向肌力、正向变时及舒张血管等作用。在心肌细胞中,有研究[14]发现PACAP 干预后可显著缓解蒽环类化学治疗药物诱导的心肌细胞凋亡与氧化应激损伤。PACAP的作用通过3种G蛋白相关受体介导——血管活性肠肽受体1(vasoactive intestinal peptide receptor 1,VPAC1)、VPAC2 和垂体腺苷酸环化酶激活肽受体1 (pituitary adenylate cyclaseactivating polypeptide receptor 1,PAC1),其中PAC1 受体是PACAP 特异性受体。通过与受体结合进一步触发第二信使信号转导级联反应,促进Bcl-2 的表达,阻断细胞色素C 的释放,抑制Caspase 的活化[14]。PACAP 还可以激活PI3K/Akt 通路,进而抑制Bax、c-Jun 等促凋亡因子的表达,进而发挥抗凋亡的细胞保护作用[15]。
在本研究中,首先构建了体内外心脏辐照模型,体外心肌细胞辐照剂量为12 Gy。参考相关文献[16-17]中的数据,心肌细胞的辐照剂量梯度分布在0、2、4、8、10、12、16 Gy;当辐照剂量为12 Gy 时,心肌细胞存在明显的辐照损伤特征,并且损伤可被逆转修复[16]。Lauk等[18]在体内研究中发现,啮齿动物在心脏辐照剂量为10 Gy及以上时表现出明显的放射性心肌损伤的特征。啮齿动物辐照剂量梯度分布在0、10、14、18、20 Gy[17,19-20]。本研究中,动物辐照剂量选择14 Gy,后续研究将增加多个剂量梯度进一步验证。通过体内心脏辐照模型研究,发现PACAP38 可以有效修复小鼠心脏组织放射性病理损伤。通过体外细胞辐照模型,我们发现PACAP38 可以降低辐照诱导的心肌细胞毒性,降低心肌细胞的辐照敏感性;但对于其作用机制是否与抑制细胞凋亡及氧化应激损伤相关,尚需进一步探究。研究结果将有助于开发新的治疗策略,干预胸部肿瘤放射治疗相关的心肌损伤。而且,有必要开展进一步的动物实验,探究PACAP38 对放射性心肌损伤的长期作用,包括早期损伤与晚期损伤,加速临床转化的进展。另外,RIHD 的发生涉及冠状动脉、心包、心肌、瓣膜、传导系统等多种心脏亚结构。在本研究中,我们主要探究了PACAP38 对心脏的主要亚结构——心肌的保护作用。PACAP38 对其他心脏亚结构的保护作用及其分子机制仍有待进一步研究。
综上所述,本研究结果表明,PACAP38 在体内外对急性放射性心肌损伤具有一定的预防作用,表现为降低心肌细胞的辐照敏感性及细胞毒性,逆转辐照诱导的小鼠心肌组织病理损伤。PACAP38 在体内外心脏辐照模型中展现出来的心肌细胞保护作用,为其成为RIHD 无毒、有效的保护策略提供了实验依据。未来还需要深入开展转化研究,评估其药效学和治疗效果。
